Výskyt latentní asymptomatické celiakie u žen se sníženou plodností
The incidence of latent asymptomatic celiac disease in women with decreased fertility
Objective:
To determine whether patients with recurrent spontaneous abortions and IVF suffer from latent celiac disease.
Design:
Perspective study.
Settings:
Department of Gynecology and Obstetrics and Faculty Hospital, Charles University, Pilsen.
Material and methods:
Sera from 442 infertile patients aged 23–47 years and 86 healthy fertile controls aged 22–38 years were examined by commercial ELISA sets for the presence (absence) of antibodies against gliadin IgG, IgA and tissue transglutaminase in IgG and IgA.
Results:
We found a statistically significant difference between the control group and patients with decreased fertility. They have a positive values in anti-tissue transglutaminase IgA (p = 0.0096). Frequent, very low positive reaction of antigliadin IgG was also found in the control group of women.
Conclusion:
Patients with unexplained repeated miscarriages and repeated unsuccessful IVF with IgA positive tissue transglutaminase have new complement of other tests for autoimmunity and examination of a total IgA, and gastroenterological examination. Eleven patients with significant positive anti-tissue transglutaminase IgA were successfully conceived only under strict gluten-free diet.
Keywords:
infertility – celiac disease – antibodies – gliadin – tissue transglutaminase
Authors:
M. Čedíková 1; Z. Ulčová-Gallová 2,3; K. Bibková 3; Z. Mičanová 3
Authors‘ workplace:
Ústav histologie a embryologie LF UK, Plzeň, přednostka doc. MUDr. M. Králíčková, Ph. D.
1; Gynekologicko-porodnická klinika LF UK a FN, Plzeň, přednosta doc. MUDr. Z. Novotný, CSc.
2; Genetika-Plzeň, s. r. o., ředitel MUDr. P. Lošan
3
Published in:
Ceska Gynekol 2013; 78(3): 247-251
Overview
Cíl studie:
Zjistit, zda pacientky s opakovanými potraty a opakovanými IVF netrpí také latentní asymptomatickou celiakií.
Typ studie:
Perspektivní studie.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF UK a FN, Plzeň, a Genetika, Plzeň.
Metodiky:
Séra 442 pacientek ve věku 23–47 let se sníženou plodností a 86 zdravých fertilních kontrol ve věku 22–38 let jsme vyšetřili komerčními ELISA sety na přítomnost (nepřítomnost) protilátek proti gliadinu IgG, IgA a tkáňové transglutamináze v IgG a IgA.
Výsledky:
Prokázali jsme statisticky významný rozdíl mezi kontrolní skupinou a pacientkami se sníženou plodností v pozitivních hodnotách tkáňové transglutaminázy v IgA (p = 0,0096). Častější, lehce pozitivní reakci antigliadinových protilátek v IgG jsme nalezli i u kontrolní skupiny žen.
Závěr:
U opakovaně potrácejících pacientek a žen po opakovaných, doposud neúspěšných IVF s pozitivními hodnotami tkáňové transglutaminázy IgA doplňujeme další vyšetření celkového IgA a konzultaci u gastroenterologa. Jedenáct pacientek s výraznou pozitivitou proti tkáňové transglutamináze v IgA úspěšně otěhotnělo jen za přísné bezlepkové diety.
Klíčová slova:
infertilita – celiakie – protilátky proti gliadinu – protilátky proti tkáňové transglutamináze
ÚVOD
Celiakie (CD) nebo glutenová (lepková) nesnášenlivost (glutenová enteropatie) patří mezi autoimunitní dědičná onemocnění tenkého střeva. Bílkovina obilí, lepek, pak způsobuje autoimunitní zánět střevní sliznice. Bez léčby – diety sliznice střeva postupně atrofuje a má sníženou absorpční schopnost. Odstranění lepku ze stravy vede k úplné remisi onemocnění. Pacientky doposud bez klinických známek tohoto autoimunitního onemocnění mohou opakovaně potrácet nebo rodit hypotrofické plody. Již dříve bylo prokázáno [např.1–6, 9, 10, 19, 23, 27–29], že glutenovou intoleranci způsobují proteiny z obilovin – glutenin a prolamin; studie [22] molekulárně-geneticky a imunologicky analyzuje glutenové proteiny z různých obilovin a rozebírá jejich odlišnosti ve vztahu k autoimunitní reakci a CD. Ze současného písemnictví [např. 8, 17, 18, 21] vyplývá, že v Evropě a Severní Americe je prevalence CD 1 : 100 a 1 : 300, v samotné České republice se odhaduje na 0,5 %. Bylo však také prokázáno [19, 24], že nemocní s CD mají genetickou predispozici v podobě HLA I. třídy B8, HLA II. třídy DQ2, DQ8, DQw2 velmi často spojenou s dalším autoimunitním onemocněním [např. 11, 14, 15, 25, 26]. Příznaky CD jsou velmi různé, od klasických [6], atypických, silentních a asymptomatických [3] po latentní a možné [9, 30]. Mezi nejčastější příznaky CD patří řídká stolice, bolesti v podbřišku, známky malabsorpce. Většina pacientů však bývá bez těchto klasických příznaků. V případě silentní a atypické formy mohou pacienti být např. více unavitelní, někdy depresivní, ženy mívají problémy s otěhotněním, udržením gravidity, donošením zdravého plodu [11, 12–15, 16]. U pacientek s CD se mohou objevit i jiné nepravidelnosti, např. zpožděná menarche nebo amenorea, časná menopauza, v reprodukčním období pak častější potraty nebo se u jejich plodů objevuje růstová intrauterinní retardace (tab. 1) [7, 11, 14, 21]. Vedle základních klinických symptomů CD jsou důležité i sérologické markery tohoto onemocnění. Běžně se zjištují protilátky proti gliadinu, tkáňové transglutamináze, protilátky proti endomysiu nebo retikulinu. Tyto testy jsou pro odborníky jen pomocné, doplňkové k imunohistochemické analýze sliznice tenkého střeva. Vancikova a kol. [28] publikovali velmi rozsáhlou českou studii, která sledovala téměř 1900 pacientů s různými diagnózami (zdravé dárce krve, pacienty s primární osteoporózou, s autoimunitním onemocněním, se sníženou plodností) v sérologických parametrech CD. Zjistila až čtyřnásobnou sérologickou pozitivitu u jmenovaných diagnóz proti zdravé skupině dárců krve.
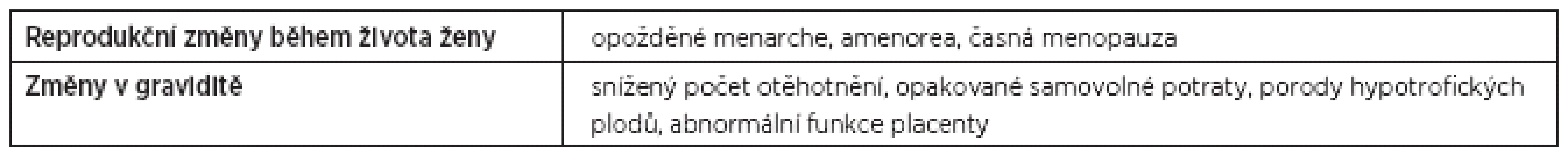
V naší studii jsme se soustředili na náhodně vybrané pacientky po 2–3 spontánních potratech a ženy po opakovaných neúspěšných IVF léčebných cyklech. Vedle rutinních základních testů v reprodukční imunologii jsme se zaměřili i na protilátky proti gliadinu a tkáňové transglutamináze.
SOUBOR A METODIKA
Vyšetřili jsme celkem 442 pacientek ve věku23–47 let (průměrný věk 32,6 let), 275 z nich spontánně potratilo dvakrát a vícekrát, 167 pacientek pak bylo po dvou a více neúspěšných IVF. Všechny ženy v té době navštěvovaly Poradnu pro imunologii reprodukce na Gynekologicko-porodnické klinice LF UK a FN v Plzni. Kontrolní skupina se skládala z 86 zdravých fertilních dobrovolnic ve věku 22–38 let (průměrný věk 24,5 let). Všechny ženy podepsaly informovaný souhlas s tímto vyšetřením. Při podrobné anamnéze žádná ze sledovaných žen neměla subjektivní potíže týkající se CD.
K laboratornímu vyšetření jsme použili komerční ELISA (Tissue Transglutaminase IgA/IgG ELISA Kit a Gliadin IgA/IgG ELISA Kit, Omega) k určení sérových hladin IgA a IgG protilátek proti gliadinu a tkáňové transglutamináze. Statistickou analýzu jsme provedli pomocí χ2 testu.
VÝSLEDKY
Výsledky sérových protilátek proti gliadinu a tkáňové transglutamináze v IgG a v IgA jsou uvedeny v tabulce 2. Zjistili jsme rozdíly mezi oběma skupinami pacientek a kontrolním souborem v hladinách protilátek proti tkáňové transglutamináze v IgA (p = 0,0096**). Významný rozdíl byl i mezi samotnými pacientkami: mezi skupinou žen s opakovanými potraty a ženami po opakovaných IVF (p = 0,0374*), a dále mezi kontrolní skupinou a pacientkami po opakovaných selháních v IVF (p = 0,0303*).
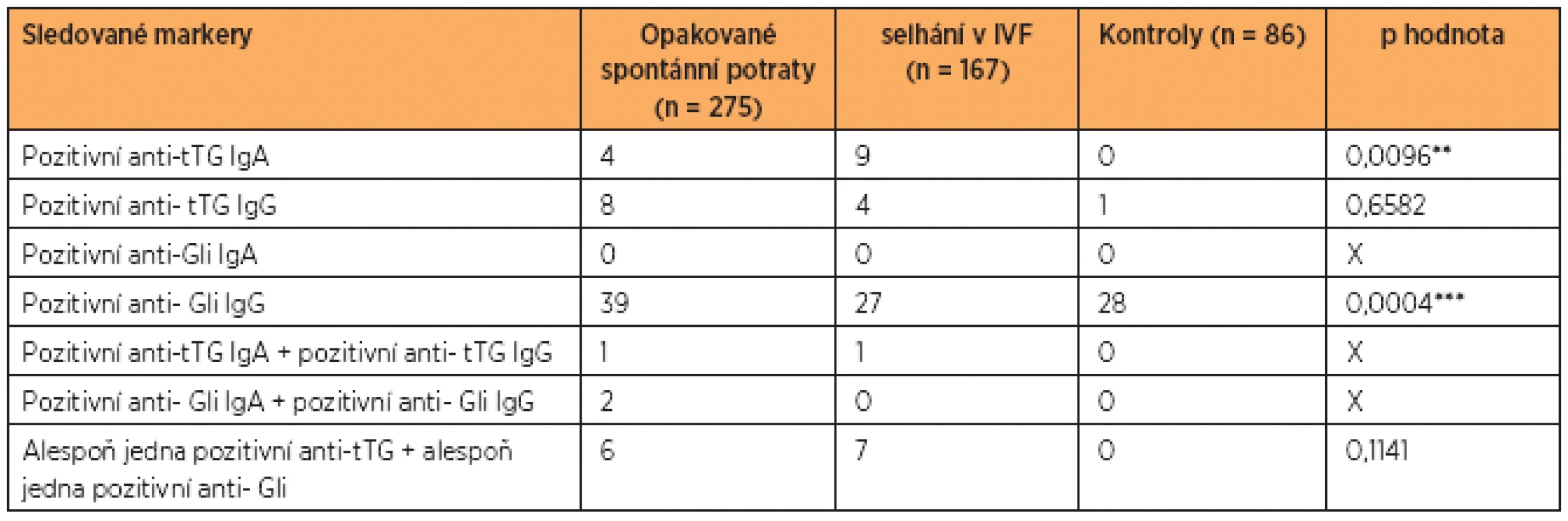
U kontrolní skupiny zdravých fertilních žen jsme zjistili signifikantně vyšší hladiny proti glia-dinu v IgG ve srovnání s ostatními skupinami pacientek (p = 0,0004***). (Statistickou analýzu uvádíme na čtyři desetinná místa na doporučení statistika.)
DISKUSE
Snížená plodnost u žen může být způsobena nejrůznějšími příčinami, izolovanými nebo sdruženými. Imunologická nadstavba snížené plodnosti se velmi často uvádí v podobě abnormalit v buněčné nebo protilátkové odpovědi [např. 12, 13, 25, 26]. Některé studie poukazují na to, že pacientky s CD mají problémy s otěhotněním, udržením časného embrya nebo rodí hypotrofické plody [např. 16]. Rozsáhlá česká studie [28] analyzovala výsledky protilátkových faktorů charakterizujících CD u 1835 dospělých, z nichž bylo 1312 zdravých dárců krve, 102 pacientů s primární osteoporózou, 58 se základním autoimunitním onemocněním a 365 žen se sníženou plodností. Dvojitý screening ukázal velmi pestrý protilátkový obraz proti gliadinu, tkáňové transglutamináze i endomysiu, při čemž latentní CD byla prokázána u 0,45 % zdravých dárců krve, u 0,98 % pacientů s osteoporózou, u 2,7 % s autoimunitním onemocněním a u 1,13 % žen se sníženou plodností. Ukázalo se tedy v této multicentrické české studii, že je zvýšená prevalence séropozitivity CD i u zdánlivě zdravé české populace. U vysoce rizikových skupin pak prevalence séropozitivity v CD je 2–4krát vyšší než u kontrolní skupiny zdravých dárců.
V naší současné studii 442 žen jen 13 pacientek (2,9 %) se sníženou plodností (4 po opakovaných spontánních potratech a 9 po neúspěšných opakovaných IVF) mělo laboratorně vysoké hladiny tkáňové transglutaminázy v IgA, aniž by tyto ženy měly jakékoli klinické gastrointestinální obtíže. Žádná z 13 žen v době laboratorního „podezření“ na CD nepodstoupila histologické vyšetření střevní biopsie. Pacientky ale přistoupily na přísnou bez-lepkovou dietu. Během diety úspěšně otěhotnělo jedenáct pacientek, sedm porodilo zdravý plod, u dalších ještě pokračuje gravidita.
Cena screeningového vyšetřování protilátek proti gliadinu i tkáňové transglutaminázy pomocí ELISA metody se pohybuje mezi 200–400 Kč. Do screeningu celiakie zahrnují některé laboratoře vyšetření protilátek i proti retikulinu, endomysiu. Ani jeden z testů však nemá stoprocentní senzitivitu a specificitu. Vyšetření na protilátky proti gliadinu však má značnou variabilitu, která záleží na purifikaci antigenu navázaného na destičce v systému ELISA metody [20, i vlastní zkušenost]. V současné době se upřednostňuje purifikovaný α-gliadin (vyšší specificita) [20], ale tento antigen jsme neměli možnost v naší studii použít. ELISA testy k detekci protilátek proti α-gliadinu jsou i mnohem dražší (kolem 500–600 Kč).
Vzhledem k vysoce purifikovanému antigenu tkáňové transglutaminázy v systému ELISA je test k vyšetření celiakie daleko citlivější a specifičtější, má přímý vztah k sledovanému latentnímu doposud asymptomatickému onemocnění, je prakticky vyloučena zkřížená imunoreaktivita s jiným epitopem (to u gliadinu nešlo v našem testování vyloučit). Suverénní diagnostickou metodou celiakie je metoda střevní biopsie. Tu ani jedna pacientka v naší studii neměla.
Pravděpodobně i latentní, subklinická CD může participovat na snížené plodnosti. Bylo vysloveno několik hypotéz (lektinová hypotéza, hypotéza o vrozeném deficitu peptidáz, imunologická hypotéza). Všechny se snaží vysvětlit příčinu snížené plodnosti u žen s CD. Jedna z nich se opírá [16] o morfologické změny na sliznici tenkého střeva s atrofií klků, což má pak za následek zhoršené vstřebávání i např. kyseliny listové, železa a vitaminů skupiny B se sekundárními následky snížené plodnosti. Latentní, doposud subklinická CD se zdá být četnější především u žen se sníženou plodností ve smyslu opakovaných těhotenských ztrát ve srovnání se zdravou fertilní populací.
V naší studii jsme zcela náhodně u třinácti pacientek našli pozitivní laboratorní nález směřující k diagnóze celiakie (vysoké hladiny tkáňové transglutaminázy v IgA), doporučili jsme další vyšetření u gastroenterologa. Ten většinou rozšiřuje laboratorní diagnostické spektrum o vyšetření protilátek proti retikulinu a endomysiu. Laboratorní vyšetření ale nikdy nenahradí diagnostickou střevní biopsii. Léčbu pacientek pak zahajujeme společně. Většinou postačí přísná bezlepková dieta, při které dojde k obnovení fyziologických enzymatických pochodů a absorpční činnosti střevní sliznice. V dalším sdělení se budeme zabývat detailním rozborem stavu našich třinácti pacientek, z nichž jedenáct otěhotnělo a zatím sedm úspěšně porodilo zdravý plod.
Práce vznikla s podporou grantu MŠMT ČR MSM 002 162 0812 a GAUKu č. 696212.
Korespondující autorka
Prof. MUDr. Zdenka Ulčová-Gallová, DrSc.
Genetika-Plzeň
a Gynekologicko-porodnická klinika LF UK
Parková IIA
326 00 Plzeň-Černice
e-mail: ulcova-gallova@email.cz
Sources
1. Anderson, C., Townley, RRW., Messer, M., Hubbard, L. Further observations on the relationship of wheat gluten to cœliac disease. Proc R Soc Med, 1962, 55, p. 983–985.
2. Anderson, CM. Histological changes in the duodenal mucosa in coeliac disease: reversibility during treatment with a wheat gluten free diet. Arch Dis Child, 1960, 35, p. 419–427.
3. Bottaro, G., Cataldo, F., Rotolo, N., et al. The clinical pattern of subclinical silent celiac disease: An analysis on 1026 consecutive cases. Am J Gastroenterol, 1999, 94, p. 691–696.
4. Ciclitira, PJ., Johnson, MW., Dewar, DH., Ellis, HJ. The pathogenesis of coeliac disease. Mol Aspects Med, 2005, 26, p. 421–458.
5. Farrell, RJ., Kelly, CP. Celiac sprue. N Engl J Med, 2002, 346, p. 180–188.
6. Fasano, A. Celiac disease – how to handle a clinical chameleon. N Engl J Med, 2003, 348, p. 2568–2570.
7. Freeman, HJ. Reproductive changes associated with celiac disease. World J Gastroenterol, 2010, 16, p. 5810–5814.
8. Fric, P. Celiakální sprue – současnost a perspektiva. Postgrad Med, 2006, 8, p. 588–593.
9. Holmes, GK. Potential and latent coeliac disease. Eur J Gastroenterol Hepatol, 2001, 13, p. 1057–1060.
10. Holtmeier, W., Caspary, WF. Celiac disease. Orphanet J Rare Dis, 2006, 1, p. 3–9.
11. Khoshbaten, M., Rostami, NM., Farzady, L., et al. Fertility disorder associated with celiac disease in males and females: fact or fiction? J Obstet Gynaecol Res, 2011, 37, p. 1308–1312.
12. Kwak-Kim, J., Park, JC., Ahn, HK., et al. Immunological modes of pregnancy loss. Am J Reprod Immunol, 2010, 63, p. 611–623.
13. Kralickova, M., Sima, P., Rokyta, Z. Role of the leukemia-inhibitory factor gene mutations in infertile women: the embryo-endometrial cytokine cross talk during implantatio – a delicate homeostatic equilibrium. Folia Microbiol, 2005, 50, p. 179–186.
14. Kumar, A., Meena, M., Begum, N., et al. Latent celiac disease in reproductive performance of women. Fertil Steril, 2011, 95, p. 922–927.
15. Maki, M., Hallstrom, O., Huupponen, T., et al. Increaased prevalence of coeliac disease in diabetes. Arch Dis Child, 1984, 59, p. 739–742.
16. Meloni, GF., Dessole, S., Vargiu, N., et al. The prevalence of coeliac disease in infertility. Human Reprod, 1999, 14, p. 2759–2761.
17. Mustalahti, K., Catassi, C., Reunanen, A., et al. Coeliac EU Cluster, Project Epidemiology, The prevalence of celiac disease in Europe: results of a centralized, international mass screening project. Ann Med, 2010, 42, p. 587–595.
18. Not, T., Horvath, K., Hill, ID., et al. Celiac disease risk in the USA: high prevalence of antiendomysium antibodies in healthy blood donors. Scand J Gastroenterol, 1998, 33, p. 494–498.
19. Parnel, NDJ., Daniel, Y., Travers, P., et al. Binding of a coeliac toxic peptide, and point substituted analogues, to the disease associated HLA-DQ8 molecule. Gut, 1999, 44, p. A77–78.
20. Rashtak, S., Ettore, MW., Homburger, HA., Murray, JA. Comparative usefulness of deamidated gliadin antibodies in the diagnosis of celiac disease. Clin Gastroenterol Hepatol, 2008, 6, 4, p. 426–432.
21. Rajput, R., Chatterjee, S. Primary infertility as a rare presentation of celiac disease. Fertil Steril, 2010, 94, p. 5–7.
22. Real, A., Comino, I., de Lorenzo, L., et al. Molecular and immunological characterization of gluten proteins isolated from oat cultivars that differ in toxicity for celiac disease. PLoS One, 2012, 7, p. 483–485.
23. Schuppan, D., Junker, Y., Barisani, D. Celiac disease: from pathogenesis to novel therapies. Gastroenterology, 2009, 137, p. 1912–1933.
24. Shidrawi, RG., Parnell, ND., Ciclitira, PJ., et al. Binding of gluten-derived peptides to the HLA-DQ2 (alpha1*0501, beta1*0201) molecule, assessed in the cellular assay. Clin Exp Immunol, 1998, 111, p. 158–165.
25. Ulcova-Gallova, Z., Krauz, V., Novakova, P., et al. Anti-phospholipid antibodies against phosphatidylinositol, and phosphatidylserine are more significant in reproductive failure than antibodies against cardiolipin only. Am J Reprod Immunol, 2005, 54, p. 112–117.
26. Ulcova-Gallova, Z. Repeated miscarriages in patients with antiphospholipid syndrome and subjected to in vitro fertilization: the importance of preimplantation genetic diagnosis. Lupus, 2012, 21, p. 744–746.
27. Vader, LW., Stepniak, DT., Bunnik, EM., et al. Characterization of cereal toxicity for celiac disease patients based on protein homology in grains. Gastroenterology, 2003, 125, p. 1105–1113.
28. Vancikova, Z., Chlumecky, V., Sokol, D., et al. The serologic screening for celiac disease in the general population (blood donors) and in some high-risk groups of adults (patients with autoimmune diseases, osteoporosis and infertility) in the Czech Republic. Folia Microbiol, 2002, 47, p. 53–58.
29. Walter-Smith, JA., Guandalini, S., Schmitz, J., et al. Revised criteria for diagnosis of coeliac disease. Arch Dis Child, 1990, 65, p. 909–911.
30. Weinstein, WM. Latent celiac sprue. Gastroenterology, 1974, 66, p. 489–493.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2013 Issue 3
-
All articles in this issue
- Peripartální kardiomyopatie po císařském řezu – kazuistika
- Dysfunkce endotelu u těhotných s chronickou formou hypertenze
- Vliv ohřátých infuzních roztoků při plánovaném císařském řezu na matku a plod – pilotní randomizovaná prospektivní studie
- Chirurgická léčba gynekologických onemocnění u Svědkyň Jehovových
- Výskyt latentní asymptomatické celiakie u žen se sníženou plodností
- Perzistence užívání léčby hyperaktivního močového měchýře v České republice
- Radioterapie v léčbě karcinomu vulvy
- Expresia karbonickej anhydrázy IX v karcinómoch prsníka
-
Psychosociální klima porodnice očima rodiček II.
Prediktory spokojenosti s perinatální péčí v České republice - Intrahepatální cholestáza v těhotenství
- Stanovení anti-Müllerova hormonu u žen
- Karcinom cervixu – možnosti detekce lidského papilomaviru
- Profylaktické užití antiinfekčních léčiv v porodnictví
- Solitární fibrózní tumor endometria – kazuistika
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Intrahepatální cholestáza v těhotenství
- Stanovení anti-Müllerova hormonu u žen
- Profylaktické užití antiinfekčních léčiv v porodnictví
- Peripartální kardiomyopatie po císařském řezu – kazuistika
