Současná klasifikace zhoubných nádorů v onkogynekologii – část I
Current classification of malignant tumours in gynecological oncology – part I
Objective:
Review of new staging systems for gynaecological cancers and their impact on prognosis and planning treatment.
Design:
Review article.
Setting:
Department of Gynaecology and Obstetrics, First Faculty of Medicine and University Hospital Na Bulovce, Charles University, Prague.
Department of Radiotherapeutic Oncology, First Faculty of Medicine and University Hospital Na Bulovce, Charles University, Prague.
Department of Pathology, University Hospital Na Bulovce, Prague.
Results:
The main objectives of any good staging system – essential to an evidence-based approach to cancer – include planning treatment, providing an assessement of prognosis and the evaluation of the results of treatment. With this approach, the exchange of relevant information between oncological centers is facilitated, thus disseminating knowledge and stimulating research in other parts of the world. A good staging system must have three basic characteristics: validity, reliability, and practicality. The first staging system for gynaecological cancers appeared around the turn of the 20th century and was applied to carcinoma of the cervix uteri. Classifications for the other gynaecological malignancies were not created until the 1950s. Over the years, these staging classifications - with the exception of cervical cancer and gestational trophoblastic neoplasia - have shifted from a clinical to a surgical-pathological basis. Some changes, brought about through new findings, were approved by the FIGO in 2008 and published in 2009. The greatest changes were made in the new staging system for carcinoma of the vulva, while others were made in the new staging systems for carcinoma of the cervix and carcinoma of the endometrium. A new stanging system was also created for uterine sarcomas, based on the criteria used in other soft tissue sarcomas.
Conclusion:
As a result of the explosion of medical research in the field of oncology, the staging of some of the gynaecological cancers became outdated and did not give a good spread of prognostic groupings. Therefore, revised FIGO and TNM staging system has been structured to represent major prognostic factors in predicting patients’ outcomes and lending order to the complex dynamic behavior of gynaecological cancers. The purpose of a good staging system is to offer a classification of the extent of gynaecological cancer, in order to provide a method of conveying one’s clinical experience to others for the comparison of different treatment methods.
Key words:
staging, gynaecological oncology, FIGO, TNM.
:
B. Sehnal 1; Daniel Driák 1
; E. Kmoníčková 2; M. Dvorská 1; M. Hósová 3; K. Citterbart 1; M. Halaška 1; D. Kolařík 1
:
Gynekologicko-porodnická klinika, 1. LF UK a FN Na Bulovce, Praha, přednosta prof. MUDr. M. Halaška, DrSc.
1; Ústav radiační onkologie, 1. LF UK a FN Na Bulovce, Praha, přednosta prof. MUDr. J. Abrahámová, DrSc.
2; Patologicko-anatomické oddělení, 1. LF UK a FN Na Bulovce, Praha, primářka MUDr. K. Benková
3
:
Ceska Gynekol 2011; 76(4): 279-284
Cíl studie:
Přehled nového stagingu u gynekologických karcinomů a jeho vliv na prognózu a plánování léčby.
Typ studie:
Souhrnný přehled.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, 1. LF UK a FN Na Bulovce, Praha; Ústav radiační onkologie, 1. LF UK a FN Na Bulovce, Praha; Patologicko-anatomické oddělení, FN Na Bulovce, Praha.
Metodika a výsledky:
Hlavní cíle kteréhokoliv dobrého stagingového systému založeného na evidence-based medicine zahrnují plánování léčby, poskytují odhad prognózy onemocnění a vypovídají o úspěchu aplikované léčby. Tím také umožňují výměnu relevantních informací mezi onkologickými centry a přispívají k poznávání a výzkumu malignit v rozlišných státech světa. Dobrý stagingový systém by měl mít tři základní charakteristiky – odůvodněnost (na základě poznatků evidence-based medicine), důvěryhodnost a praktičnost (snadno uplatnitelný v praxi). První stagingový systém gynekologických nádorů se objevil na přelomu 20. století a byl vypracován pro karcinom děložního hrdla. Vypracování klasifikace ostatních gynekologických nádorů následovalo v 50. letech minulého století. Během následujících dekád se tyto stagingové systémy s výjimkou cervikálního karcinomu a trofoblastické nemoci přesunuly z klinické na chirurgickou (patologicko-anatomickou) základnu. Na základě nových poznatků byly FIGO v roce 2008 odsouhlaseny některé změny, které byly publikovány v roce 2009. Největší změny byly provedeny u karcinomu vulvy, další u karcinomu děložního hrdla a karcinomu endometria. Nově byl vypracován stagingový systém pro sarkomy dělohy založený na pravidlech platných pro sarkomy jiných měkkých tkání.
Závěr:
V důsledku exploze lékařského výzkumu na poli onkologie zastaraly některé klasifikační systémy v onkogynekologii a přestaly vytvářet skupiny se stejnou prognózou. Proto přepracovaný FIGO a TNM stagingový systém je strukturován tak, aby zahrnul hlavní prognostické faktory vyjadřující prognózu pacienta a vyjádřil ucelenou povahu chování gynekologických zhoubných nádorů. Účelem dobrého stagingového systému je poskytnout klasifikaci možného šíření zhoubného nádoru vycházející z klinické zkušenosti, aby bylo možno srovnat účinnost různých modalit léčby.
Klíčová slova:
staging, onkogynekologie, FIGO, TNM.
ÚVOD
Vypracování stagingového systému a určení stadia maligního onemocnění je jedním ze základních aktivit v onkologii a má zásadní význam v managementu maligních onemocnění. V současné době tuto problematiku zastřešují tři velké organizace – FIGO, UICC a AJCC.
Mezinárodní federace gynekologie a porodnictví FIGO (Fédération Internationale de Gynécologie et d’Obstétrique, The International Federation of Gynecology and Obstetrics) byla založena v roce 1954 v Ženevě a v současnosti shromažďuje odborné gynekologicko-porodnické společnosti ze 124 zemí pěti kontinentů [37]. Vedle svých stěžejních celosvětových projektů – podpory snížení mateřské a novorozenecké mortality, převážně v rozvojových zemích, a zvýšení práv žen v manželství a při pohlavním zneužívání – je jedna z hlavních komisí FIGO zaměřena na onkogynekologii a do jejího portfolia spadají i návrhy změn ve stagingových klasifikacích ženských zhoubných nádorů [37]. Jako vůbec první byl vypracován stagingový klasifikační systém pro karcinom děložního hrdla a poté následovaly stagingové systémy pro další ženské malignity.
TNM systém pro klasifikaci zhoubných nádorů vypracoval Pierre Denoix (Francie) v letech 1943 až 1952 [8]. Mezinárodní výbor proti rakovině (UICC – International Union Against Cancer) založil v roce 1950 Výbor pro nádorovou nomenklaturu a statistiku (Committee on Tumour Nomenclature and Statistics). Po několika změnách názvu tohoto výboru se od roku 1994 jmenuje Výbor pro Projekt – TNM prognostické faktory (TNM Prognostic Factor Project Committee). V roce 1954 UICC se spojil s FIGO do komise pro vytvoření pravidel pro klasifikaci klinického stagingu zhoubných nádorů a prezentaci výsledků léčby. TNM klasifikace (tumor-node-metastasis) pro rakovinu děložního hrdla byla navržena touto komisí v roce 1966, což bylo velké uznání zkušeností a dat získaných pomocí stagingu FIGO. Dosažení všeobecné shody v klasifikaci anatomického rozsahu onemocnění zůstává pro UICC trvalým cílem.
V USA Americký společný výbor pro staging malignit (American Joint Committe for Cancer Staging) a End Results Reporting (dnes známá jako American Joint Committee on Cancer, AJCC) začaly v roce 1959 spolupracovat na vývoji klinického stagingového systému nádorů, který by byl vhodný pro lékaře praktikující ve Spojených státech. Byl navržen systém založený na TNM klasifikaci, v roce 1976 AJCC přijala rozvržení stadií systému gynekologických zhoubných nádorů FIGO [10]. TNM systém je tedy podporován organizacemi UICC a AJCC [34].
Každý dobrý stagingový systém by měl mít 3 základní charakteristiky – měl by být odůvodněný (na základě poznatků evidence-based medicine), solidní (důvěryhodný) a praktický (snadno uplatnitelný v praxi). Platný stagingový systém musí odrážet rozsah klinické manifestace jednotlivých stadií daného typu nádoru. K dosažení tohoto cíle, musí být stagingový systém založen na základě „evidence-based“ znalostí a snadno aplikovatelný v praxi (user-friendly) [25]. Měl by být také založen a revidován na základě nejnovějších poznatků vědy [1, 3]. Na druhé straně, onkologie jednoznačně profituje z široce používaného stagingu, který z podobných skupin pacientů generuje nová data usnadňující další výzkum [22]. Během let se všechny stagingové systémy v onkogynekologii s výjimkou cervikálního karcinomu a trofoblastické nemoci přesunuly z klinické na chirurgickou (patologicko-anatomickou) základnu [8, 23]. Pro jednotlivá stagingová stadia konkrétních nemocí nebyla vytvořena jednoznačná neměnná terapie, ale určitá doporučení léčby, se kterými nemusí být všeobecný souhlas [31]. Jednotlivá stadia dobrého stagingového systému vyjadřují prognózu pacienta a vycházejí z komplexního biologického chování tumoru [1].
Při optimalizování terapie jakéhokoli zhoubného nádoru hrají roli určité faktory: původní (originální) ložisko tumoru, jeho biologické chování a rozsah onemocnění, tedy stadium tumoru [11]. Klasifikace nádoru je rozdělena do 4 stadií na základě klinického a/nebo patologicko-anatomického šíření nemoci: stadium I popisuje tumor, který nepřesahuje orgán svého původu, tedy tumory poměrně malé. Stadium II popisuje šíření nádoru na přilehlé orgány, stadium III zachycuje už pokročilejší stadium nemoci s postižením dalších orgánů, stadium IV reprezentuje vzdálené metastázy [29]. Tato 4 základní stadia se dále dělí do substadií, která lépe odrážejí specifické klinické, patologickoanatomické a prognostické faktory onemocnění [4]. Jedním z hlavních účelů stagingů zhoubných nádorů je zprostředkovat klinické zkušenosti léčby v závislosti na stadiu onemocnění napříč světadíly bez ohledu na rozvinutost a bohatství regionu.
Během posledních 70 let stagingové systémy gynekologických nádorů byly opakovaně upravovány, aby kopírovaly obrovský rozmach v lékařském výzkumu a léčbě, zvláště na poli onkologie [12]. Během posledních 30 let všechny změny ve FIGO klasifikaci byly opakovaně diskutovány Výborem FIGO pro onkogynekologii (FIGO Committee on Gynecologic Oncology) a odsouhlaseny Výborem UICC pro TNM staging, AJCC a WHO. V průběhu let UICC, AJCC a FIGO modifikovaly svoje stagingové systémy gynekologických karcinomů, takže všechny tři klasifikace jsou velmi podobné až identické [11]. V současné době souhlas mezi těmito třemi subjekty zajistil porovnatelnost dat z jednotlivých klasifikačních systémů, přičemž reprezentanti těchto organizací se setkávají každoročně. Součinnost těchto organizací vede k reprodukovatelnosti a srovnání onkologických informací a výsledků léčby napříč vědeckou komunitou celého světa [32].
Další snaha je zaměřena na řešení sporných otázek, jako je přítomnost reziduálního tumoru po léčbě, neboť ten se jeví jako jeden z nejpřesvědčivějších prognostických faktorů po terapii; diskutuje se o možnosti zahrnout do klasifikace způsob šíření nádoru, detekci izolovaných nádorových buněk v regionálních lymfatických uzlinách, krvi, kostní dřeni nebo v jiných biopsiích, respektive využití metody sentinelové lymfatické uzliny [16].
Aby si stagingový systém zachoval svoji odůvodnitelnost, musí být staging přístupný změnám vycházejícím z nových vědeckých poznatků. Věrohodnost by mělo zajišťovat to, aby identickým případům onemocnění byla vždy přiřazena stejná stadia, neměl by být dvojsmyslný. Praktický stagingový systém musí být vhodný a snadno aplikovatelný v různých zemích s rozdílnou úrovní zdravotní péče a s odlišnými možnostmi léčby. Zařazení tumoru do jednotlivých stadií nesmí vyžadovat složitá nebo vysoce specializovaná diagnostická vyšetření, ale takové postupy, které jsou dostupné naprosté většině zdravotnických pracovníků ve světě. V budoucnu jistě budou další změny, které budou pracovat s novými molekulárními markery a mechanismy, které upřesní porozumění dědičným faktorům a genetickým aberacím uplatňujícím se v etiologii a patogenezi jednotlivých nádorů [37]. Zvyšující se povědomí o prognostických skórovacích systémech a jejich širší uplatnění v klinické praxi budou hrát stále větší roli v budoucnosti [36]. Vědci odpovědní za prosazování a navrhování změn a úprav existujících stagingových systémů cítí velkou odpovědnost, aby patřičné změny prováděli prozíravě a na základě vědeckých dat [26].
V letech 2006–2008 se věnovalo mnoho času a pozornosti revizi návrhů stagingových systémů vulvy (poslední revize v roce 1988), karcinomu cervixu (poslední revize v roce 1994) a endometria (poslední revize v roce 1988). Staging ovariálního karcinomu nebyl měněn, ale cílem Výboru FIGO pro onkogynekologii je tento systém zrevidovat a upravit během následujících tří let. Největší změny byly provedeny u karcinomu vulvy, další u karcinomu děložního hrdla a karcinomu endometria, nově byl vypracován stagingový systém pro sarkomy dělohy založený na pravidlech platných pro sarkomy jiných měkkých tkání. Stadium 0 bylo u všech nádorů zrušeno, protože jde o prekancerózu a nikoliv o invazivní nádor.
Proces revize řídil prof. Sergio Pecorelli z Milána, předseda Výboru FIGO pro onkogynekologii. V závěrečné fázi procesu přizval prof. Pecorelli další mezinárodní vědecké společnosti a instituce zabývající se výzkumem a léčbou ženských malignit [30]. Vzniklý konsenzus byl představen na „Ročním setkání TNM UICC Core Group“ v Ženevě na začátku května 2008, kde byl s minimálními změnami schválen i odbornými společnostmi UICC a AJCC. V září 2008 tento dokument obsahující zrevidované stagingové systémy pro karcinom vulvy, děložního hrdla a endometria oficiálně přijal Výkonný výbor FIGO (FIGO Executive Board). Další doplnění, která vyplynula z diskusí a debat mezinárodních expertů, byla publikována jako Special Communication v květnu 2009 [30].
VŠEOBECNÁ PRAVIDLA TNM SYSTÉMU
TNM systém pro popis anatomického rozsahu nemoci je založen na určení tří složek: T – rozsah primárního tumoru, N – přítomnost či nepřítomnost a rozsah metastáz v regionálních lymfatických uzlinách, M – přítomnost či nepřítomnost vzdálených metastáz (mohou to být i vzdálené – neregionální lymfatické uzliny). Přiřazením číslice k těmto třem složkám je udán rozsah onemocnění: T0, T1, T2, T3, T4; N0, N1, N2, N3; M0, M1. Pokud nelze hodnotit primární nádor, regionální lymfatické uzliny nebo vzdálené metastázy, používá se označení TX (pTX), NX (pNX), MX (pMX). Případ pouze s mikrometastázami, tj. žádná z mikrometastáz není větší než 0,2 cm, je možno doplnit označením mi, např. N1(mi) nebo pN2(mi). Při vyšetření sentinelové mízní uzliny se používá následujících označení: pNX(sn)-sentinelovou uzlinu nelze hodnotit, pN0(sn)-v sentinelové uzlině nejsou metastázy, pN1(sn)-metastázy v sentinelové mízní uzlině. Kategorie M1 může být dále specifikována označením lokalizace vzdálené metastázy. Zkratky pro metastázy jsou PUL (plicní), OSS (kostní), HEP (jaterní), BRA (mozkové), LYM (uzlinové), MAR (kostní dřeň), PLE (pleurální), PER (peritoneální), ADR (nadledvinové), SKI (kožní), OTH (jiné) [35].
Jednou stanovená klasifikace TNM a stadium musí zůstat ve zdravotnické dokumentaci beze změny. Existují-li o správném zařazení konkrétního případu do TNM pochybnosti, měla by být zvolená kategorie nižší, tj. méně pokročilá. V případě, že se v jednom orgánu vyskytují současně vícečetné nádory, měl by se klasifikovat nádor s nejvyšší kategorií T a vícečetnost T(m) či počet nádorů by se měl uvést v závorce.
Klinická klasifikace (předléčebná klinická klasifikace), označovaná jako TNM nebo cTNM je založena na nálezech získaných před léčbou. Nálezy se získají na podkladě klinického vyšetření, zobrazovacích vyšetřovacích metod, endoskopie, biopsie, chirurgické explorace a jiných příslušných vyšetření.
Patologická klasifikace (pooperační histopatologická klasifikace), označovaná jako pTNM, je založena na nálezech získaných před léčbou doplněných nebo pozměněných dalšími nálezy, jež byly získány při chirurgickém výkonu a vyšetřením patologickým. K patologickému hodnocení primárního nádoru (pT) je nutná resekce primárního nádoru nebo biopsie dostačující pro stanovení nejvyšší kategorie pT. K patologickému hodnocení regionálních mízních uzlin (pN) je nutné odstranění uzlin v takovém rozsahu, jenž postačí k ověření nepřítomnosti metastáz v regionálních lymfatických uzlinách (pN0) a k hodnocení nejvyšší pN kategorie. K patologickému hodnocení vzdálených metastáz (pM) je nutné histologické vyšetření.
V případech, kdy je klasifikace provedena v průběhu multimodální léčby nebo po ní, se kategorie cTNM či pTNM označí předřazením písmene y. Kategorie ycTNM či ypTNM klasifikuje aktuální rozsah nádoru v době vyšetření. Kategorie y není hodnocením nádoru před multimodální léčbou. Recidivující nádory, jež jsou klasifikovány po předchozím období bez známek choroby, se označují předřazením písmene r (rTNM). Předřazení písmene a se používá, je-li klasifikace poprvé stanovena až při pitvě (aTNM).
C – faktor (z angličtiny certainty factor), faktor diagnostické jistoty, vyjadřuje spolehlivost klasifikace podle použitých diagnostických metod, jeho použití je nepovinné. C1 definuje nálezy ze standardních vyšetřovacích metod (aspekce, palpace, standardní RTG snímkovaní, endoskopie). C2 určuje nálezy získané speciálními vyšetřovacími metodami (CT, MRI, lymfografie, sonografie, scintigrafie, biopsie). C3 charakterizuje nálezy z chirurgické explorace včetně biopsie a cytologie. C4 určuje rozsah onemocnění na základě definitivního chirurgického výkonu a patologického vyšetření resekátu, čemuž odpovídá patologická klasifikace pTNM. C5 značí pitevní nález.
R – klasifikace se zabývá stavem nádoru po léčbě. Odráží výsledky léčby (chirurgické i nechirurgické), ovlivňuje další léčebné postupy a je důležitým prognostickým faktorem. RX - přítomnost reziduálního nádoru nelze hodnotit, R0 - bez reziduálního nádoru, R1 - mikroskopický reziduální nádor, R2 - makroskopický reziduální nádor.
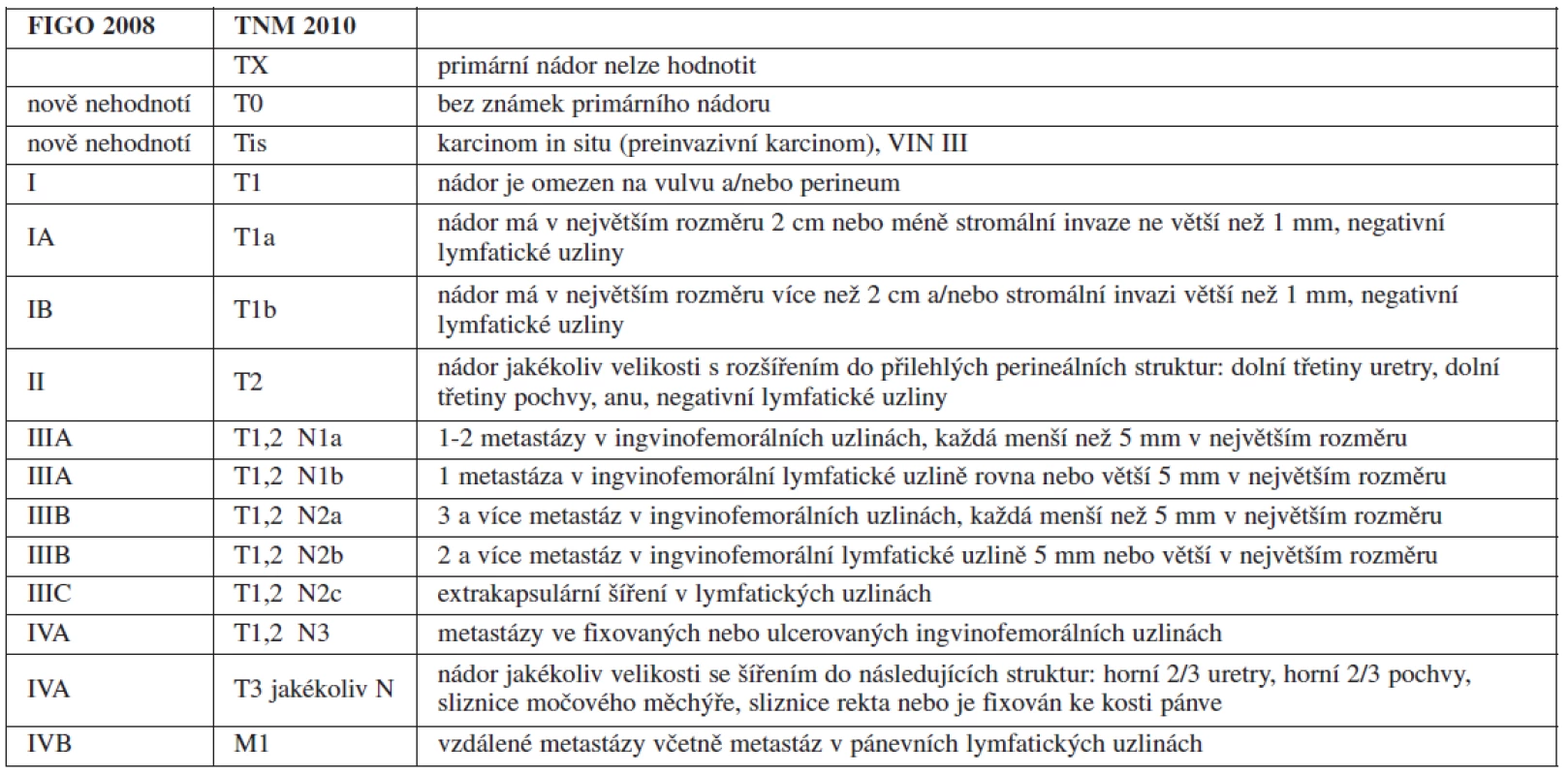
PŘEPRACOVANÝ STAGING PRO KARCINOM VULVY
Incidence karcinomu vulvy se v ČR pohybuje kolem 3-4 případů na 100 tisíc žen a rok. Před 35. rokem života se karcinom vulvy objevuje sporadicky, průměrný věk v době stanovení diagnózy je 65–75 let [7]. Nejčastější maligní nádor vulvy je dlaždicobuněčný karcinom, představuje asi 90 % všech maligních nádorů této oblasti.
V roce 1988 Výbor FIGO pro onkogynekologii (FIGO Committee on Gynecologic Oncology) přijal nový staging pro karcinom vulvy založený na chirurgické (patologicko-anatomické) základně, což byla změna z předchozího stagingu klinického. Dále bylo zohledněno, že postižení regionálních lymfatických uzlin je velmi důležitý prognostický faktor [12, 16, 17] a klinické vyšetření lymfatických uzlin je krajně nespolehlivé [5, 23].
Jednotlivá stadia klinického stagingu odpovídaly daným prognostickým skupinám ve smyslu pětiletého přežití, a to 90,4 % pro stadium I, 77,1 % pro stadium II, 51,3 % pro stadium III a 18,0 % pro stadium IV [14]. Tato čtyři stadia odrážela fakt, že procento pacientů s postižením lymfatických uzlin se zvyšuje s každým stadiem a je 10,7 % ve stadiu I, 26,2 % ve stadiu II, 64,2 % ve stadiu III a 88,9 % ve stadiu IV [14].
V roce 1991 uveřejnil Homesley a kol. retrospektivní analýzu 588 pacientů s vulvárním karcinomem [17]. Do stadia I zařadil 154 pacientek, u kterých zaznamenal pětileté přežití v 98 %. Ve stadiu II (231 pacientek) bylo pětileté přežití u 85 % pacientek, ve stadiu III (141 pacientek) přežilo pět let 74 % osob a ve stadiu IV (62 pacientek) referoval u 31 % pacientek přežití 5 let. Pokud nebyly postiženy lymfatické uzliny, prognóza byla velmi dobrá, a to i u nádorů velikosti v průměru 8 cm. Z těchto údajů vyplynulo, že důležitějším prognostickým faktorem než velikost primárního nádoru je postižení regionálních lymfatických uzlin. To potvrdil i Hacker ve studii, do které byla zařazeno 349 pacientek s primárním nádorem větším než 8 cm v největším rozměru a s negativními lymfatickými uzlinami, když referoval o pětiletém přežití u 88 % pacientek [14]. Stejnou dobu přežití u 121 pacientek ve stadiu I a II karcinomu vulvy zjistil i Tantipalakorn [33].
Jiné analýzy různých skupin GOG (Gynecologic Oncology Group) poukázaly na nedostatek v definici stadia III stagingu z roku 1988. Stadium III zahrnovalo prognosticky velmi rozdílnou skupinu s přežitím v rozmezí mezi 34 % až 100 % [14]. Např. u 6 pacientek s tumorem menším než 2 cm, ale postihujícím pochvu a/nebo uretru všech 6 pacientek přežilo pět let. U jiných 47 pacientek s primárním tumorem menším než 2 cm s jednou pozitivní lymfatickou uzlinou bylo zaznamenáno pětileté přežití v 95 %. Dalších 28 pacientek s tumorem větším než 8 cm a se dvěma pozitivními lymfatickými uzlinami mělo pětileté přežití 34 %. Všechny tyto pacientky byly zařazeny do stadia III. Významným prognostickým faktorem, který nebyl zohledněn, je celkový počet pozitivních lymfatických uzlin a jejich morfologie.
Studie skupin GOG uveřejnily u 385 pacientek s negativními lymfatickými uzlinami pětileté přežití v 90,9 %, u skupiny 125 pacientek s 1–2 pozitivními lymfatickými uzlinami referovaly o pětiletém přežití v 75,2 %, u skupiny 40 pacientek se 3–4 postiženými lymfatickými uzlinami v 36,1 %, u 19 pacientek s 5–6 pozitivními lymfatickými uzlinami ve 24,0 % a ze 16 pacientek se sedmi a více pozitivními lymfatickými uzlinami nepřežil nikdo [18]. Další data ukázala 94% přežití u skupiny pacientek s nepostiženými lymfatickými uzlinami (82 osob) nebo s 1 postiženou lymfatickou uzlinou (16 osob), 80% přežití u pacientek se 2 pozitivními lymfatickými uzlinami a 12% přežití u pacientek se 3 nebo více pozitivními lymfatickými uzlinami [12].
Význam rozměru postižených lymfatických uzlin u karcinomu vulvy nebyl brán v úvahu až do roku 1991, kdy Origoni a kol. uveřejnili data o prognóze přežití v závislosti na velikosti postižených lymfatických uzlin [26]. U metastáz v lymfatických uzlinách do velikosti 5 mm bylo pětileté přežití 90,0 %, u postižení velikosti 5–15 mm 41,6 % a u metastáz nad 15 mm bylo přežití 20,6 % (p=0,01). Tato práce také demonstrovala, že pacientky s extrakapsulárním šířením mají výrazně horší prognózu přežití (25 %) ve srovnání s pacientkami, které mají postižení uzlin bez extrakapsulárního šíření (85,7 %, p=0,0001). Tato data byla poté potvrzena dalšími autory [27, 35].
Poněkud více kontroverzní je závažnost celkového množství postižených lymfatických uzlin jako prognostického faktoru ve srovnání s oboustranným výskytem postižených uzlin. Většina prací poukazuje na fakt, že bilaterální zasažení uzlin není nezávislý prognostický faktor [12, 18, 20, 32], dvě práce toto nepotvrdily [4, 9]. Fons a kol. ve svém souboru 134 pacientek s vulvárním karcinomem ve stadiu III a IVA uvádí, že bilateralita postižení lymfatických uzlin není významným rizikovým faktorem ve vztahu k počtu postižených uzlin [9].
Vzhledem k výše uvedeným faktům prošel FIGO staging karcinomu vulvy pod vedením prof. Neville F. Hackera největšími změnami ze všech gynekologických nádorů [29]. Stadium IA bylo ponecháno beze změny, protože riziko postižení lymfatických uzlin u této skupiny je zanedbatelné. Stadium IB a II bylo spojeno, do stagingu byl zahrnut údaj o celkovém počtu postižených lymfatických uzlin, nikoliv jejich bilateralita (tab. 1).
V budoucnu bude pravděpodobně místo systematické ingvinofemorální lymfadenektomie do stagingu zahrnuto vyšetření sentinelové uzliny a některých molekulárních markerů, což snad pomůže lépe rozčlenit prognostické skupiny.
MUDr. Borek Sehnal
Gynekologicko-porodnická klinika
FN Na Bulovce
Budínova 2
180 00 Praha 8
boreksehnal@seznam.cz
Sources
1. Benedet, JL., Pecorelli, S. Why cancer staging? Int J Gynecol Obstet, 2006, 95, suppl. l, p. 3.
2. Benedet, JL. Conclusions. CME J Gynecol Oncol, 2001, 6, p. 270-273.
3. Benedet, JL. Indroduction. CME J Gynecol Oncol, 2001, 6, p. 229.
4. Bösze, P. Prognostic factors and staging: the role of molecular markers. CME J Gynecol Oncol, 2001, 6, p. 232-234.
5. Burger, MP., Hollema, H., Emanuels, AG., et al. The importance of the groin node status for the survival of T1 and T2 vulval carcinoma patients. Gynecol Oncol, 1995, 57, 3, p. 327‑334.
6. Cavanagh, D., Roberts, WS., Bryson, SC., et al. Changing trends in the surgical treatment of invasive carcinoma of the vulva. Surg Gynecol Obstet, 1986, 162, 2, p. 164-168.
7. Cibula, D., Petruželka, L., et al. Onkogynekologie. 1. vyd. Praha: Grada, 2009, s 343.
8. Denoix, PF. Nomenclature des cancers. 1st ed. Paris: Bull Inst Nat Hyg, 1944, p. 69-73.
9. Fons, G., Hyde, SE., Buist, M., et al. The presence of bilateral positive lymph nodes in squamosus cell cancer of the vulva is not an independent prognostic variable for disease – specific survival. Int J Gynecol Cancer, 2009, 105, p. 103-104.
10. Gospodarowicz, MK., Benedet, L., Hutter, RV., et al. History and international development in cancer staging. Cancer Prev Control, 1998, 2, p. 262-268.
11. Gospodarowicz, MK., Miller, D., Groome, PA., et al. The proces for continuous improvement of the TMN classification. Cancer, 2004, 100, p. 1-5.
12. Hacker, NF., Berek, JS., Lagasse, LD., et al. Management of regional lymph nodes and their prognostic influence in vulvar cancer. Obstet Gynecol, 1983, 61, 4, p. 408-412.
13. Hacker, NF., Berek, JS. Practical gynecologic oncology. 4th ed. Philadephia: Lippincott Williams a Wilkins 2005, p. 543-581.
14. Hacker, NF. Revised FIGO staging for carcinoma of the vulva. Int J Gynaecol Obstet, 2009, 105, p. 105-106.
15. Hermanek, P. Why TNM system for staging of gynaecological tumours? CME J Gynecol Oncol, 2001, 6, p. 267-269.
16. Hoffman, JS., Kumar, NB., Morley, GW. Prognostic signifikance of groin lymph node metastases in squamosus carcinoma of vulva. Obstet Gynecol, 1985, 66, 3, p. 402-405.
17. Homesley, HD., Bundy, BN., Sedlis, A., et al. Assessment of current International Federation of Gynecology and Obstetrics staging of vulvar carcinoma relative to prognostic factors for survival. Am J Obstet Gynecol, 1991, 164, 4, p. 997-1004.
18. Hopkins, MP., Reid, GC., Johnston, CM., Morley, GW. A comparison of staging systems for squamous cell carcinoma of the vulva. Gynecol Oncol, 1992, 47, 1, p. 34-37.
19. Kottmeier, HL. Annual report on the results of treatment in gynecological cancer. FIGO, 1982, Eighteenth volume.
20. Lataifeh, I., Nascimento, MN., Nicklin, JL., et at. Patterns of recurrence and disease-free survival in advanced squamosus cell carcinoma of the vulva. Gynecol Oncol, 2004, 95, 3, p. 701-705.
21. Mackillop, WJ., O’Sullivan, B., Gospodarowicz, M. The role of cancer staging in evidence-based medicine. Cancer Prev Control, 1998, 2, 6, p. 269-277.
22. Marsden, DE., Hacker, NF. Controversies and new trends in staging vulvar and vaginal carcinoma. CME J. Gynecol Oncol, 2001, 6, p. 235-239.
23. Morley, GW. Infiltrative carcinoma of the vulva: result of surgical treatment. Am J Obstet Gynecol, 1976, 124, 8, p. 874‑888.
24. O’Sullivan, B., Gospodarowicz, M., Mckillop, WJ. Cancer staging. Cancer Prev Control, 1998, 2, 6, p. 260-261.
25. Odicino, F., Pecorelli, S., Zigliani, L., Creasman, WT. History of the FIGO cancer staging system. Int J Gynecol Obstet, 2008, 101, p. 205-210.
26. Origoni, M., Sideri, M., Garsia, S., et at. Prognostic value of pathological patterns of lymph node positivity in squamosus cell carcinoma of the vulva stage III and IVA FIGO. Gynecol Oncol, 1992, 45, 3, p. 313-316.
27. Paladini, D., Cross, P., Lopes, A., Monaghan, JM. Prognostic significance of lymph node variables in squamosus cell carcinoma of the vulva. Cancer, 1994, 74, 9, p. 2491-2496.
28. Pecorelli, S., Ngan, HYS., Hacker, NF. Staging Classifications and Clinical Practice Guidelines for Gynaecological Cancers. A collaboration between FIGO and IGCS. 3rd ed. London: FIGO, 2006.
29. Pecorelli, S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet, 2009, 105, p. 103-104.
30. Pettersson, F. Annual report on the results of treatment in gynecological cancer. FIGO, 1988, Twentieth volume.
31. Pettersson, F. Annual report on the results of treatment in gynecological cancer. FIGO, 1985, Nineteenth volume.
32. Raspagliesi, F., Hanozet, F., Ditto, A., et al. Clinical and pathologic prognostic factors in squamosus cell carcinoma of the vulva. Gynecol Oncol, 2006, 102, 2, p. 333-337.
33. Tantipalakorn, C., Robertson, G., Marsden, DE., et al. Outcome and patterns of recurrence for FIGO stages I and II squamosus cell vulvar cancer. Obstet Gynecol, 2009, p. 113.
34. TNM klasifikace zhoubných novotvarů. 7. vyd. Chichester, UK: Wiley-Blackwell, 2009, česká verze 2011, p. 17-29, 159-163.
35. van der Velden, J., van Lindert, AC., Lammes, FB., et al. Extracapsular growth of lymph node metastases in squamous cell carcinoma of the vulva. Cancer, 1995, 75, 12, p. 2885-2890.
36. van Trappen, PO., Jacobs, IJ. Controversies and new trends in staging ovarian and Fallopian tube carcinoma. CME J Gynecol Oncol, 2001, 6, p. 260-266.
37. www.figo.org.
38. www.nccn.org.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2011 Issue 4
-
All articles in this issue
- Transabdominal ultrasound examination in gynecology
- Ultrasound-guided minimally invasive interventions in gynecologic oncology
- Application of SNP array method in prenatal diagnosis
- The impact of exogenous luteinizing hormone on IVF/ICSI cycles parameters
- Methylation of selected tumor-supressor genes in benign and malignant ovarian tumors
- Current classification of malignant tumours in gynecological oncology – part I
- Biochemical aspects of fetal hypoxia
- Fetal tricuspid regurgitation
- Is it necessary to revise the guidelines on prevention of thrombembolic disease in pregnancy?
- Risk of the prolapse „de novo“ in primary unaffected compartment by using the syntethic mesh in the surgery treatment of the pelvic organe prolapse
- Implementation of One-Stop-Clinic for Risk Assessment of chromosomal abnormalities in the first trimester, evaluating the effectiveness and making it part of our daily practice
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Fetal tricuspid regurgitation
- Application of SNP array method in prenatal diagnosis
- Transabdominal ultrasound examination in gynecology
- Current classification of malignant tumours in gynecological oncology – part I