Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
Erythrocyte alloimmunization in pregnant women, clinical importance and laboratory diagnostics
Objective:
The aim of this review is to give comprehensive summary of erythrocyte alloimunization of pregnant women, laboratory dignostics and clinical importance.
Design:
Review.
Setting:
University Hospital Olomouc, Transfusion Department, Department of Obstetrics and Gynecology.
Subject and method:
Based on literature analysis using database search engines PubMed, Google Scholar, Ovid in field of erythrocyte antibodies, laboratory diagnostics and clinical importance up-to-date knowledge.
Conclusion:
Erythrocyte alloimunization anti-D antibodies decreases in connection with the introduction of immunoprofylaxis. Immunization of non RhD antibodies with impossibility using of immunoprofylaxis remains still clinical problem.
Keywords:
alloimmunization – anti-D antibodies – prenatal diagnosis
:
I. Holusková 1; M. Lubušký 2,3; M. Studničková 2
; M. Procházka 2
:
Transfuzní oddělení FN a LF UP, Olomouc, primářka MUDr. D. Galuszková, MBA, Ph. D.
1; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D.
2; Ústav lékařské genetiky a fetální medicíny FN a LF UP, Olomouc, přednosta prof. MUDr. J. Šantavý, CSc.
3
:
Ceska Gynekol 2013; 78(1): 89-99
Cíl studie:
Cílem tohoto přehledu je dát ucelený pohled na erytrocytární aloimunizaci těhotných žen, klinický význam a laboratorní diagnostiku.
Typ studie:
Přehledová práce.
Název a sídlo pracoviště:
Fakultní nemocnice Olomouc, Lékařská fakulta Univerzity Palackého v Olomouci, Transfuzní oddělení, Porodnicko-gynekologická klinika, Ústav lékařské genetiky a fetální medicíny.
Předmět a metodika studie:
Na základě analýzy publikací vyhledaných v databázích PubMed, Google Scholar, Ovid zaměřené na jednotlivé erytrocytární aloprotilátky, klinický význam a laboratorní diagnostiku byl sestaven současný přehled znalostí.
Závěr:
Erytrocytární aloimunizace anti-D aloprotilátkou klesá v souvislosti se zavedením anti-D imunoprofylaxe. Imunizace non RhD protilátkami s ohledem na nemožnost podání profylaxe zůstává stále klinickým problémem.
Klíčová slova:
aloimunizace – RhD protilátky – prenatální diagnostika
ÚVOD
Erytrocytární aloimunizace se rozvíjí jako následek stimulace imunitního systému cizími povrchovými erytrocytárními antigeny, které následně navozují tvorbu imunních protilátek třídy IgG [12]. Erytrocytární aloimunizace může být navozena podáním krevní transfuze, která obsahuje pro příjemce transfuze jemu cizí erytrocytární antigen nebo v průběhu těhotenství následkem fetomaternální hemoragie, kdy plod zdědil po otci antigen, který není přítomen na erytrocytech matky [12, 91]. Mateřské aloprotilátky mohou v průběhu těhotenství pronikat placentou do krevního oběhu plodu (transplacentární přenos), kde se navážou na fetální erytrocyty, které jsou následně destruovány v retikulo-endoteliálním systému plodu. Dochází k rozvoji hemolytické nemoci plodu a novorozence (HDFN – Haemolytic Disease of the Fetus and Newborn). Není-li aloimunizace matky diagnostikována a HDFN léčena, může vést k závažné perinatální morbiditě a mortalitě. Pokud jde o první kontakt imunitního systému matky s inkompatibilním erytrocytárním antigenem plodu, dochází ke vzniku závažné formy HDFN ve stávajícím těhotenství jen vzácně. Závažnou formou HDFN jsou většinou ohroženy antigenně inkompatibilní plody až v následujících těhotenstvích.
Nepravidelné antierytrocytární protilátky lze rozdělit podle optimální teploty, při které jsou schopny vázat antigen, na tepelné, které reagují při tělesné teplotě 37 °C, a chladové, které reagují nejlépe při teplotě pokojové (20–23 °C), ev. nižší. Nepravidelné tepelné antierytrocytární protilátky lze dále dělit na autoprotilátky a aloprotilátky, podle přítomnosti nebo nepřítomnosti komplementárního antigenu na povrchu erytrocytů daného jedince. Jsou-li namířeny proti konkrétnímu erytrocytárnímu antigenu, hovoříme o protilátkách specifických, vykazují-li širokou reaktivitu s různými nebo podobnými antigeny, hovoříme o protilátkách nespecifických [80]. Za klinicky významné antierytrocytární aloprotilátky považujeme u těhotných žen takové aloprotilátky, které v případě přítomnosti komplementárního antigenu na povrchu erytrocytů u plodu mohou způsobit rozvoj závažné formy HDFN.
KLINICKÝ VÝZNAM ANTIERYTROCYTÁRNÍCH PROTILÁTEK U TĚHOTNÝCH ŽEN
Hemolytickou nemoc plodu a novorozence mohou teoreticky způsobovat jakékoliv antierytrocytární aloprotilátky třídy IgG. S ohledem na riziko rozvoje HDFN ve vztahu k jednotlivým krevně skupinovým systémům lze antierytrocytární protilátky u těhotných žen rozdělit na klinicky „nejvýznamnější“, „významné“ a „nevýznamné“.
Rozdělení antierytrocytárních protilátek u těhotných žen z hlediska klinického významu pro riziko rozvoje HDFN zobrazuje tabulka 1.
![Rozdělení antierytrocytárních protilátek u těhotných žen z hlediska klinického významu pro riziko rozvoje hemolytické nemoci plodu a novorozence (HDFN, Haemolytic Disease of the Fetus and Newborn) [5, 29, 38, 39, 44, 45, 46, 48, 49, 51, 52, 65, 71,76, 105]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/f83672ce52ef9573cce29cb4111cb81a.png)
Krevně skupinové systémy jsou v následujícím přehledu seřazeny sestupně podle četnosti výskytu antierytrocytárních protilátek u těhotných žen. Klinický význam specifických antierytocytárních protilátek proti jednotlivým erytrocytárním antigenům však nekoresponduje s četností jejich výskytu u těhotných žen.
AB0 SYSTÉM (ISBT 001)H systém (ISBT 018)
AB0 systém je jedním z nejdůležitějších systémů v transfuzní medicíně a zároveň také prvním objeveným antigenním systémem, a to Landsteinerem v roce 1901.
Dědičnost
Geny H a AB0 řídí expresi antigenů “H“ a “A“,“B“ na povrchu erytrocytů. Antigen “H“ je prekurzorová substance, která vzniká připojením sacharidu L-fukózy k prekurzorovému oligosacharidovému řetězci. Přítomnost jen prekurzorové substance H na povrchu erytrocytu odpovídá krevní skupině 0, připojením dalšího specifického monosacharidu do oligosacharidového řetězce antigenu “H“ vznikají antigeny “A“ a “B“.
Geny H ani AB0 tudíž nekódují syntézu samotných antigenů, ale kódují syntézu enzymů, které umožní upevnění dalších monosacharidů specifických pro antigen “H“, “A“ nebo “B“.
Gen H je lokalizován na 19. chromozomu a může mít alely H a h, kdy alela h je recesivní vůči alele H. Alela H kóduje syntézu enzymu H-transferázy, která umožní připojení L-fukózy ke galaktóze v prekurzorovém oligosacharidovém řetězci, a dává tak vznik prekurzorovému “H“ antigenu, který je imunodominantním antigenem krevní skupiny 0. Je-li přítomna pouze recesivní alela h (genotyp h/h), která nekóduje žádnou H-transferázu, nedochází k expresi H antigenu na povrchu erytrocytů. V případě totálního deficitu “H“ antigenu vzniká velmi vzácný tzv. Bombay nebo 0h fenotyp, při částečném deficitu “H“ antigenu tzv. Parabombay fenotyp [16, 31, 87].
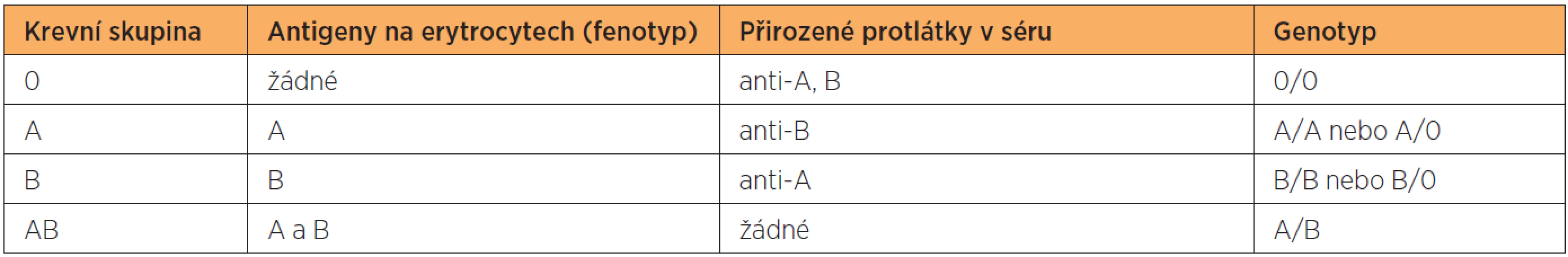
Gen AB0 je lokalizován na 9. chromozomu a může mít alely A1, A2, B, 0 a sérii vzácných alel A3, AX a Am (atd). Alela 0 je ztrátová alela, která je recesivní vůči alelám A a B, jenž jsou vůči sobě kodominantní [87]. Alela A kóduje syntézu enzymu A transferázy, která umožní připojení N-acetyl-galaktosaminu k “H“ antigenu. N-acetyl-galaktosamin je terminálním a imunodominantím monosacharidem pro “A“ antigen. Alela B kóduje syntézu enzymu B transferázy, která umožní připojení D-galaktózy k “H“ antigenu. D-galaktóza je terminálním a imunodominantím monosacharidem pro“ B“ antigen. Alela 0 je ztrátová (klinicky němá) alela, u které nebyl zjištěn žádný proteinový produkt [80]. K AB0 systému patří šest základních genotypů (A/A, A/0, B/B, B/0, A/B, 0/0), kterým odpovídají čtyři fenotypy: A, B, AB a 0. Přehled jednotlivých krevních skupin včetně antigenů (fenotypů), přirozených protilátek a odpovídajících genotypů shrnuje tabulka 2.
Mourant a kol. [77] uvádí zastoupení jednotlivých krevních skupin (fenotypů) u evropské populace A 42 %, B 8 %, AB 3 % a 0 47 %.
Antigeny “A“, “B“ / protilátky anti-A, anti-B
AB0 antigeny jsou koncové oligosacharidy glykoproteinů (65–75 %) nebo glykolipidů (25–35 %) erytrocytární membrány [20]. Antigeny “A“,“B“ a “H“ jsou prokazatelné již u 3 až 4týdenních embryí, nejsou však plně vyvinuty, neboť plné exprese dosahují až mezi 8. a 20. rokem života [16].
Protilátky AB0 systému jsou přirozeně se vyskytující protilátky proti chybějícím antigenům na povrchu erytrocytů, které vznikají přirozenou imunizací jedince zevními substancemi podobnými antigenům “A“ a “B“ (bakteriální antigeny). Tyto protilátky jsou imunoglobuliny třídy IgM a jsou detekovatelné v séru novorozence nejdříve od 3. měsíce věku [16, 19, 87]. Imunizací jedince antigenně inkompatibilními erytrocyty může dojít ke vzniku imunních protilátek třídy IgG. K imunizaci dochází po podání krevní transfuze nebo následkem fetomaternální hemoragie v souvislosti s těhotenstvím. Protilátky třídy IgG již mohou procházet placentou a je-li na erytrocytech plodu přítomen komplementární antigen, může dojít k rozvoji HDFN. U plodu a novorozence jsou však antigeny “A“ a “B“ exprimovány jen velmi slabě [18, 27]. K rozvoji anémie u plodu proto dochází jen velmi vzácně, hemolýza bývá nižšího stupně a prakticky nikdy nevede k rozvoji klinicky závažné fetální anémie. Hemolytická nemoc se většinou rozvíjí až u novorozence a až za několik dnů po porodu, většinou rovněž nemá závažný průběh [87].
Při AB0 inkomatibilitě mezi matkou a plodem se HDFN nejčastěji rozvíjí u matek s krevní skupinou 0. Inkomatibilita mezi matkou a plodem v systému AB0 je častější než RhD inkompatibilita. V evropské populaci je AB0 inkompatibilita přítomna u 25 % těhotenství a RhD u 10 % těhotenství [75]. V případě fetomaternální hemoragie představuje inkompatibilita v systému AB0 pro těhotnou ženu přirozený ochranný faktor před vznikem RhD aloimunizace. AB0 + RhD inkompatibilní fetální erytrocyty jsou v krevním oběhu těhotné ženy rychle hemolyzovány přirozenými protilátkami AB0 systému. K senzibilizaci fetálním RhD antigenem tudíž nemusí dojít a těhotná žena si nevytvoří aloprotilátku anti-D. Riziko RhD aloimunizace těhotné ženy při současné AB0 inkomatibilitě je asi 1,5 % [63] vs. 16 % bez této inkompatibility.
Rh SYSTÉM (ISBT 004)
Rh systém je druhý nejvýznamnější systém krevních skupin objevený Landsteinerem v roce 1939, když v séru ženy po porodu nalezl protilátku proti antigenu plodu, jenž zdědil po otci [80]. K nejvýznamnějším antigenům Rh systému, kterých je identifikovaných více než 50 [87], patří antigeny “D“, “C“, “c“, “E“ a “e“. Jedinec s exprimovaným “D“ antigenem na povrchu erytrocytů je označován jako RhD pozitivní, jedinec s chybějícím “D“ antigenem je označován jako RhD negativní. Proti Rh antigenům se nevyskytují přirozené protilátky (výjimečně anti-E), k tvorbě protilátek proti antigenům Rh systému dochází vždy až po stimulaci imunitního systému antigenně inkompatibilními erytrocyty po podání krevní transfuze nebo následkem fetomaternální hemoragie v souvislosti s těhotenstvím [80].
Dědičnost
Rh antigeny jsou kódovány dvěma blízko sebe ležícími homologními geny RHD a RHCE, které podléhají autozomálně dominantnímu typu dědičnosti a jsou umístěny na krátkém raménku 1. chromozomu. RHD a RHCE geny kódují proteiny RhD a RhCcEe, které jsou oba tvořeny polypeptidovým řetězcem o 417 aminokyselinách, který 12krát prochází erytrocytární membránou. Na vnější straně vytváří šest smyček, kde jsou lokalizovány vlastní antigeny. RhD protein se od RhCcEe proteinu liší 31 až 35 aminokyselinami. RHD gen produkuje “D“ antigen, RHCE gen produkuje antigeny “C“, “c“ ,“E“ a “e“ [19]. Gen RHD má dvě alely D/d, kdy alela D je dominantní k alele d, která je ztrátovou (klinicky němou) alelou, neboť její produkt nebyl nikdy nalezen. Gen RHCE má čtyři alely CE, Ce, cE, ce, které jsou vůči sobě kodominantní a uvedené kombinace alel se dědí neoddělitelně od sebe, proto název genový komplex. Může tak vzniknout až osm genových komplexů (haplotypů): CDe, cde, cDE, cDe, Cde, cdE, CDE a CdE (řazeno sestupně dle výskytu u kavkazské populace). Dvojice těchto genových komplexů jako např. CDe/cde potom určuje genotyp. Některé genotypy a odpovídající fenotypy, se vyskytují častěji než jiné. Nejčastější genotypy jsou CDe/cde a CDe/CDe a představují přibližně 55 % genotypů kavkazské rasy [1]. Pro expresi všech Rh antigenů je nezbytný RhAG (Rh-associated glycoprotein), který je kódován RHAG genem lokalizovaným na krátkém raménku 6. chromozomu. Rh antigeny jsou exprimovány pouze na buňkách erytroidní linie a na fetálních erytrocytech jsou exprimovány již od 6. gestačního týdne.Velmi vzácně mohou Rh antigeny na erytrocytech zcela chybět a potom hovoříme o tzv. Rhnull fenotypu.
Antigen“D“ / protilátka anti-D
Objeven jako první antigen z tohoto systému. Je zároveň hlavním a nejvýznamnějším antigenem Rh systému. Antigen “D“ je silně imunogenní, protože u RhD negativních jedinců chybí celý RhD protein se všemi antigenními epitopy. Imunitní systém RhD negativních jedinců velmi dobře rozpozná RhD pozitivní ertrocyty a dochází k tvorbě anti-D protilátky [16]. Pronikne-li tedy dostatečné množství RhD pozitivních erytrocytů do krevního oběhu RhD negativní těhotné ženy mohou způsobit rozvoj RhD aloimunizace. Objem inkompatibilních erytrocytů, nezbytně nutný k vyvolání aloimunizace, je individuální a závisí jak na imunogenicitě RhD pozitivních fetálních erytrocytů, tak i na reaktivitě imunitního systému těhotné ženy. Již objem 0,1 ml fetálních erytrocytů může vést k rozvoji aloimunizace. Přibližně u 1–2 % těhotenství dochází k aloimunizaci již antepartálně [14, 43].
Specifická antierytrocytární aloprotilátka anti-D je schopná vyvolávat závažnou formu HDFN [19, 20]. Intenzita hemolytické nemoci je vystupňována četností gravidit. Není-li aloimunizace matky diagnostikována nebo HDFN léčena, může vést k závažné perinatální morbiditě a mortalitě [61]. Před zavedením anti-D imunoprofylaxe byla aloprotilátka anti-D odpovědná za 90 % těžkých případů HDFN [87].
Existuje množství odchylek v expresi “D“ antigenu. Slabé D (Dweak/Dw) = kvantitativní zeslabení exprese “D“ antigenu. Všechny D epitopy jsou exprimovány slabě a jedinci si při kontaktu s erytrocyty s normální expresí “D“ antigenu nevytvářejí protilátky anti-D. Dweak erytrocyty méně často než normální D erytrocyty stimulují tvorbu anti-D protilátek u RhD negativních jedinců a rovněž tak D pozitivní plod je také méně často ohrožen závažnou formou HDFN v případě RhD aloimunizace u matky [75]. Variantní D (Dvariant/Dv) = kvalitativní zeslabení exprese“ D“antigenu. Některé epitopy “D“ antigenu nejsou exprimovány a při kontaktu s D positivními erytrocyty si jedinci s Dvariant fenotypem mohou vytvářet protilátky proti D epitopům, které na povrchu jejich erytrocytů chybí. Bylo popsáno více než20 variantních “D“ antigenů, ale většina z nich se vyskytuje velmi vzácně. U bílé populace jsou nejčastější “DVI“ a “DVII“, u Afričanů “DIII“ [4, 34, 94].Vytvoří-li si žena s Dvariant fenotypem protilátky anti-D, může dojít k rozvoji závažné formy HDFN u D pozitivního plodu [18]. U žen s Dvariant fenotypem (zejména u “DVI“) je proto důležité provést prevenci RhD aloimunizace [68].
Incidence antigenu “D“ v populaci
Antigen “D“ je přítomen u 82–88 % evropské populace a severoamerické bělošské populace, u 95 % černošské populace a u obyvatel dálného východu dosahuje výskyt “D“ antigenu téměř 100 % [20]. RhD pozitivní jedinci se dělí na heterozygoty pro alelu D, kterých se v bělošské populaci vyskytuje přibližně 60 %, a na homozygoty pro alelu D, kterých se v bělošské populaci vyskytuje přibližně 40 % [1, 19].
Incidence protilátky anti-D u těhotných žen
Ľubušký a kol. uvádí incidenci aloprotilátky anti-D 5,0 ‰ [59], Geifman-Holtzman a kol. [36] uvádí ve svém souboru incidenci 2,7 ‰.
Incidence RhD inkompatibilních těhotenství
Přibližně 15 % bílé populace je RhD negativní a RhD negativní žena má tedy asi 85% pravděpodobnost, že její partner bude RhD pozitivní (60 % heterozygot a 40 % homozygot pro alelu D). Přibližně v 10 % všech těhotenství tudíž nastává situace, že RhD negativní matka bude mít RhD pozitivní plod [7, 20, 43].
Antigeny “C“, “c“ a “E“, “e“ / protilátky anti-C, anti-c, anti-E, anti-e
Antigeny “C“, “c“ a “E“, “e“ jsou mnohem méně imunogenní než antigen “D“. Všechny protilátky proti antigenům Rh systému by měly být považovány za schopné způsobit závažnou formu HDFN. Klinicky nejvýznamnější z non-RhD protilátek je protilátka anti-c, která je schopna způsobit závažnou formu HDFN. Velmi často jde o opožděnou hemolýzu. Její hemolytický potenciál je velmi podobný protilátce anti-D [41, 104]. Až v polovině případů je jako příčina aloimunizace popisována inkompatibilní transfuze [8]. Protilátky anti-C, anti-E, anti-e mohou rovněž způsobit HDFN, ale většinou mírnou formu, a závažnou hemolýzu zposobují jen zřídka [11, 41, 47, 95, 99].
Incidence antigenů “C“, “c“, “E“, “e“ v populaci
Antigen “C“ je přítomen u 68 % bělošské polulace, 17 % černošské populace a u 94 % obyvatel dálného východu. Antigen “c“ je přítomen u 81 % bělošské polulace, 99 % černošské populace a u 43 % obyvatel dálného východu. Antigen “E“ je přítomen u 29 % bělošské polulace, 23 % černošské populace a u 36 % obyvatel dálného východu. Antigen “e“ je přítomen u 98 % bělošské polulace, 99 % černošské populace a u 96 % obyvatel dálného východu [20].
Incidence protilátek anti - C, anti-c, anti-E, anti-e u těhotných žen
Ľubušký a kol. uvádí incidenci aloprotilátky anti-E 5,1 ‰, anti-C 1,3 ‰ a anti-c 0,6 ‰ [59]. Geifman-Holtzman a kol. [36] uvádí incidenci anti-E 2,0 ‰ (77/37 506), anti-c 0,8 ‰ (32/37 506) a anti-C 0,7 ‰ (26/37 506).
KELL SYSTÉM ( ISBT 006)
Systém KELL je tvořen 27 antigeny a každý z nich je označen jménem, písmennou zkratkou a číslem (např. Kell, K a KEL1). Tento antigenní systém byl objeven v roce 1946 hned po objevení antiglobulinového testu [24]. Nejběžnější antigeny spojené s HDFN jsou alelické antigeny Kell (K, KEL1) a Cellano (k, KEL2). Další antigeny, které jsou asociovány s HDFN jsou: Penny (Kpa, KEL3), Rautenberg (Kpb, KEL4), Peltz (Ku, KEL5), Sutter (Jsa, KEL6), Matthews (Jsb, KEL7), Karhula (Ula, KEL10) a KEL22 [15, 17, 40, 56, 86, 89]. V následujícím textu budou již jednotlivé antigeny označovány vždy jen písmennou zkratkou.
Dědičnost
KEL gen je lokalizován na 7. chromozomu, je organizován 19 exony v kódující sekvenci a je vysoce polymorfní. KEL gen má 2 hlavní kodomimantní alely K a k, které jsou výsledkem jednonukleotidového polymorfismu (698T→C) a korespondující antigeny “K“ a “k“ se liší jednou aminokyselinou (M193T) [24]. KEL gen kóduje KELL glykoprotein, který prostupuje erytrocytární membránou pouze jednou a extramembranózně má velkou doménu, na které se exprimují všechny antigeny systému KELL. KELL glykoprotein je strukturální a sekvenční homolog s rodinou na zinku závislých neutrálních endopeptidáz, což naznačuje, že zřejmě hraje významnou roli v růstu a diferenciaci erytrocytů [74]. KELL glykoprotein je asociován s XK proteinem (produkt XK genu na X chromozomu), který 10krát prochází erytrocytární membránou a jsou na něm lokalizovány antigeny “Kx“ a “Km“. Velmi vzácné chybění XK proteinu výhradně u chlapců je zodpovědno za tzv McLeodův fenotyp, kdy chybí antigeny “Kx“ a “Km“, a ostatní KELL antigeny jsou exprimovány velmi slabě. Přítomnost XK proteinu v membráně erytrocytů při současném chybění celého KELL glykoproteinu se označuje jeko vzácný K0 fenotyp. Jedinci s K0 fenotypem mohou produkovat protilátku anti-Ku, která může způsobit hemolýzu všech erytrocytů, v jejichž membráně se KELL glykoprotein nachází [19, 24]. V literatuře je uvedeno nejméně devět aloprotilátek proti KELL antigenům v souvislosti s rozvojem HDFN [20, 74].
Antigen “K“ / protilátka anti-K
Nejvíce imunogenním antigenem Kell systému je antigen “K“, který je po “D“ antigenu druhým nejvíce imunogenním antigenem [2, 13, 24, 33, 102]. Protilátky anti-K mohou způsobovat závažnou formu HDFN [18, 70]. Nejčastější příčinou aloimunizace v Kell systému je inkompatibilní krevní transfuze [70]. Závažnost HDFN lze jen obtížně předpovědět, protože korelace mezi hladinou aloprotilátky anti-K a stupněm fetální anémie je jen velmi malá. Byl popsán i případ těhotenství s hydropsem plodu v 17. týdnu gravidity, kdy titr anti-K byl v 16. týdnu pouze 1 : 2 [100]. HDFN způsobená mateřskou aloprotilátkou anti-K se liší od HDFN způsobené mateřskou aloprotilátkou anti-D, protože kromě hemolýzy inkompatibilních erytrocytů může aloprotilátka anti-K způsobovat ještě útlum krvetvorby jejich prekurzorů v kostní dřeni. Je jisté, že KELL glykoprotein se na membráně erytroidních progenitorových buněk objevuje mnohem dříve než Rh proteiny [20, 21, 22, 88]. HDFN způsobená aloprotilátkou anti-K je spojena s nižší hladinou bilirubinu v plodové vodě než HDFN způsobená aloprotilátkou anti-D a ani postnatálně nebývá přítomna významná hyperbilirubinémie. Nižší je rovněž i hladina retikulocytů a erytroblastů. Tyto údaje nasvědčují tomu, že u stejně závažné HDFN způsobené anti-K ve srovnání s HDFN způsobené anti-D je menší podíl hemolýzy [20].
Incidence antigenu “K“ v populaci
Antigen “K“ se vyskytuje u 10 % bělošské populace a u 2 % černošské populace. V Arábii a na Sinajském poloostrově je naopak incidence “K“ antigenu až 25 %. K pozitivní jedinci se dělí na heterozygoty pro alelu K (Kk) – 98 % bělochů a téměř 100 % Afroameričanů – a homozygoty pro alelu K (KK).
Incidence protilátky anti-K u těhotných žen
Ľubušký a kol. uvádí incidenci aloprotilátky anti-K 1,2 ‰ [59], Geifman-Holtzman a kol. [36] uvádí incidenci anti-K 3,0 ‰ (115/37 506). Výskyt anti-K protilátky se v posledních letech zvýšil: z 1,6/1000 v polovině 60. let 20. století na 3,2/1000 do roku 1995 [36, 74, 83]. Příčina nebyla zatím zcela objasněna.
Incidence “K” inkompatibilních těhotenství
U bělošské populace má K negativní žena (90 %) pravděpodobnost 10 %, že její partner bude K pozitivní (většinou heterozygot pro alelu K), a tudíž 5% pravděpodobnost, že bude mít K pozitivní plod [24, 74].
Antigen “k“ / protilátka anti-k
Jde o vysokofrekventní antigen [24], naopak incidence aloprotilátky anti-k u těhotných žen je velmi nízká. Z hlediska rizika rozvoje závažné formy HDFN je aloprotilátka anti-k řazena mezi významné aloprotilátky, avšak vzhledem k velmi nízkému výskytu u těhotných žen lze klinický význam pro riziko rozvoje HDFN jen velmi obtížně posoudit [9, 28, 53, 57].
MNS SYSTÉM (objeven v roce 1927) – ISBT 002
Zahrnuje 46 antigenů. Mezi nejznámější antigeny patří antigeny “M“, “N“, “S“, “s“ a v černošské populaci antigen “U“. MNS systém je kódován dvěma geny – GYP A (gen pro glykophorin A) a GYP B ( gen pro glykophorin B), které jsou lokalizovány na 4. chromozomu. Párové antigeny “M“ a “N“ jsou na glykophorinu A (GPA) a párové antigeny “S“ a “s“ jsou na glykophorinu B (GPB) [24, 87]. Jde o druhý nejpolymorfnější systém po Rh systému.
Antigeny “M“ a “N“ / protilátky anti-Ma anti-N
Protilátka anti-M je relativně běžně přirozeně se vyskytující protilátka, zatímco protilátka anti-N se vyskytuje vzácně. Většina anti-M a anti-N protilátek je při teplotě 37 °C inaktivních, a jsou tedy klinicky nevýznamné [20]. Vzácně může dojít ke konverzi anti-M protilátky třídy IgM na IgG, která je schopna procházet placentou a v tom případě může způsobit i závažnou HDFN [73]. V souvislosti s aloprotilátkou anti-M bylo popsáno 6 případů závažné formy HDFN [29, 35, 50, 62, 67, 90] a pouze jeden případ závažné formy HDFN v souvislosti s aloprotilátkou anti-N [92].
Incidence antigenů “M“, “N“ v populaci
Antigen “M“ je přítomen u 78 % kavkazské populace a u 74 % Afroameričanů, antigen “N“ u 72 % kavkazské populace a u 75 % Afroameričanů [24].
Incidence protilátek anti-M, anti-N u těhotných žen
Ľubušký a kol. uvádí incidenci aloprotilátky anti-M 1,4 ‰ [59], Geifman-Holtzman a kol. [36] uvádí nález anti-M u 0,5 ‰ (19/37 506) a anti-N u 0,0 ‰ (1/37 506) vyšetřovaných žen.
Antigeny “S“ a “s“ / protilátky anti-Sa anti-s
Protilátka anti-S se vyskytuje častěji než protilátka anti-s a obě jsou schopny způsobit i závažnou hemolýzu. Byly popsány tři případy závažné formy HDFN způsobené aloprotilátkou anti-S [32, 58, 69] a čtyři případy závažné formy HDFN způsobené aloprotilátkou anti-s [37]. V ostatních případech se jednalo pouze o mírnou formu HDFN [32, 23].
Mezi další protilátky systému MNS, které by mohly způsobit HDFN, řadíme protilátky anti-U, anti-Mia, anti-Mta, anti-Ena , anti-Vw, anti-Mur, anti-Hut, anti-Hil, anti-Mv, anti-Far, anti-sD, anti-Or a anti-MUT [24].
Incidence antigenů “S“, “s“ v populaci
Antigen “S“ je přítomen u 55 % kavkazské populace a u 31 % Afroameričanů a antigen “s“ u 89 % kavkazské populace a u 93 % Afroameričanů [24].
Incidence protilátek anti-S, anti-s u těhotných žen
Ľubušký a kol. uvádí incidenci výskytu aloprotilátky anti-S 0,4 ‰ [59], Geifman-Holtzman a kol. [36] uvádí nález anti-S u 0,1 ‰ (4/37 506) vyšetřovaných žen.
DUFFY SYSTÉM (ISBT 008)
Tento antigenní systém zahrnuje celkem 6 antigenů. Gen pro Duffy systém (DARC) je uložen na 1. chromozomu a kóduje Duffy antigeny (“Fya“, “Fyb“, “Fy3“, “Fy4“, “Fy5“, “Fy6“) [24]. Klinicky nejvýznamnější jsou alelické antigeny “Fya“ (FY1) a “Fyb“ (FY2). Protilátky anti-Fya a anti-Fyb jsou třídy IgG a nejsou detekovány v enzymových testech, neboť antigeny “Fya“ a “Fyb“ jsou citlivé vůči proteázovým enzymům, které je štěpí [87]. Protilátky anti-Fya a anti-Fyb jsou schopny způsobit i závažnou formu HDFN [6, 36, 39, 101, 103].
KIDD SYSTÉM (ISBT 009)
Tento antigenní systém zahrnuje tři antigeny – “Jka“, “Jkb“ a“Jk3“. Gen SLC14A1 kódující klinicky nejvýznamnější alelické antigeny “Jka“ a “Jkb“ je lokalizován na 18. chromozomu. Aloprotilátky anti-Jka a anti-Jkb jsou třídy IgG; jsou schopny aktivovat komplement, procházejí placentou, a mohou tedy způsobovat různé formy HDFN. HDFN způsobená těmito aloprotilátkami je poměrně vzácná, avšak byly popsány i případy velmi těžké formy s fatálními následky [51, 64]. Aloprotilátky anti-Jka a anti-Jkb jsou velmi dobře detekovány antiglobulinovými technikami, ačkoli některé slabé protilátky lze velmi dobře zachytit i enzymovými technikami [87].
SYSTÉM DIEGO (ISBT 010)
Tento systém se skládá z 21 antigenů. Diego antigeny jsou kódovány SLC4A1 genem, který je lokalizován na 17. chromozomu. Mezi nejvýznamnější antigeny patří antigeny “Dia“, “Dib“ a “Wra“. Antigen “Dia“ se u Evropanů vyskytuje vzácně, mnohem častěji se vyskytuje u původních obyvatel severní a jižní Ameriky, kde dosahuje až 54 %. Protilátky anti-Dia mohou způsobit závažnou formu HDFN a i přes nízkou incidenci ve většině populací byla popsána řada případů HDFN [3, 54, 93]. Anti-Dib mohou způsobit hemolýzu vyžadující provedení výměnné transfuze u novorozence [26, 55, 97]. Rovněž protilátky anti-Wra a anti-ELO proti vzácně se vyskytujícím antigenům systému Diego mohou způsobit závažnou formu HDFN [85].
SYSTÉM LUTHERAN (ISBT 005)
Z tohoto antigenního systému jsou dobře známy antigeny “Lua“ (nízká frekvence výskytu) a “Lub“ (vysoká frekvence výskytu). Aloprotilátka anti-Lua bývá obvykle třídy IgM, anti-Lub třídy IgG. Klinický význam pro HDFN však nemají, neboť jsou jen slabě exprimovány na fetálních erytrocytech [87].
P SYSTÉM (ISBT 003)
Z tohoto systému je dobře známý pouze antigen “P1“, který je asociován s antigeny “P“, “Pk“ a“LKE“, jež ovšem nejsou součástí P systému. Aloprotilátka anti-P1 bývá obvykle třídy IgM a většinou bývá chladové povahy. Příležitostně lze zachytit formu reagující při 37 °C. Anti-P1 váže komplement. Výskyt HDFN v souvislosti s touto imunizací těhotné nebyl zaznamenán [87].
LABORATORNÍ DIAGNOSTIKA
V rámci komplexního prenatálního vyšetření do konce 14. týdne těhotenství, by měla být u těhotné ženy vyšetřena krevní skupina AB0 + RhD a proveden screening nepravidelných tepelných antierytrocytárních protilátek. V případě pozitivity screeningu, by měla být provedena identifikace a event. kvantifikace protilátkového nálezu.
Vyšetření krevní skupiny AB0 + RhD
Příslušnost k jednotlivým krevním skupinám v AB0 systému určuje přítomnost nebo nepřítomnost antigenu (aglutinogenu) “A“ a/nebo “B“ na povrchu erytroctů a dvou přirozeně se vyskytujících protilátek (aglutininů) anti-A a anti-B v séru. V krevním séru se vždy nachází protilátka proti antigenu, který není přítomen na vlastních erytrocytech.
Termínem RhD pozitivní se označuje přítomnost “D“ antigenu nebo jeho slabé/variantní formy (D weak/variant) na vyšetřovaných erytrocytech. Erytrocyty, na kterých se antigen “D“ nenachází, jsou označovány jako RhD negativní.
Přehled jednotlivých krevních skupin včetně antigenů (fenotypů), přirozených protilátek a odpovídajících genotypů shrnuje tabulka 2.
SCREENING nepravidelných tepelných antierytrocytárních protilátek
Screening nepravidelných tepelných antierytrocytárních protilátek umožňuje detekovat klinicky významné aloprotilátky, které mohou ohrozit plod i novorozence rozvojem závažné formy HDFN [38].
Screening nepravidelných tepelných antierytrocytárních protilátek musí vždy obsahovat nepřímý antiglobulinový test (NAT) za použití erytrocytů resuspendovaných v roztoku o nízké iontové síle (LISS-NAT anti-IgG + anti-C3d) při 37 °C [25, 30, 38, 48] nebo jinou srovnatelně citlivou metodou. Antiglobulinové techniky jsou charakterizovány vysokou senzitivitou při detekci klinicky významných protilátek třídy IgG (např. anti-D, anti-K) [84]. Jako doplňkové testy lze s výhodou použít testy enzymové, které detekují protilátky třídy IgG i IgM a zesilují reakce protilátek zejména u systémů Rh, Kell a Kidd. Naopak protilátky proti antigenům, které jsou citlivé vůči enzymům, nemohou být enzymovými testy detekovány, což se týká zejména systémů Duffy a MNS.
Spolehlivost detekce nepravidelných tepelných antierytrocytárních protilátek je závislá na dostupnosti diagnostických erytrocytů s vhodnými antigeny a na citlivosti použitých testovacích postupů. Požadavky na konfiguraci antigenního složení diagnostických screeningových erytrocytů jsou přísné a musí umožnit bezpečné stanovení všech klinicky významných aloprotilátek. Doporučuje se použití panelu 3 diagnostických erytrocytů s minimálním zastoupením následujících antigenů: “C“, “Cw“, “c“, “D“, “E“, “e“, “K“, “k“, “Fya“, “Fyb“, “Jka“, “Jkb“, “S“, “s“, “M“, “N“, “Lea“ [38]. Jedny screeningové diagnostické erytrocyty by měly mít fenotyp CDe (R1R1) a jedny fenotyp cDE (R2R2). Screeningové diagnostické erytrocyty se nesmějí používat ve směsi [38].
IDENTIFIKACE nepravidelných tepelných antierytrocytárních protilátek
Identifikace nepravidelných tepelných antierytrocytárních protilátek se provádí v případě, že je screeningové vyšetření pozitivní. Cílem je přesná identifikace protilátky event. směsi protilátek. Zpráva pro ošetřujícího lékaře by měla obsahovat informaci o klinické významnosti diagnostikované aloprotilátky z hlediska rizika rozvoje HDFN a doporučení k event. hemoterapii [38].
KVANTIFIKACE (titrace) specifických klinicky významných aloprotilátek
Stanovení titru identifikovaných klinicky významných aloprotilátek u těhotných žen slouží k identifikaci těhotenství, která jsou při dosažení kritického titru ohrožena rozvojem závažné formy HDFN [38]. Po dosažení kritického titru by měla být HDFN sledována již jinou než imunohematologickou metodou [30, 49, 79, 98].
Za kritický titr u aloprotilátek anti-D, -C, -E se považuje titr ≥ 32 v NAT (zkumavkovou metodou) nebo titr ≥ 128 v LISS-NAT metodou sloupcové aglutinace U ostatních aloprotilátek titr ≥ 64 zkumavkovou metodou [10, 25, 30, 38, 47, 66, 78, 105], respektive ≥ 128 metodou sloupcové aglutinace. Hodnocení kritického titru závisí rovněž na anamnestických údajích z předchozích těhotenství [25, 49, 82, 96].
Při aloimunizaci antigenem “E“ nemusí ani vysoké hodnoty titru vést k rozvoji HDFN, naopak při aloimunizaci “K“ antigenem se může rozvinout závažná forma HDFN již při nízkém titru a za kritický titr anti-K aloprotilátky je považován již titr 4.
ZÁVĚR
U všech těhotných žen v prvním trimestru těhotenství (do konce 14. týdne) by měla být stanovena krevní skupina AB0 + RhD a proveden screening nepravidelných tepelných antierytrocytárních protilátek. V případě pozitivního screeningu by měla být provedena identifikace protilátky, a pokud se jedná o specifickou klinicky významnou aloprotilátku, tak by následně měla být provedena i její kvantifikace. RhD aloimunizace je v současnosti jediná erytrocytární aloimunizace, které lze zabránit podáním anti-D imunoglobulinu při všech potenciálně senzibilizujících událostech. Se zavedením standardizované imunoprofylaxe anti-D imunoglobulinem došlo k poklesu výskytu anti-D aloprotilátek u RhD negativních žen. V ostatních antigenních systémech však možnost preventivní imunizace není, a aloimunizace těhotných žen těmito klinicky významnými antigeny bude tudíž představovat riziko rozvoje hemolytické nemoci u plodu a novorozence i v budoucnosti.
Podpořeno grantem IGA MZ ČRNT-11004-3/2010, NT-12225-4/2011.
MUDr. Iva Holusková
Transfuzní oddělení
Fakultní nemocnice
I. P. Pavlova 6
775 20 Olomouc
Sources
1. ACOG – American College of Obstetricians and Gynecologists. ACOG Practise Bulletin No 75: management of alloimmunization. Obstet Gynecol, 2006, 108, p. 457–464.
2. Ahaded, A. Brossard, Y., Debbia, M., Lambin, P. Quantitative determination of anti-K (KELL 1) IgG and IgG subclasses in the serum of severely alloimmunized pregnant women by ELISA. Transfusion, 2000, 40, p. 239–1245.
3. Alves de Lima, LM., Berthier, ME., Sad, WE., et al. Characterization of an anti-Dia antibody causing hemolytic disease in a newborn infant. Transfusion, 1982, 22, p. 246–247.
4. Avent, ND. The Rhesus blood group systém: insights from recent advances in molecular biology. Transfus Med Rev, 1999, 13, p. 245–266.
5. Avent, N., Finning, K., Martin, P., Soothill, P. Prenatal determination of fetal blood group status. Vox Sang, 2000, 78 (Suppl. 2), p. 155–162.
6. Babinszki, A., Berkowitz, RL. Haemolytic disease of the newborn caused by anti-c, anti-E and anti-Fya antibodies: report of five cases. Prenat Diagn, 1999, 19, p. 533–536.
7. Berghella, V. Maternal-Fetal Evidence-Based Guidelines (Series in Maternal-Fetal Medicine). Informa-Healthcare Publishing, 1st. ed. 2007.
8. Bowell, PJ., Brown, SE., Dike, AE., Inskip, MJ. The significance of anti-c alloimmunization in pregnancy. Br J Obstet Gynaecol, 1986, 93, 10, p. 1044–1048.
9. Bowman, JM., Harman, CR., Manning, FA., Pollock, JM. Erythroblastosis fetalis produced by anti-k. Vox Sang,1989, 56, 3, p. 187–189, Erratum in: Vo. Sang, 1990, 58, 2, p. 139.
10. Bowman, JM., Pollock, JM., Manning, FA., Harman, CR. Severe anti-C hemolytic disease of the newborn. Am J Obstet Gynecol, 1992, 166, 4, p. 1239–1243.
11. Bowman, JM., Pollock, JM. Maternal Cw alloimmunization. Vox Sang, 1993, 63, p. 226–230.
12. Calda, P. Příčiny, prevence a diagnostika aloimunizace v těhotenství. Actual Gyn, 2009, 1, s. 55–60.
13. Collinet, P., Subtil, D., Puech, F., Vaast, P. Successful treatment of extremely severe fetal anemia due to Kell alloimmunization. Obstet Gynecol, 2002, 100, p. 1102–1105.
14. Contreras, M. The prevention of Rh haemolytic disease of the fetus and newborn-general background. Br J Obstet Gynaecol, 1989, 105, p. 7–10.
15. Costemagna, L., Barbarini, M., Viarengo, GL., et al.A case of hemolytic disease of the newborn due to anti-Kpa. Immunohematol, 1997, 13, p. 61–62.
16. Čermáková, Z., Kořístka, M., Malušková, A. Imunohemato-logie. Ostrava: Ostravská Univerzita v Ostravě, 2008.
17. Dacus, JV., Spinnato, JA. Severe erythroblastosis fetalis secondary to anti-Kpb sensitization, Am J Obstet Gynecol, 1984, 150, p. 888–889.
18. Daniels, G. Human blood groups. Oxford: Blackwell Science, 1995.
19. Daniels, G. Human blood groups. 2nd ed. Oxford: Blackwell Publishing, 2002.
20. Daniels, G., Bromilow, I. Essential Guide to Blood Groups. 1th ed. Oxford: Blackwell Publishing, 2007.
21. Daniels, G., Green, C. Expression of red cell surface antigens during erythropoesis. Vox Sang, 2000, 78 (Suppl. 2), p. 149–153.
22. Daniels, G., Hadley, A., Green, C. Fetal anemia due to anti-K may result from immune destruction of early erythroid progenitors. Transfus Med, 1999, 9 (suppl. 1), p. 16 (abstract).
23. Davie, MJ., Smith, DS., White, UM., Dyball, D. An example of anti-s causing mild haemolytic disease of the newborn. J Clin Pathol, 1972, 25, 9, p. 772–773.
24. Dean, L. Blood Groups and Red Cell Antigens. National Center for Biotechnology Information (US), 2005 NCBI.
25. De Silva, M. New guidelines for pre and perinatal immunohaematology. ISBT, 2003, Istanbul, p. 109–111.
26. Donato, E., Guinot, M., Vilar, C., et al. rHuEPO in the management of pregnancy complicated by anti-Dib. Transfusion, 2003, 43, p. 681–682.
27. Drabik-Clary, K., Reddy, VV., Benjamin, WH., Boctor, FN. Severe hemolytic disease of the newborn in a group B African-American infant delivered by a group 0 mother. Ann Clin Lab Sci, 2006, 36, p. 205–207.
28. Duguid, J., Bromilow I. Haemolytic disease of the newborn due to anti-k. Vox Sang, 1990, 58, 1, p. 69.
29. Duguid, J., Bromilow I., Entwistle, G., Wilkinson, R. Haemolytic disease of the newborn due to anti-M. Vox Sang, 1995, 68, 3, p. 195–196.
30. Dušková, D., Kubánková, H., Masopust, J., et al. Imuno-hematologická vyšetření v těhotenství a po porodu. Doporučení společnosti pro transfuzní lékařství ČLS JEP, č. STL2010_06 ze dne1. 3. 2010 verze 3 (2010_06), Souhrn doporučení.
31. Eckstein, R. Imunohematologie a Transfuzní lékařství, 1. vyd. 1994.
32. Feldman, R., Luhby, AL., Gromisch, DS. Erythroblastosis fetalis due to anti-S antibody. Pediatr, 1973, 82, 1, p. 88–91.
33. Fernandez-Jimenez, MC., Jimenez-Marco, MT., Hernandez, D., et al. Treatment with plasmapheresis and intravenous immunoglobulin in pregnancies complicated with anti PP1Pk or anti-K immunization: a report of two patients. Vox Sang, 2001, 80, p. 117–120.
34. Flegel, W., Wagner, FF., Muller, TH., Gassner, C. Rh phenotype prediction by DNA typik and its application to practice. Transfus Med, 1998, 8, p. 281–302.
35. Furukawa, K., Nakajima, T., Kogure, T., et al. Example of a woman with multiple intrauterine deaths due to anti-M who delivered a live child after plasmaferesis. Exp Clin Immunogenet, 1993, 10, 3, p. 161–167.
36. Geifman-Holtzman, O., Wojtowycz, M., Kosmas, E., Artal, R. Female alloimmunization with antibodies known to cause hemolytic disease. Obstet Gynecol, 1997, 89, 2, p. 272–275.
37. Giblett, E., Chase, J., Crealock, FW. Hemolytic disease of the newborn resulting from anti-s antibody: report of a fatal case resulting from the fourth example of anti-s antibody. Am J Clin Pathol, 1958, 29, 3, p. 254–256.
38. Gooch, A., Parker, J., Wray, J., Qureshi, H. Guideline for blood grouping and antipody testing in pregnancy. British Committee for Standards in Haematology, 2006, www. Bcshguidelines.com.
39. Goodrick, M., Hadley, A., Poole, G. Haemolytic disease of the fetus and newborn due tu anti-Fya and the potential clinical value of Duffy genotyping in pregnancies at risk. Transfus Med, 1997, 7, p. 301–304.
40. Gordon, MC., Kennedy, MS., O’Shaughnessy, RW.,Waheed, A. Severe hemolytic disease of the newborn due toanti-Jsb. Vox Sang, 1995, 69, p. 140–141.
41. Hackney, DN., Knudtson, EJ., Rossi, KQ., et al. Management of pregnancies complicated by anti-c isoimmunization. Obstet Gynecol, 2004, 103, 1, p. 24–30.
42. Hadley, AG., Poole, GD., Poole, J. Haemolytic disease of the newborn due to anti-G. Vox Sang, 1996, 71, p. 108–112.
43. Hadley, A., Soothill, P. Alloimmune disorders of pregnancy: anaemia, trombocytopenia and neutropenia in the fetus and newborn. Cambridge: Cambridge University Press, 2008.
44. Hall, AR., Mason, RP., Mallaband, A. Survey of significant antibodies found in enzyme screen positive but antiglobulin test negative antenatal referrals. Transfus Med, 1997, 7 (Suppl. 1), p. 23.
45. Huber, AR., Leonard, GT., Diggers, RW., et al. Case report: moderate hemolytic disease of the newborn due to anti-G. Immunohematol, 2006, 22, p. 166–170.
46. Hundrič-Haspl, Z., Jurakovič-Loncar, N., Grgicevič, D. Evaluation of the enzyme test for detection of clinically significant red blood cell antibodies during pregnancy. Acta Med Croatica, 1999, 53, p. 125–128.
47. Joy, SD., Rossi, KQ., Krugh, D., O’Shaughnessy, RW. Management of pregnancies complicated by anti-E alloimmunization. Obstet Gynecol, 2005, 105, 1, p. 24–28.
48. Judd, W., Luban, N., Ness, P., et al. Prenatal and perinatal imunohematology: recommendations for serologic management of the fetus, newborn infant, and obstetric patient. Transfusion, 1990, 30, p. 175–183.
49. Judd, WJ. Practice guidelines for prenatal and perinatal imunohematology, revisited. Transfusion, 2001, 41, p. 1445–1452.
50. Kanra, T., Yüce, K., Ozcebe, IU. Hydrops fetalis and intrauterine deaths due to anti-M. Acta Obstet Gynecol Scand, 1996, 775, 4, p. 415–417.
51. Kim, WD., Lee, YH. A fatal case of severe haemolytic disease of newborn associated with anti-Jk(b). J Korean Med Sci, 2006, 21, 1, p. 151–154.
52. Klein, H., Anstee, D. Haemolytic disease of the fetus and newborn. In Mollison’s blood transfusion in clinical medicine. 11th ed. Oxford: Blackwell Publishing, 2005, p. 496–545.
53. Kulich, V., Kohout, M. Hemolytic disease of a newborn caused by anti-k antibody. Ces Pediatr, 1967, 22, 9, p. 823–826.
54. Kusnierz-Alejska, G., Bochenek, S. Haemolytic disease of the newborn due to anti-Dia and incidence of the Dia antigen in Poland. Vox San, 1992, 62, p. 124–126.
55. Lenkiewicz, B., Zupanska, B. The first example of anti-Diego(b) found in a Polish woman with the Di(a+b-) phenotype and haemolytic disease of the newborn not requiring treatment. Transfus Med, 2003, 13, p. 161–163.
56. Levene, C., Rudolphson, Y., Schechter, Y. A second case of hemolytic disease of the newborn due to anti-Jsa. Transfusion, 1980, 20, p. 714–715.
57. Levine, P., Backer, M., Wigod, M., Ponder, R. A new human hereditary blood property (Cellano) present in 99.8% of all bloods.Science, 1949, 6, 109, 2836, p. 464–466.
58. Levine, P., Ferraro, LR., Koch, E. Hemolytic disease of the newborn due to anti-S: a case report with a review of 12 anti-S sera cited in the literature. Blood, 1952, 7, 10, p. 1030–1037.
59. Lubusky, M., Dhaifalah, I., Holuskova, I., et al. The incidence of erytrocyte alloimmunization in pregnant women. Int J Gynaecol Obstet, 2009, 107, S2, p. 439.
60. Lubusky, M., Holuskova, I., Prochazka, M., et al. The incidence of erythrocyte alloimmunization in pregnant women. J Matern Fetal Neonatal Med, 2010, 23 (Suppl. 1), p. 593.
61. Ľubušký, M., Procházka, M. Erytrocytární aloimunizace těhotných žen: Hemolytická nemoc plodu a novorozence. Postgradual Med, 2012, 14, 3, p. 242–246.
62. Macpherson, CR., Zartman, ER. Anti-M antibody as a cause of intrauterine death: a follow up. Am J Clin Pathol, 1965, 43, p. 544–547.
63. Manning, FA. Fetal medicine: principles and practice. Norwalk, Connecticut: Appleton & Lange, 1995.
64. Marshall, CS., Dwyre, D., Eckert, R., Russell, L. Severe hemolytic reaction due to anti-Jk3, Arch Pathol Lab Med, 1999, 123, p. 949–951.
65. Martinez, S., Luna, I., Arriaga, F., et al. Foetus fatal haemolytic disease by anti-Jkb, a case report. Vox Sang, 2007, 93 (Suppl. 1), p. 8.
66. Masopust, J. Hemolytická nemoc novorozenců – význam kritického titru antierytrocytárních protilátek. Neonat Listy, 1998, s. 18–21.
67. Matsumoto, H., Tamaki, Y., Sato, S., Shibata, K. A case of hemolytic disease of the newborn caused by anti-M: serological study of maternal blood. Acta Obstet Gynaecol Jpn, 1981, 33, 4, p. 525–528.
68. Mayne, K., Bowell, P., Woodward, T., et al. Rh immunization by the partial D antigen of category DVa. B J Haematol, 1989, 76, p. 537–539.
69. Mayne, K., Bowell, P., Green, S., Entwistle, C. The significance of anti-S sensitization in pregnancy. Clin Lab Haematol, 1990, 12, 1, p. 105–107.
70. McKenna, DS., Nagaraja, HN., O’Shaughnessy, RW. Management of pregnancies complicated by anti-Kell isoimmunization. Obstet Gynecol, 1999, 93, p. 667–673.
71. Moise, K. Non anti-D antibodies in red cell alloimmunization. Eur J Obstet Gynecol Reprod Biol, 2000, 92, p. 75–81.
72. Moise, K. Red blood cell alloimmunization in pregnancy. Seminars in Hematology, 2005, p. 169–178.
73. Moise, K. Fetal anemia due to non-Rhesus-D red-cell alloimmunization. Semin Fetal Neonatal Med, 2008, 13, 4, p. 207–214.
74. Moise, K. Kell aloimunizace matky může vést k rozvoji anémie plodu. Gynek po promoci. 2009, s. 24–31.
75. Mollison, PL., Engelfriet, CP., Contreras, M. Blood transfusion in clinical medicine. 10th ed. Oxford: Blackwell Science, 1997.
76. Moran, P., Robson, S., Reid, M. Anti-E in pregnancy. Brit J Obstet Gynecol, 2000, 107, p. 1436–1438.
77. Mourant, AE., Kopec, AC., Domaniewska, K. The distribution of human blood groups and other polymorphisms. London: Oxford University Press, 1976.
78. Novaretti, MC., Peres Navarro, S., Leao Bonifacio, S., et al. Comparison of gel test and tube test technique for isoagglutininstitration. Vox Sang, 2007, 93 (Suppl. 1), p. 188–189.
79. Oepkes, D., Seaward, PG., Vandenbussche, FT., et al. Doppler ultrasonography versus amniocentesis to predict fetal anemia. N Engl J Med, 2006, 13, 335, 2, p. 156–164.
80. Penka, M., Tesařová, E. Hematologie a transfuzní lékařství II. 1. vyd. Praha: Grada Publishing, 2012.
81. Pětroš, M., Ľubušký, M., Šimetka, O., Procházka, M. Aloimunizace těhotných žen non-RhD erytrocytárními antigeny: přehledový článek. Čes Gynek, 2010, 75, s. 325–333.
82. Ponťuch, A., Hrubiško, M., Michaličková, J. Hemolytická choroba novorozencov. 1. vyd. Martin: Osveta, 1970.
83. Queenan, JT., Smith, BD., Haber, JM., et al. Irregular antibodies in the obstetric patient. Obstet Gynecol, 1969, 34, 6, p. 767–771.
84. Raman, L., Amstrong, B., Smart, E. Principles of laborator techniques. Journal compilation. Oxford: Blackwell Publishing, 2008, p. 33–60.
85. Reid, ME., Lomas-Francis, C. The blood group antigen facts Book. 2nd ed. New York: Elsevier Academic Press, 2004.
86. Sakuma, K., Suzuki, H., Ohto, H., et al. First case of hemolytic disease of the newborn due to anti-Ula antibodies. Vox Sang, 1994, 66, p. 293–294.
87. Smart, E., Armstrong B. Blood group systems. Journal compilation. Oxford: Blackwell Publishing 2008, p. 68–92.
88. Southcott, J., Tanner, J., Anstee, D. The expression of human blood group antigens during erythropoesis in a cell culture systém. Blood, 1999, 93, p. 4425–4435.
89. Stanworth, S., Fleetwood, P., de Silva, M. Severe hemolytic disease of the newborn due to anti-Jsb. Vox Sang, 2001, 81, p. 134–135.
90. Stone, B., Marsh, WL. Haemolytic disease of the newborn caused by anti-M. Br J Haematol, 1959, 5, p. 344–347.
91. Studničková, M., Ľubušký, M., Ordeltová, M., Procházka, M. Možnosti stanovení fetomaternální hemoragie. Čes Gynek, 2010, 75, 5, s. 443–446.
92. Telischi, M., Behzad, O., Issitt, PD., Pavone, BG. Hemolytic disease of the newborn due to anti-N. Vox Sang, 1976, 31, 2, p. 109–116.
93. Ting, JY., Ma, ES., Wong, KY. A case of severe haemolytic disease of the newborn due to anti-Di(a) antibody. Hong Kong Med J, 2004, 10 p. 247–249.
94. Tippet, P., Lomas-Francis, C., Wallace, M. The Rh antigen D: partial D antigens and associated low incidence antigens. Vox Sang, 1996, 70, p. 123–131.
95. Trevett, TN., Moise, KJ. Twin pregnancy complicated by severe hemolytic disease of the fetus and newborn due to anti-g and anti-C. Obstet Gynecol, 2005, 106, p. 1178–1180.
96. Turgeon, ML. Fundamentals of immunohematology: Theory and technique. Philadelphia: Lea and Febiger, 1989, p. 322–343.
97. Uchikawa, M., Shibata, Y., Tohyama, H., et al. A case of hemolytic disease of the newborn due to anti-Dib antibodies. Vox Sang. 1982, 42, p. 91–92.
98. Van Dongen, H., Klumper, FJ., Sikkel, E., et al. Non-invasive tests to predict fetal anemia in Kell-alloimmunized pregnancies. Ultrasound Obstet Gynecol, 2005, 25, 4, p. 341–345.
99. Van Kamp, IL., Klumper, FJ., Bakkum, RS., et al. The severity of immune fetal hydrops is predictive of fetal outcome after intrauterine treatment. Am J Obstet Gynecol, 2001, 185, 3, p. 668–673.
100. Van Wamelen, DJ., Klumper, FJ., de Haas, M., et al. Obstetric history and antibody titr in estimating severity of Kell alloimmunization in pregnancy. Obstet Gynecol, 2007, 109, 5, p. 1093–1098.
101. Vescio, LA., Farina, D., Rogido, M., Sola, A. Hemolytic disease of the newborn caused by anti-Fyb. Transfusion, 1987, 27, 4, p. 366.
102. Wagner, T., Resch, B., Reiterer, F., et al. Pancytopenia due to suppressed hematopoesis in a case of fatal hemolytic disease of the newborn associated with anti-K supported by molecular K1 typing. J Pediatr Hematol Oncol, 2004, 26, p. 13–15.
103. Weinstein, L., Taylor, ES. Hemolytic disease of the neonate secondary to anti-Fya. Am J Obstet Gynecol, 1975, 1, 121, 5, p. 643–645.
104. Wenk, RE., Goldstein, P., Felix, JK. Alloimmunization by hr´(c) hemolytic disease of newborns and perinatal management. Obstet Gynecol 1986, 67, 5, p. 623–626.
105. Whittle, M. Rhesus haemolytic disease. Arch Dis Childhood, 1992, 67, p. 65–68.
106. Žižka, Z., Hájek, Z., a kol. Rizikové a patologické těhotenství. Praha: Grada Publishing, 2004, s. 83–94.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2013 Issue 1
-
All articles in this issue
- History of Department of Obstetrics and Gynecology in Olomouc
- “Learning curve” robotic radical hysterectomycompared to standardized laparoscopy assisted radical vaginal and open radical hysterectomy
- Sacrospinous fixation for vaginal vault prolapse after hysterectomy sec. Miyazaki – longterm results
- RHD genotyping from cell-free fetal DNA circulating in pregnant women peripheral blood and sensitivity assessment of innovated diagnostic approaches for introduction into the clinical practice
- Births of children of low and very low weight at the University Hospital in Olomouc (1993–2011)
- Incidence of erythrocyte alloimmunization in pregnant women in olomouc region
- Epidemiology and management of thyroid disorders in pregnancy
- Influence of the length of cultivation of no early cleavage embryos on the IVF success rate
- The occurence of genetic trombophilic markers in patients evaluated for infertility
- Objective assessment of the tissue trauma in surgery of endometrial cancer
- Bleeding disorders in pregnancy
- Erythrocyte alloimmunization in pregnant women, clinical importance and laboratory diagnostics
- Disorders of the thyroid gland in pregnancy
- Status of bone mineral density after the long-standing application of contraception Depo-Provera
- Implementation and applications of robotic surgery within gynecologic oncology and gynecology; analysis of the first thousand cases
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Influence of the length of cultivation of no early cleavage embryos on the IVF success rate
- Sacrospinous fixation for vaginal vault prolapse after hysterectomy sec. Miyazaki – longterm results
- Erythrocyte alloimmunization in pregnant women, clinical importance and laboratory diagnostics
- Bleeding disorders in pregnancy
