Chirurgie bránice v léčbě pokročilého karcinomu ovaria
Diaphragmatic surgery in advanced ovarian cancer therapy
Objective:
Advanced ovarian cancer is a lethal disease. More than 75% of women with ovarian cancer are diagnosed in advanced stage FIGO IIIC–IV. The combination of surgical cytoreduction without residual tumor, and chemotherapy is the only way to prolong overall survival of women with advanced ovarian cancer.
Design:
Systematic review.
Subject and methods:
Current literature review.
Conclusion:
Due to frequent involvement of the diaphragm in women with advanced ovarian cancer and the effort of optimal debulking is the inclusion of diaphragmatic surgery necessary for so affected women. Diaphragmatic surgery increases the rates of optimal cytoreduction, improves survival of women with advanced ovarian cancer and has acceptable morbidity rate.
Keywords:
advanced ovarian cancer, diaphragmatic surgery, optimal debulking, residual disease
Authors:
V. Kalist 1; P. Havelka 1; M. Mlčoch 1; Z. Adamík 1; J. Klein 2,3
Authors‘ workplace:
Gynekologicko-porodnické oddělení, Krajská nemocnice T. Bati, a. s., Zlín, přednosta MUDr. Z. Adamík, Ph. D.
1; Chirurgické oddělení, Krajská nemocnice T. Bati, a. s., Zlín, přednosta prof. MUDr. J. Klein, Ph. D.
2; Fakulta zdravotníctva, Trenčianska univerzita Alexandra Dubčeka, Trenčín, Slovenská republika
3
Published in:
Ceska Gynekol 2015; 80(5): 333-338
Overview
Cíl studie:
Pokročilý karcinom ovaria je letální onemocnění. Více než 75 % žen s karcinomem ovaria je diagnostikováno v pokročilém stadiu FIGO IIIC–IV. Kombinace chirurgické cytoredukce s dosažením nulového makroskopického rezidua a chemoterapie jsou jedinou cestou k prodloužení celkového přežívání žen v tomto stadiu nemoci.
Typ studie:
Přehledový článek.
Materiál a metoda:
Literární přehled recentních prací.
Závěr:
Vzhledem k častému postižení bránice u žen s pokročilým karcinomem ovaria a snaze o dosažení optimální cytoredukce je zahrnutí výkonů na bránici u takto postižených žen nezbytné. Chirurgie bránice zvyšuje pravděpodobnost dosažení optimální cytoredukce, koreluje s lepším přežíváním žen s pokročilým karcinomem ovaria a má akceptovatelnou morbiditu.
Klíčová slova:
pokročilý karcinom ovaria, chirurgie bránice, cytoredukce, nádorové reziduum
ÚVOD
Pokročilý karcinom ovaria (advanced ovarian cancer, AOC) je letální onemocnění. Přes medicínský pokrok, nové tumorové markery a kvalitnější zobrazovací metody se obvykle nedaří diagnostikovat karcinom ovaria ve včasném stadiu, které dává pacientce naději na vyléčení. Chybění efektivního screeningového testu a diagnostika onemocnění v pozdním stadiu jsou příčinou vysoké mortality na toto onemocnění. Bohužel až 75 % žen s karcinomem ovaria je diagnostikováno v pokročilém stadiu FIGO IIIC–IV, kdy nádor postihuje celou dutinu břišní. V roce 1975 Griffits popsal inverzní vztah mezi velikostí nádorového rezidua na konci operace a přežíváním pacientek [14]. Od této průkopnické práce již několik studií potvrdilo význam nádorového rezidua na konci operace u žen s AOC [4, 12, 17, 19]. Velikost nádorového rezidua na konci operace je nejdůležitější prognostický faktor, který významně ovlivňuje přežívání žen s AOC. Za optimální cytoredukční výkon považujeme v současné době operaci, u které dosáhneme na jejím konci nulového makroskopického rezidua (R0). Kompletní chirurgická cytoredukce všech makroskopických ložisek je hlavním cílem chirurgické léčby u AOC [7, 19]. U takto provedené operace můžeme očekávat lepší odpověď na chemoterapii, snížení rezistence na platinu a prodloužení celkového přežívání [23].
Pacientky s AOC mají časté postižení epigastria, nejčastěji bránice. Einekel a kol. uvádí metastatické postižení bránice u 91 % žen [9]. Další autoři uvádějí postižení bránice u 40–50 % žen s AOC [5, 11]. Častější je postižení pravé bránice [5], nicméně současné postižení levé je téměř v 80 % případů [11]. Postižení bránice, společně s infiltrací střevních kliček a struktur porty hepatis, patří mezi nejčastější místa, která znemožní provedení řádné cytoredukce [12]. Chceme-li operovat optimálně, tj. bez nádorového rezidua, měli bychom do operačního algoritmu u pokročilého karcinomu ovaria, v rámci primární nebo sekundární cytoredukce, zahrnout i výkony na bránici. Ty vyžadují především dobrý operační přístup, adekvátní laparotomii, vhodný rozvěrač a dobrou znalost anatomie jater a bránice.
ANATOMIE
Znalost anatomie jater, jejich závěsů a retroperitoneálních cévních struktur je důležitou podmínkou výkonů na bránici. Povrch jater kryje téměř po celé jejich ploše tunica serosa, která přechází do jejich závěsů. Ligamentum falciforme hepatis je peritoneální duplikatura, která připojuje játra k nástěnnému peritoneu bránice a přední břišní stěny. V jeho ventrokaudálním okraji se táhne ligamentum teres hepatis, zbytek po pupeční žíle. Ligamentum falciforme hepatis dále pokračuje do předního listu pravého a levého ligamentum coronarium hepatis, které zajišťují přímý peritoneální přechod z jater na bránici. Přední list pravého a levého ligamentum coronarium hepatis pak pokračuje laterálně, splyne se zadním listem pravého a levého ligamentum coronarium hepatis a zformuje pravé a levé ligamentum triangulare hepatis. Oba listy pravého a levého ligamentum coronarium hepatis lemují oblast, která je vlevo menší a kde jsou játra přímo srostlá s bránicí a se zadní stěnou břišní a nejsou kryta peritoneem. Tato retroperitoneálně uložená oblast jater se nazývá area nuda neboli pars affixa [6].
Disekce výše zmíněných ligament je nutná k tomu, abychom mobilizovali játra a zpřístupnili celou bránici. Zároveň otevíráme prostor mezi area nuda jater a bránicí, který obsahuje důležité cévní struktury. Anatomická znalost průběhu těchto cév nám umožní vyhnout se jejich poranění [8].
Venae hepaticae, zpravidla tři (někdy jen dvě) žíly opouštějí játra a po krátkém průběhu vstupují do přední stěny suprahepatální části dolní duté žíly mezi horním povrchem jater a bránicí. Tento vstup jaterních žil do vena cava inferior je lokalizován za peritoneální duplikaturou ligamentum falciforme hepatis a mediální částí předního listu pravého ligamentum coronarium hepatis. Disekce těchto ligament při mobilizaci jater může vést k poranění jaterních žil, případně dolní duté žíly [8, 11].
Arteriae phrenicae inferiores jsou párové větve vystupující z aorta abdominalis těsně pod bránicí a větvící se po její dolní ploše. Venae phrenicae inferiores jsou parietální přítoky dolní duté žíly ze spodiny plochy bránice.
Nervus phrenicus je motorickým nervem bránice. Vychází z krčního plexu C4, sestupuje aperturou thoracis superior do mediastina a po stranách perikardu k bránici. Dělí se na variabilní počet větví, které vstupují do svaloviny nebo centrum tendineum bránice. Pravý nervus phrenicus vstupuje do bránice mediálně skrze hiatus vena cava inferior, levý vstupuje do bránice více laterálně. Na možnost poranění frenického nervu musíme myslet především při resekci levé bránice [11].
TECHNIKA VÝKONU
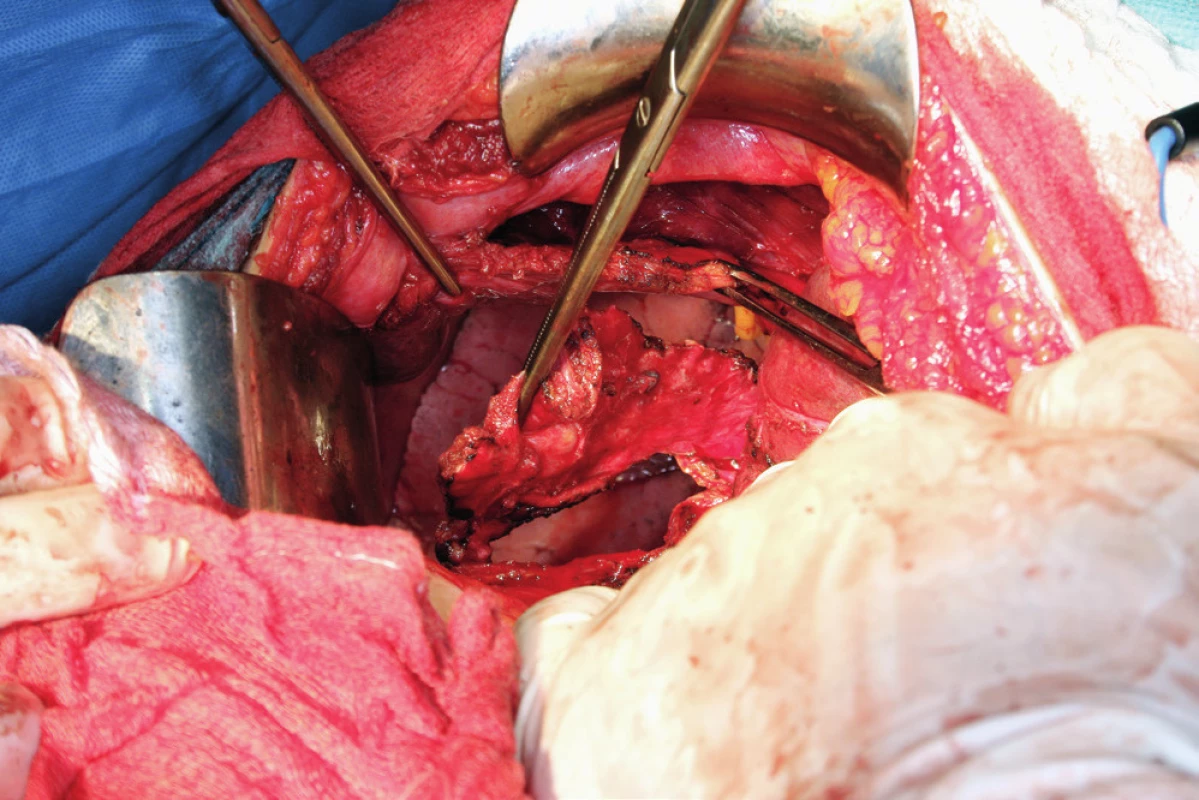
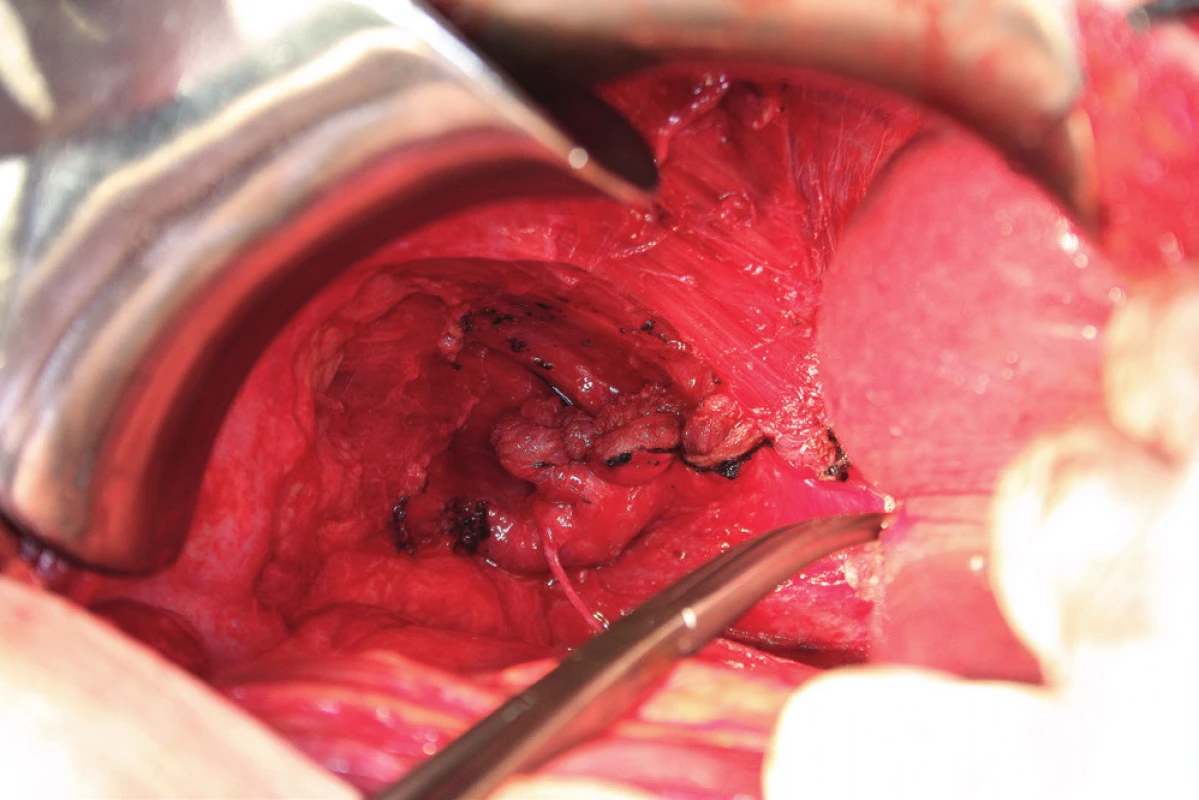
Pacientka leží na zádech, operační přístup je zajištěn dolní a horní střední laparotomií, tedy řezem od procesus xyphoideus po symphysis pubica. Vhodný je k operačnímu stolu fixovaný rozvěrač, který umožní elevaci přední břišní stěny a žeberního oblouku a zajistí optimální přístup do subfrenické oblasti. Důležitá je aspekce celé dutiny břišní a zhodnocení optimální operability. Výkon na bránici následuje před výkonem nebo až po výkonech v malé pánvi a dutině břišní. Gouy a kol. uvádí, že pokud nejsou schopni provést optimální cytoredukci, výkon na bránci neprovádí [15]. Klíčová při operaci bránice je mobilizace jater, která spočívá v disekci ligamentum falciforme hepatis, nebo v případě metastatického postižení v jeho exstirpaci. Uvolnění tohoto spojení jater k přední břišní stěně nazývá Einekel parciální mobilizací jater [8] (obr. 1). Kompletní mobilizaci pravého laloku jater charakterizuje úplná disekce obou listů ligamentum coronarium hepatis a ligamentum triangulare hepatis vpravo a uvolnění jater od jejich spojení s bránicí, v místě area nuda a od zadní břišní stěny až k pravé ledvině a nadledvině. Pozornost je nutná při disekci pravého ligamentum triangulare hepatis, které je těsně nad pravou ledvinou a nadledvinou [21] (obr. 2, 3). Nyní můžeme pravý lalok jater rotovat mediálně a inferiorně, což umožní pečlivé posouzení stavu celé pravé bránice [5] (obr. 4, 5). Mobilizace levého laloku jater je vzhledem k malé oblasti area nuda na levé straně méně častá a resekci levé bránice je možné provést i bez úplné mobilizace levého laloku jater [21]. Samotný rozsah výkonu na bránici závisí od stupně jejího postižení. V závislosti na hloubce infiltrace jednotlivých anatomických vrstev se popisují 4 skupiny: 1. povrchová infiltrace peritonea, 2. infiltrace subperitoneálního prostoru, 3. infiltrace svaloviny bránice nebo centrum tendineum, 4. infiltrace pleury [9]. V zásadě literatura uvádí tři typy výkonu: od destrukce – koagulace malých ložisek – k peritonektomii až k samotné resekci bránice [3, 8, 25]. Koagulace, provedená pomocí elektrochirurgie, je vyhrazena pro malá ložiska, noduly do 2–3 mm. K jejímu provedení většinou postačí parciální mobilizace jater.
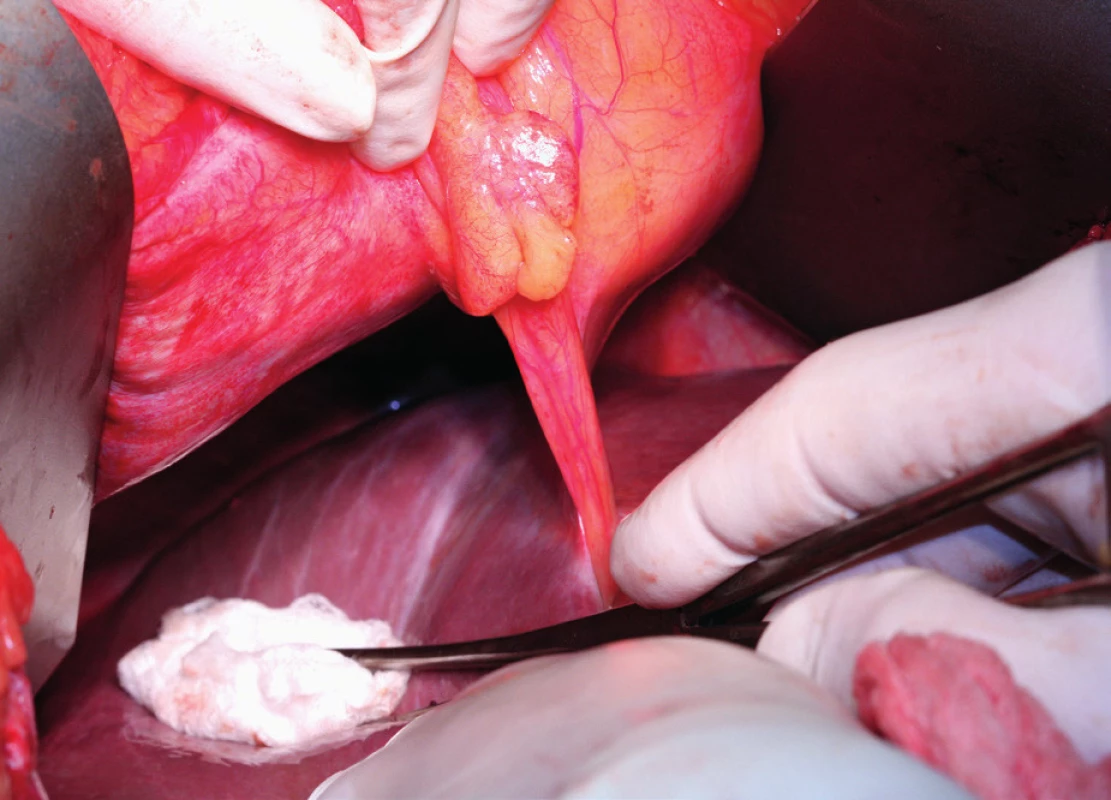
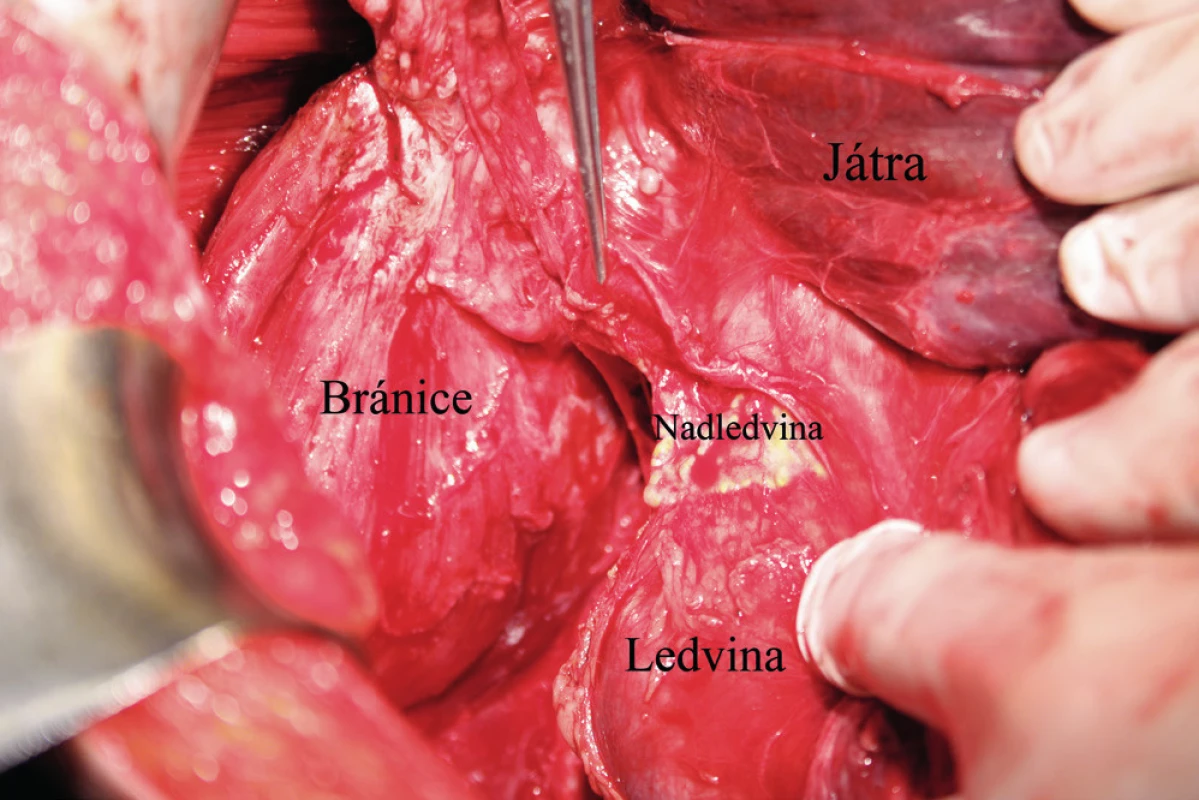
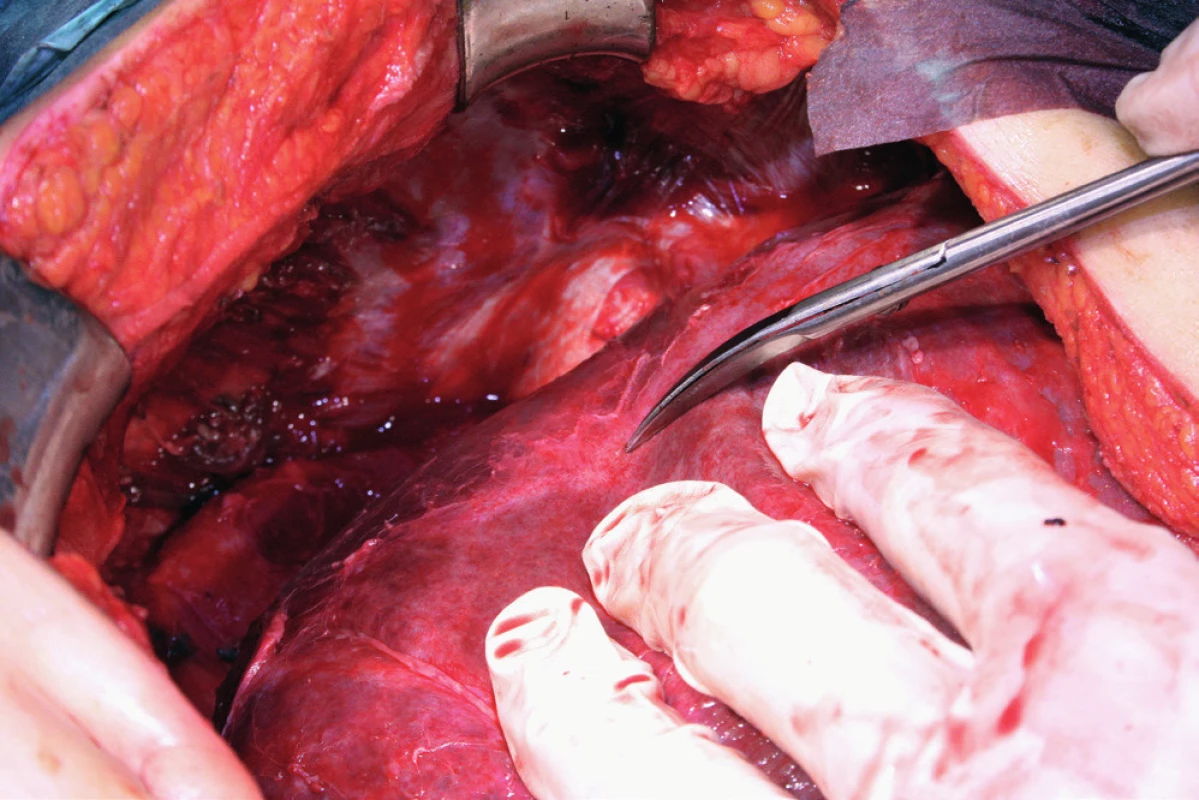
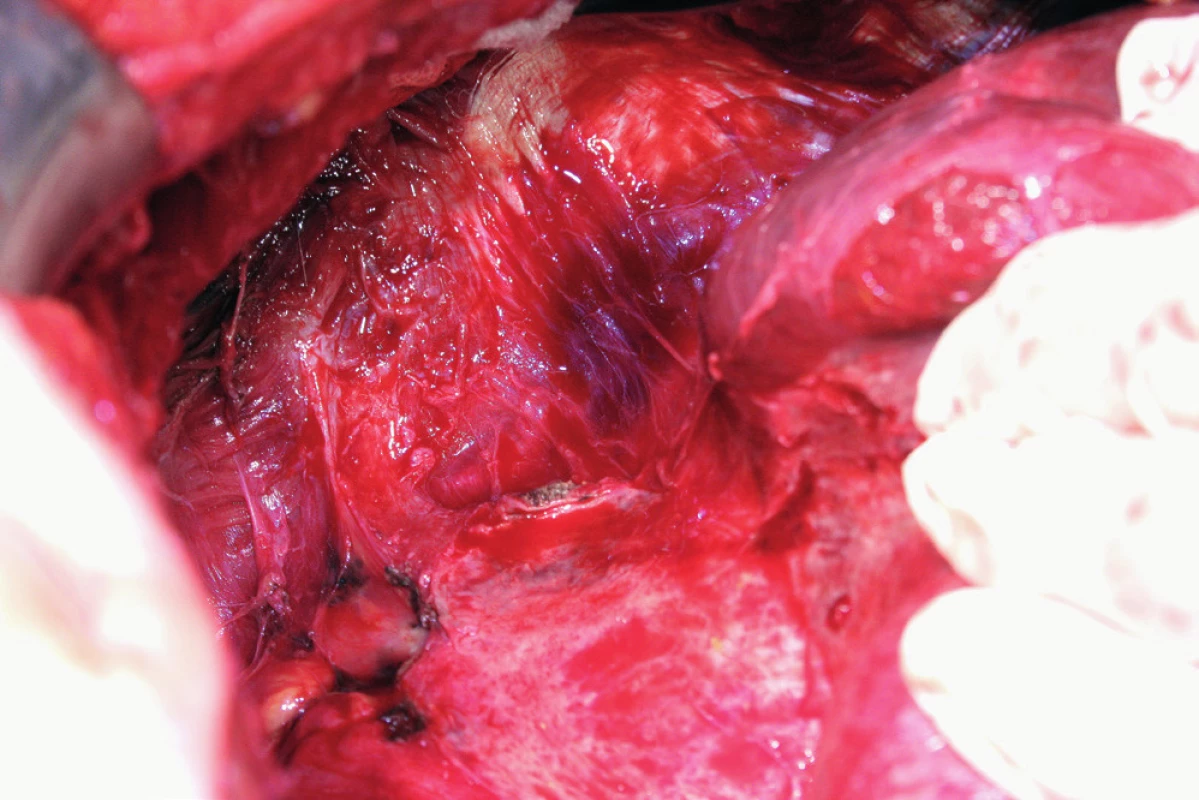
Peritonektomie (stripping) je definována jako sloupnutí (odstranění) peritonea od bránice ležící pod ním. Rozsah výkonu je určen stupněm postižení. V případě strippingu peritonea celé bránice je nutná kompletní mobilizace jater. Výkon začíná incizí peritonea mimo postiženou oblast, zachycením okraje peritonea do Allisových kleští a následné separaci peritonea od bránice směrem shora dolů, často až k hepatorenálnímu recesu a od laterálního okraje k mediálnímu. Provádíme jej tupou (digitálně, tampon) nebo ostrou (nůžky, elektrochirurgie) preparací [8, 16] (obr. 6). Obtížnější je separace peritonea v mediální části, od centrum tendineum bránice, protože spojení peritonea k centrum tendineum bránice je mnohem silnější než ke svalovině bránice [8]. Právě v místě centrum tendineum dochází z tohoto důvodu nejčastěji k otevření pleurální dutiny [13]. Separace může být rovněž obtížnější v rámci IDS (Interval Debulking Surgery), tedy po neadjuvantní chemoterapii, z důvodu regresivních změn podmíněných chemoterapií [22]. Ke zjištění případného otevření pleurální dutiny používáme „bubble test“. V Trendelenburgově poloze aplikujeme subdiafragmaticky fyziologický roztok za stálé ventilace plic. Absence úniku bublin vzduchu je známkou neporušené pleurální dutiny [8, 11].
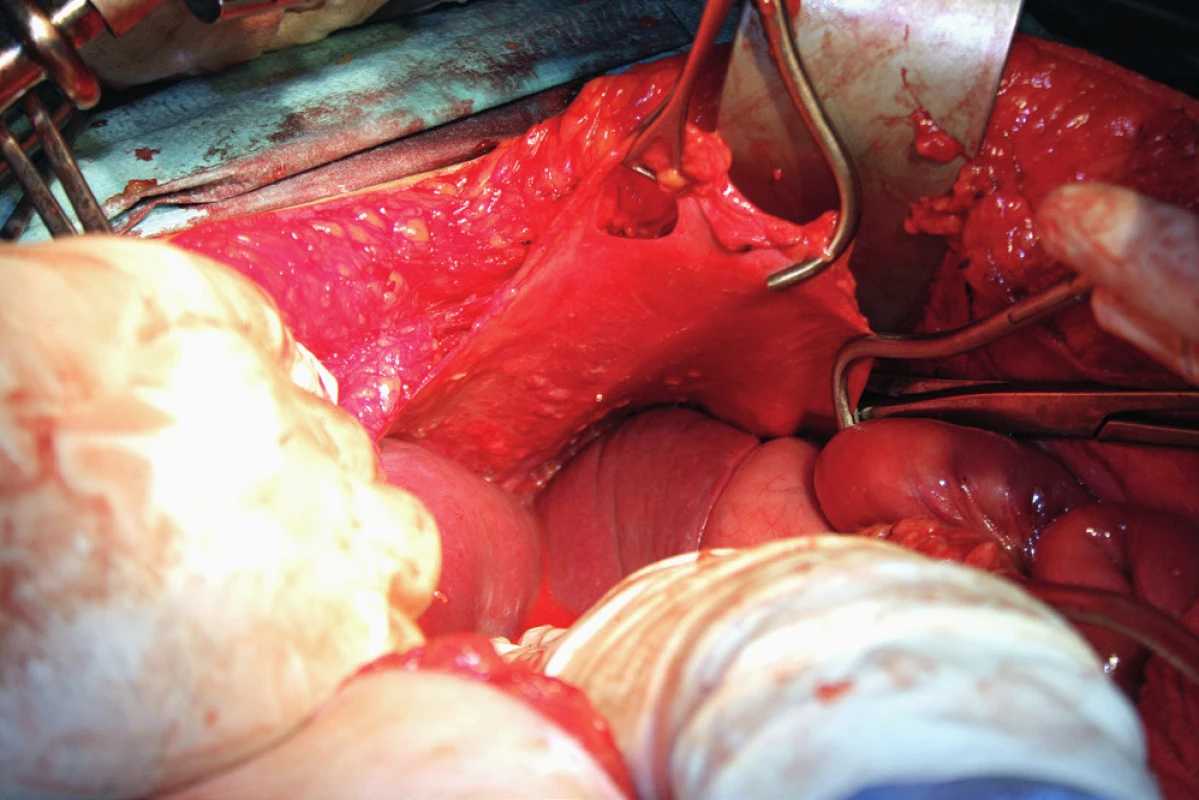
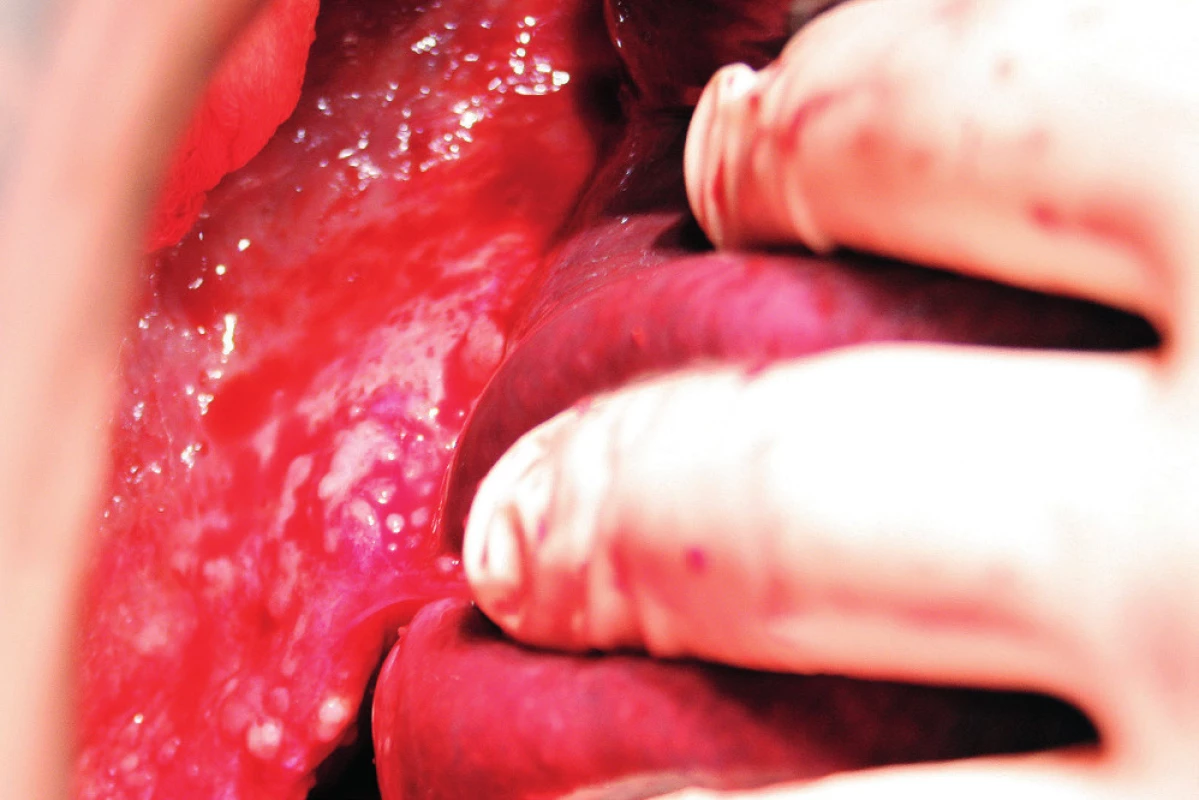
Resekci bránice definujeme jako resekci svaloviny bránice nebo centrum tendineum s přilehlým peritoneem a pleurou. Tento výkon je nutný, pokud nádorový proces prorůstá skrze peritoneum do svaloviny bránice, do centrum tendineum nebo až na pleuru. Často zjistíme nutnost resekovat bránici až peroperačně. Predikovat hloubku infiltrace, a tedy potřebu resekce bránice předoperačně není prakticky možné. Kapnik a kol. vyhodnocovali vztah mezi velikostí nádorového ložiska a infiltrací pleury. Ve své práci zjistili, že všechna ložiska větší než 5 cm infiltrovala bránici a pleuru, zatímco žádné z ložisek velikosti 4 cm a méně bránici neinfiltrovalo [20]. Už samotná předoperační diagnostika postižení bránice pomocí zobrazovacích metod je obtížná. Fanfani a kol. uvádějí ve své práci správnou předoperační detekci postižení bránice pomocí zobrazovacích metod jen ve 42,5 %, zatímco staging laparoskopie správně odhalila postižení bránice v 93,1 % případů [13]. Laparoskopie je považována za nejlepší metodu ke zhodnocení rozsahu onemocnění a optimální operability [25]. Resekce bránice je nejčastěji provedena pomocí elektrochirurgie nebo nůžek. Otevření pleurální dutiny potom umožní aspekci plic a pleurálního prostoru (obr. 7). Někteří autoři používají za tímto účelem torakoskopii. Defekt bránice, pokud není rozsáhlý, je potom uzavřen pomalu resorbovatelným nebo neresorbovatelným vláknem pokračujícím nebo jednotlivými stehy (obr. 8). V případě široké resekce bránice je nutné použití síťky k provedení sutury defektu, což ale není příliš časté [10]. Pohrudniční dutinu po resekci bránice obvykle drénujeme jedním hrudním drénem (obr. 9). Pokud nepoužijeme drenáž pleurální dutiny, do pleurálního prostoru zavedeme skrze defekt Foleyův katétr. K evakuaci pneumotoraxu je anesteziolog vyzván k maximálnímu inspiriu. Dotažení posledního stehu provedeme ihned po vytažení Foleyova katétru z pleurální dutiny. Následně je provedena kontrola těsnosti sutury „bubble testem“ [3, 5, 13, 23].
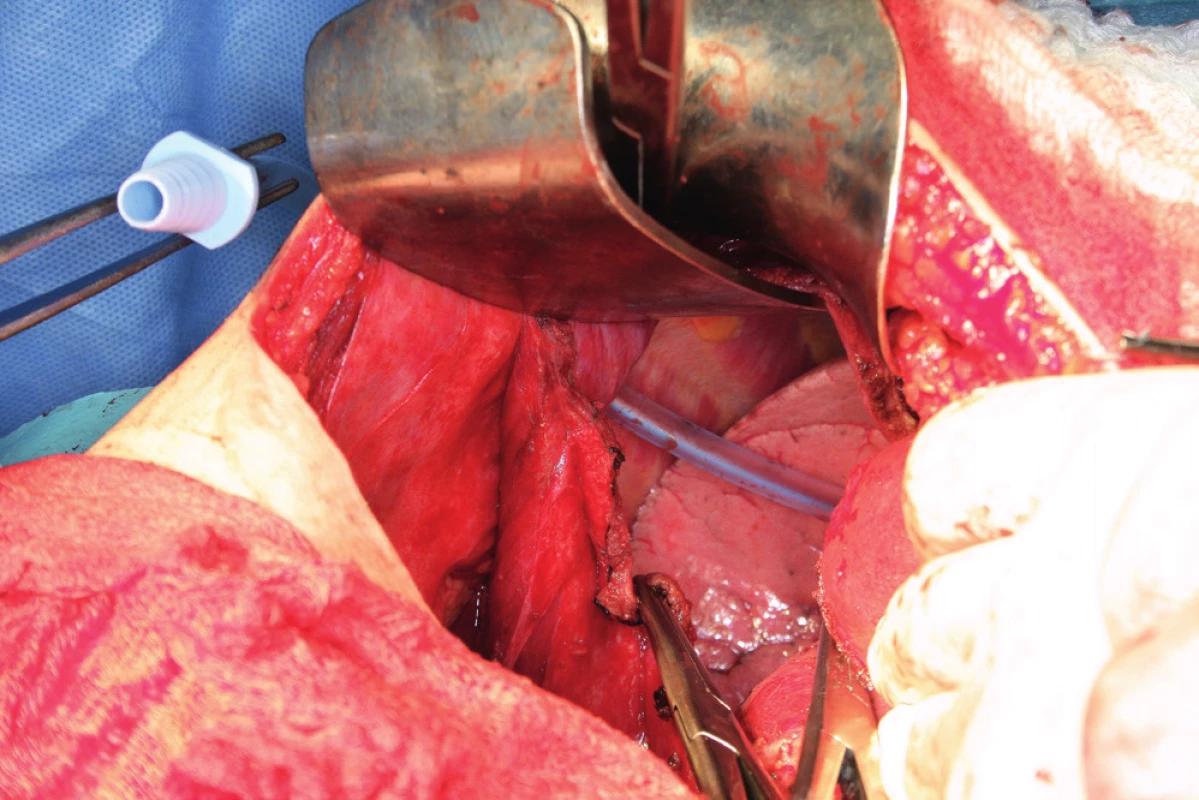
Resekce bránice je spojená s rizikem poranění jater, plic, cévních struktur a nervus phrenicus, proto bychom měli resekovanou plochu bránice omezit na nejméně nutnou.
KOMPLIKACE VÝKONU
Peroperační komplikace souvisejí s mobilizací jater a následnou peritonektomií, případně resekcí bránice. Poranění větví bráničních cév není závažné a vystačíme s koagulací nebo prošitím. Závažnější komplikací je poranění jaterní nebo dolní duté žíly, které vyžaduje suturu poraněného místa. Lacerace jater při jejich mobilizaci může vyžadovat suturu nebo jen lokální hemostatické ošetření. Resekce bránice může vést k poranění n. phrenicus, což se projeví v pooperačním období její parézou a elevací v RTG obraze. U dospělého jedince nezpůsobí jednostranná paréza bránice větší omezení. Při výkonech na levé bránici může dojít k otevření perikardu, které vyžaduje jeho suturu.
Nejčastější pooperační komplikací je pleurální výpotek s literárně uváděnou incidencí 0–59 % a pneumotorax s výskytem 0–33 % [10, 13, 18, 22].
Riziko vzniku pleurálního výpotku závisí od typu výkonu na bránici. Otevření pleurální dutiny zvyšuje pravděpodobnost výpotku. Úplná mobilizace jater s obnažením area nuda je spojená se zvýšeným rizikem oproti parciální mobilizaci 52 % vs. 16 %. Také resekce bránice větší než 5 cm zvyšuje toto riziko (oproti resekci menší části 54,1 % vs. 23,5 %) [13]. Za největší rizikové faktory vzniku pleurálního výpotku považuje Eisenhauer úplnou mobilizaci jater a otevření pleurální dutiny [10]. Jeho přítomnost zjistíme pooperačně provedeným RTG snímkem plic, případně ultrasonografickým vyšetřením. Nejčastěji se fluidotorax rozvíjí 2.–5. pooperační den a podle klinického stavu jej můžeme řešit konzervativně, punkcí nebo zavedením hrudního drénu [13]. Nutnost provedení torakocentézy nebo zavedení hrudního drénu v pooperačním období se literárně uvádí v rozmezí 0–44 % [18]. Po výkonu na bránici, kde je vysoké riziko vzniku pleurálního výpotku v pooperačním období, je zavedení drénu peroperačně vhodnou alternativou [18, 25]. Naopak, někteří autoři nepovažují zavedení hrudního drénu za nutné [3, 10, 23]. Přes kontroverzní názory na preventivní zavedení hrudního drénu Tsolakidis uvádí, že ženy s peroperačně zavedeným drénem v jejich souboru se cítily lépe díky absenci dyspnoe a zbavily se drénu rychleji (5.–10. den) než ženy, které vyžadovaly zavedení drénu pooperačně [25]. Z tohoto důvodu doporučuje rutinní zavedení drénu peroperačně u žen s AOC vyžadujících resekci bránice. Zároveň uvádí pozoruhodné pozorování, že ascites byl přítomný u všech žen, u kterých se vyvinul pooperačně fluidotorax. Předkládá, že rozvoj fluidotoraxu je spíše podmíněn transferem ascitické tekutiny do pleurální dutiny než primárně hrudním procesem. Defekt bránice, přítomnost ascitu, rozsáhlé obnažení area nuda, pooperační uvolnění VEGF (Vascular Endothelial Growth Factor) nebo zánětlivých mediátorů, snížení nitrohrudního negativního tlaku podmíněné pooperační bolestí nebo parézou n. phrenicus, jsou možné mechanismy rozvoje této komplikace [10, 25]. Zhodnotit samotný vliv chirurgie bránice na celkovou pooperační morbiditu je obtížné, protože chirurgie bránice je většinou součástí dalších resekčních výkonů: resekce střeva, resekce jater, distální pankreatektomie, splenektomie a další.
ZÁVĚR
Chirurgická cytoredukce spojená s chemoterapií s platinovým derivátem jsou základní léčebné modality AOC. Dosažení optimální cytoredukce, tedy výkonu bez makroskopického rezidua, je klíčové pro prognózu pacientek s AOC. Postižení bránice se vyskytuje u více než poloviny žen s AOC. Proto jsou ve snaze o dosažení R0 výkony na bránici nezbytné. Chirurgie bránice zvyšuje pravděpodobnost dosažení optimální cytoredukce, koreluje s lepším přežíváním žen s AOC a má akceptovatelnou morbiditu [1]. Dobré znalosti anatomie a úplná mobilizace jater umožní řádnou exploraci bránice a minimalizaci peroperačních komplikací v průběhu výkonu na bránici. Výsledné nádorové reziduum je mezi ostatními prognostickými faktory onemocnění (věk, stadium, grading, histologický typ) jediným ovlivnitelným prognostickým faktorem, který závisí od kvality operačního týmu a významně ovlivňuje celkové přežívání [15]. O prognóze pacientky do značné míry rozhoduje chirurg provádějící primární operační výkon.
MUDr. Vladimír Kalist
Gynekologicko-porodnické oddělení
Onkogynekologické centrum KNTB, a.s.
Havlíčkovo nábřeží 600
762 75 Zlín
e-mail: kalist@pobox.sk
Sources
1. Aletti, GD., Dowdy, SC., Podratz, KC., Cliby,WA. Surgical treatment of diaphragm disease correlates with improved survival in optimally debulked advanced stage ovarian cancer. Gynecol Oncol, 2006, 100, p. 283–287.
2. Aletti, GD., Gallenberg, MM., Cliby,WA., et al. Current management strategies for ovarian cancer. Mayo clinic proceedings, 2007, 82(6), p. 751–770.
3. Bashir, S., Geradi, MA., Giuntoli II, RL., et al. Surgical technice of diafragma full-thickness resection and trans-diaphragmatic decompression of pneumothorax during cytoreductive surgery for ovarian cancer. Gynecol Oncol, 2010, 119, p. 255–258.
4. Bristow, RE., Tomacrus, RS., Armstrong, DK., et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a metanalysis. J Clinical Oncol, 2002, 20, p. 1248–1259.
5. Cliby,W., Dowdy, S., Feitoza, S., et al. Diaphragm resection for ovarian cancer: technice and short-term complications. Gynecol Oncol, 2004, 94, p. 655–660.
6. Čihák, R. Anatomie 2. Praha: Grada, 1986, s. 123–125.
7. Du Bois, A., Reuss, A., Pujade-Lauraine, E., et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: a combined exploratory analysis of 3 prospectively randomized phase 3 mulicentrer trials: by the arbeitsgemeinschaft gynaekologische onkologie studiengruppe ovarialkarzinom (AGO-OVAR) and the grupe d´Investigateurs nationaux pour les etudes des cancers de I´Ovaire (GINECO). Cancer, 2009, 115, 6, p. 1234–1244.
8. Einekel, J. Techniques of diaphragmatic surgery. http://www.esgo.org/Education/ PublishingImages /119.pdf.
9. Einekel, J., Ott, R., Bauman, UD., et al. Characteristics and management of diaphragm involvement in patiens with primary advanced-stage ovarian, Falopian tube or peritoneal cancer. Intern J Gynecol Cancer, 19, p. 1288–1297.
10. Eisenhauer, EL., D´Angelica, MI., Abu-Rustum, NR., et al. Incidence and management of pleural effusion after diaphragm peritonectomy or resection for advanced mullerian cancer. Gynecol Oncol, 2006, 103, p. 871–877.
11. Eisenhauer, EL., Chi, DS. Liver mobilization and diaphragm peritonectomy/ resection. Gynecol Oncol, 2007, 104, p. S25–S28.
12. Eisenkop, SM., Spirtos, NM. What are the current surgical objectives, strategies, and technical capabilities of gynecologic oncologists treating advanced epithelial ovarian cancer? Gynecol Oncol, 2001, 82, p. 489–497.
13. Fanfany, F., Gagotti, A., Gallotta, V., et al. Upper abdominal surgery in advanced and reccurent ovarian cancer: Role of diaphragmatic surgery. Gynecol Oncol, 2010, 160, p. 497–501.
14. Griffiths, CT. Surgical resection of tumor bulk in the primary treatmnet of ovarian carcinoma. NCI Monogr, 1975, 42, p. 101–104.
15. Gouy, S., Chereau, E., Custodio, AS., et al. Surgical procedures and morbidites of diaphragmatic surgery in patients undergoing initial or interval debulking surgery for advanced-stage ovarian cancer. J Amer College Surg, 2010, 210, p. 509–514.
16. Halkia, E., Efstathiou, E., Spiliotis, J., et al. Management of diaphragmatic peritoneal carcinomatosis: surgical anatomy guidelines and results. JBUON, 2014, 19(1), p. 29–33.
17. Hoskins, WJ., McGuire, WP., Brady, MF., et al. The effect of diameter of largest residual disease on survival after primary cystoreductive sugery in patients with suboptimal residual epithelial ovarian carcinoma. Amer J Obstet Gynecol, 1994, 170, p. 974–979.
18. Chéreau, E., Rouzier, R., Gouy, S., et al. Morbidity of diaphragmatic surgery for advanced ovarian cancer: Retrospective study of 148 cases. Eur J Surg Oncol, 2011, 37(2), p. 175–180.
19. Chi, DS., Eisenhauer, EL., Lang, J., et al. What is the optimal goal of primary cytoreductive Surgery for bulky stage IIIC epithelial ovarian carcinoma (EOC)? Gynecol Oncol, 2006, 103, p. 559–564.
20. Kapnik, JS., Griffiths, TC., Finkler, NJ. Ocult pleural involvement in stage III ovarian carcinoma: role of diaphragmatic resection. Gynecol Oncol, 1990, 39(2), p. 135–138.
21. Kehoe, SM., Eisenhauer, EL., Chi, DS. Upper abdominal surgical procedures: Liver mobilization and diaphragm peritonectomy/resection, splenectomy, and distal pancreatectomy. Gynecol Oncol, 2008, 111, p. S51–S55.
22. Papadia, A., Morotti, M. Diaphragmatic surgery during cytoreduction for primary or recurrent epithelial ovarian cancer: a review of the literatue. Arch Gynecol Obstet, 2013, 287, p. 733–741.
23. Pathiraja, PNJ., Garuto-Campanile, R., Tozzi, R. Diaphragmatic peritonectomy versus full thickness diaphragmatic resection and pleurectomy during cytoreduction in patiens with ovarian cancer. Intern J Surg Oncol, Article ID 876150, 2013, 6 pages, http://www.hindawi.com/journals/ijso/2013/876150/.
24. Shih, KK., Chi, DS. Maximal cytoreductive effort in epithelial ovarian cancer surgery. J Gynecol Oncol, 2010, 21, 2, p. 75–80.
25. Tsolakidis, D., Amant, F., Van Gorp, T., et al. Diaphragmatic surgery during primary debulking in 89 patients with stage IIIB-IV epithelial ovarian cancer. Gynecol Oncol, 2010, 116, p. 489–496.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2015 Issue 5
-
All articles in this issue
- Robotem asistovaný staging karcinomu endometria – vyhodnocení prvních 100 operací a srovnání prvních a posledních 30 operací
- Chirurgie bránice v léčbě pokročilého karcinomu ovaria
- Radikální fertilitu zachovávající operační výkony u gynekologických malignit – pětiletý soubor
- Výsledky operační léčby stresové inkontinence moči mini-invazivní transobturatorní páskou z jedné inc
- Korelace subjektivního a objektivního hodnocení operace vaginálního prolapsu– sekundární analýza výsledků randomizované kontrolované studie pacientek s defektem pánevního dna a operovaných vaginální síťkou nebo závěsem na sakrospinózní ligamentum
- Psychické změny u žen v důsledku užívání hormonální antikoncepce
- Histologické typy děložních myomů u pacientek v reprodukčním věku a postmenopauze
- Robotická sakrokolpopexe – dvě kazuistiky a literární přehled
- Heterotopická gravidita po spontánní koncepci
- Gravidita v jizvě po císařském řezu – kazuistika
- Neonatální výsledky u novorozenců nízké porodní hmotnosti v brazilském referenčním centru polikliniky
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Psychické změny u žen v důsledku užívání hormonální antikoncepce
- Histologické typy děložních myomů u pacientek v reprodukčním věku a postmenopauze
- Heterotopická gravidita po spontánní koncepci
- Chirurgie bránice v léčbě pokročilého karcinomu ovaria