Systémový lupus erythematosus a sekundární antifosfolipidový syndrom u rodných sester se sníženou plodností
Systemic lupus erythematosus and secondary antiphospholipid syndrome in native sisters with reduced fertility
Objective: Systemic lupus erythematosus (SLE) and secondary anti-phospholipid syndrome (APS II) can cause increased morbidity and mortality of the fetus. We followed the course of fertility of two sisters with these two basic diseases. Methods: In the Center for Immunology of Reproduction, we confi rmed both sisters had increased levels of some selected anti-phospholipid antibodies (against phosphatidylserine, phosphatidylethanolamine, phosphatidylinositol, DL-glycerole, anexin V, phoshatidic acid, cardiolipin, beta2-glycoprotein I), anti-nuclear, and anti-DNA antibodies. During the established immunosuppressive and hormonal therapy at the time of SLE remission, both sisters became pregnant. There was a physiological progression of pregnancy until the 19th week. Results: At the 20th week of pregnancy, the older sister miscarried again, and the younger sister developed hypertension in the 31st week of pregnancy which was terminated by caesarean section. Conclusion: In our causal evaluation, we addressed two serious autoimmune diseases (SLE, APS II) in two sisters and described their course of pregnancy. However, only one of them became a happy mother.
Keywords:
infertility – Systemic lupus erythematosus – secondary antiphospholipid syndrome
Authors:
Z. Ulčová-Gallová 1,2
; Mukenšnabl P. 3; Dzurillová Ž. 4; Lošan P. 1
Authors‘ workplace:
Genetika-Plzeň s. r. o., Next-Clinics Czech a. s., Plzeň
1; Gynekologicko-porodnická klinika LF UK a FN Plzeň
2; Šiklův ústav patologie, LF UK a FN Plzeň
3; Medicentrum Dzurilla, Nitra, Slovensko
4
Published in:
Ceska Gynekol 2022; 87(3): 198-201
Category:
Case Report
doi:
https://doi.org/10.48095/cccg2022198
Overview
Cíl: Systémový lupus erythematosus (SLE) a sekundární antifosfolipidový syndrom (APS II – antiphospholipid syndrome II) může způsobovat zvýšenou morbiditu a mortalitu plodu. Sledovali jsme průběh fertility u dvou sester s těmito základními autoimunitními onemocněními. Metodika: V poradně pro imunologii reprodukce jsme u obou sester potvrdili zvýšené hodnoty některých antifosfolipidových protilátek (proti fosfatidylserinu, fosfatidylethanolaminu, fosfatidylinositolu, DL-glycerolu, anexinu V, kyselině fosfatidové, kardiolipinu, beta2-glykoproteinu I), antinukleárních protilátek a protilátek proti DNA. Při nastavené imunosupresivní a hormonální léčbě v době remise SLE obě sestry úspěšně otěhotněly. Těhotenství probíhala do 19. týdne fyziologicky. Výsledky: Starší sestra opět potratila ve 20. týdnu gravidity, u mladší sestry byla gravidita ukončena v 31. týdnu per sectionem caesaream z důvodu náhle vzniklé hypertenze. Závěr: V naší kazuistice jsme se zabývali závažnými autoimunitními onemocněními (SLE, APS II) u dvou sester, popsali průběhy následující gravidity. Pouze jedna z pacientek se však stala šťastnou matkou.
Klíčová slova:
infertilita – systémový lupus erythematosus – sekundární antifosfolipidový syndrom
Úvod
Systémový lupus erythematosus (SLE) postihující ženy v jejich plodném věku je chronické, agresivní a multifaktoriální autoimunitní onemocnění s remitujícími a relapsujícími obdobími. Jako nejčastější příčiny vzniku SLE bývají uváděny:
• UV záření;
• hormonální antikoncepce;
• infekce s abnormální imunologickou odpovědí;
• genetická predispozice [1,2].
V ČR bývá každý rok diagnostikováno 500 nových případů SLE (prevalence se pohybuje mezi 3,5 a 5,0/ 100 000 obyvatel za rok). Aktivní SLE bývá klinicky charakterizován různými příznaky, jako je únava, bolest hlavy, snížení hmotnosti, výskyt fotosenzitivního exantému motýlovitého charakteru na obličeji, dále se může vyskytnout horečka, artritida, atralgie, myalgie, myozitida, neurologické i psychiatrické problémy, vaskulitida a jiné. Toto chronické polysymptomatologické onemocnění může tedy postihnout různé části těla – kůži, klouby, ledviny, kardiovaskulární systém, dýchací, nervový i hematopoetický. Mezi závažné komplikace SLE patří glomerulonefritida doprovázená častými laboratorními abnormalitami, pro něž je charakteristická zvýšená aktivita B-buněk a porucha aktivity T-buněk s tvorbou autoprotilátek různého charakteru. Imunokomplexy vytvořené z autoprotilátek a vlastních antigenů způsobují zánět, při kterém se aktivují agresivní cytokiny a zánětlivé molekuly. Můžeme se setkat s výskytem protilátek proti DNA (anti - -dsDNA), s hypokomplementémií (nízké C3 a C4) s patologickými hodnotami jednotlivých imunoglobulinů, s přítomností různě pozitivních antifosfolipidových protilátek. Vysoký bývá i CRP, vyšší hodnoty antinukleárních (ANA – antinuclear antibodies) a jiných protilátek. Při detailnějším imunologickém vyšetření nacházíme i různé hladiny spekter extrahovatelných jaderných protilátek, např. Sm, La, Ro a dalších [3–5].
Některé pacientky v reprodukčním věku mívají i pravidelnou ovulaci, jiné zase menstruační nepravidelnosti kombinované opakovaným selháním implantace v procesu oplodnění jak in vivo, tak in vitro. Ženy, které úspěšně otěhotní, mohou být postiženy vysokou mírou časné i pozdní potrácivosti. U novorozenců matek se SLE se může, ale nemusí objevit tzv. neonatální lupus erythematosus.
Pacientky se SLE jsou vystaveny zvýšenému riziku vzplanutí lupusu nejen v reprodukčním období. Vysoká autoprotilátková aktivita u SLE se může objevit prakticky kdykoli. V našem sdělení chceme poukázat na zcela raritní případ dvou sester se SLE přijatých postupně do naší poradny a laboratoří reprodukční imunologie v Plzni. Nikde jsme v literatuře nenašli podobný případ sester se stejnou autoimunitní nemocí a podobnou porodnickou anamnézou.
Kazuistika
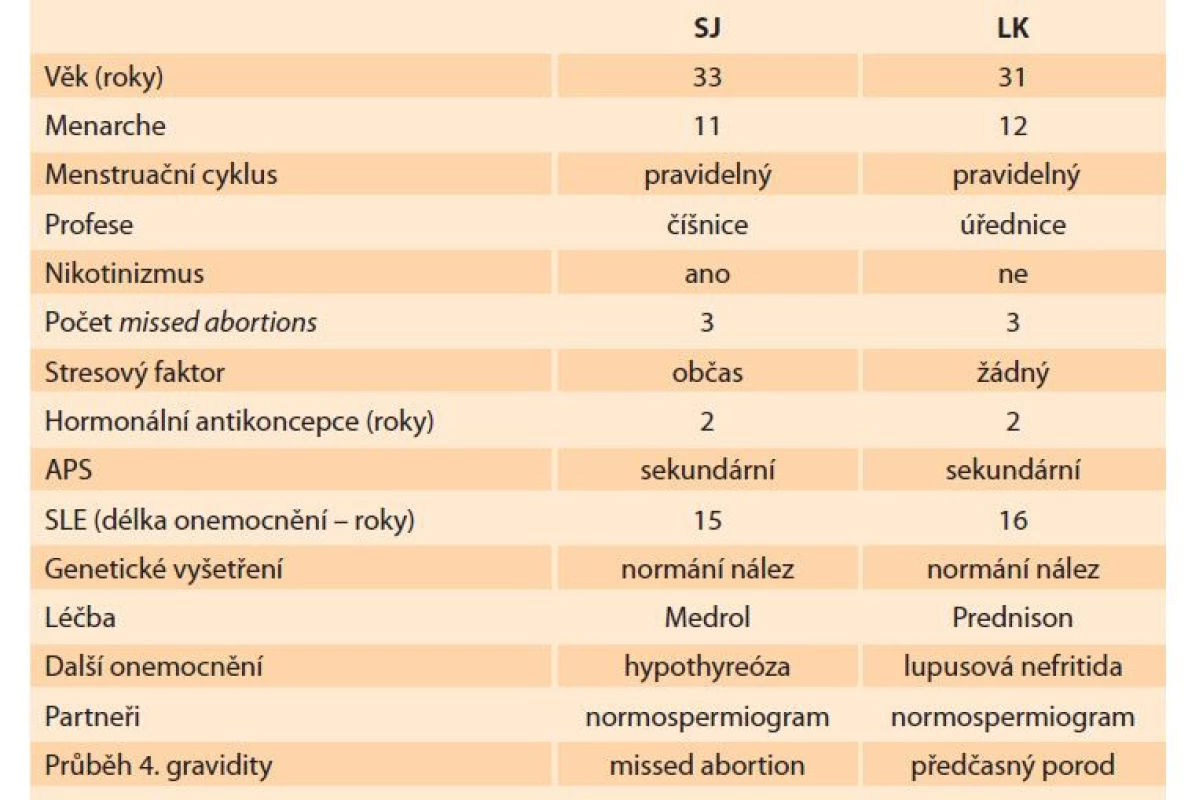
Vyšetřovali jsme dvě sestry, 33letou (SJ) a 31letou (LK) z důvodu opakovaných časných těhotenských ztrát. Rodinná anamnéza je bezvýznamná. Obě sestry prožily dětství s běžnými infekčními chorobami (jejich další anamnestické údaje v tab. 1). Pečlivá gynekologická a ultrasonografická vyšetření potvrdila normální anatomii vnitřního genitálu. Obě ženy měly fyziologické hormonální hladiny, pravidelné ovulace i menstruace. Obě pacientky byly po třech missed abortions. Výsledky cervikálního i vaginálního mikrobio mu byly v pořádku. Neprokázali jsme přítomnost chlamydií, mykoplazmat, kvasinek ani trichomoniázy. V sérech jsme nezjistili protilátky proti zona pellucida ani antiovariální protilátky. Protilátky proti štítné žláze a antispermiové byly také negativní. Zjistili jsme ale různě vysokou pozitivitu protilátek proti jednotlivým fosfolipidům ve screeningu antifosfolipidových protilátek (APA – antiphospholipid antibodies), především proti fosfatidyl-serinu, fosfatidylethanolaminu, fosfatidylinositolu, DL-glycerolu, anexinu V, kyselině fosfatidové, kardiolipinu, beta2-glykoproteinu I. Prokázali jsme tedy sekundární antifosfolipidový syndrom (APS II). Při analýze histologických nálezů zbytků potracených placent byly vždy přítomny mikrotrombotizace, které jsou výsledkem účinků APA v oblasti endotelových buněk a trombocytů. Manželé obou sester měli spermiogramy se zcela normálními spermiologickými i imunologickými parametry.
Tab.1. Basic anamnestical data of both female patients, SJ and LK.
Pacientka SJ
Starší sestra (33 let, gravida III, para 0) byla už v roce 2018 odeslána na vyšetření k nám z důvodu tří missed abortions. V 18 letech, kdy užívala hormonální antikoncepci, ji postihla trombóza levé dolní končetiny, následovala pak lehká trombocytopenie. Během hospitalizace se na obličeji objevil typický motýlovitý exantém kolem očí a nosu, podrobným autoimunitním screeningem byla odhalena i hypotyreóza a vysoká protilátková pozitivita proti kardiolipinu IgG, anexinu V, beta2-glykoproteinu I IgA, IgG, fosfatidylserinu, anti-dsDNA, byl přítomen lupus antikoagulans, snížení komplementu C3, ANA, ANCA. Byla stanovena diagnóza SLE se sekundárním APS II. Pacientka pak byla léčena kortikosteroidy a cyklofosfamidem (dávky byly zvoleny revmatologem podle současných klinických a laboratorních nálezů). Léčba cyklofosfamidem byla zastavena 2 měsíce před plánovaným těhotenstvím.
V remisi jsme pak přidali ještě kyselinu acetylsalicylovou a kortikoidy. Jakmile žena otěhotněla, do půl roku od snažení o koncepci jsme pak doporučili maximální dávky gestagenů a nízkomolekulární heparin (LMWH – low molecular weight heparin). Ve 20. týdnu gravidity se ale zpočátku objevil spotting a při následném ultrasonografi ckém vyšetření plod bez akce srdeční. Jednalo se tedy o čtvrtou těhotenskou ztrátu plodu. Pacientka se nakonec rozhodla pro adopci (tab. 1).
Pacientka LK
Mladší sestře (31 let, gravida III, para 0) byl SLE diagnostikován už v 15 letech. Onemocnění pak bylo komplikováno kolísavou hypertenzí a sekundární glomerulopatií (lupusová nefritida) s masivní proteinurií. I u této pacientky jsme diagnostikovali sekundární APS II s převahou protilátek proti kardiolipinu, fosfatidylinositol IgG, fosfatidylserin IgG a beta-glykoproteinu v IgG, dále i vysoké hodnoty anti - -dsDNA. Pacientka pak byla intenzivně léčena antimalariky, intermitentně antihypertenzivy i kortikosteroidy, kyselinou acetylsalicylovou, gestageny, kyselinou listovou, pyridoxinem. LMWH byl okamžitě nasazen při zjištění pozitivity choriogonadotropinu (hCG – human chorionic gonadotropin), aplikován do 12. týdne těhotenství. Gravidita při SLE probíhala téměř fyziologicky až do 30. týdne. V 31. týdnu však došlo u pacientky k náhlému zvýšení krevního tlaku (180/ 120 mmHg). Následovala okamžitá hospitalizace s antikonvulzní terapií, sériová ultrasonografie, při níž se ještě potvrdil oligohydramnion a lehká intrauterinní růstová retardace plodu (IUGR – intrauterine growth restricton). Těhotenství bylo ukončeno per sectionem caesaream. U dítěte (dcera, 1 100 g / / 40 cm) nebyl zjištěn novorozenecký lupus erythematosus. Placenta vykazovala přítomnost drobných infarktů. Neonatologická péče nezralému novorozenci byla poskytnuta do hmotnosti 2 200 g, pak bylo dítě propuštěno s maminkou domů (tab. 1).
Diskuze
Opakující se ztráta těhotenství je spojena s hormonálními, chromozomálními, imunologickými poruchami, ale také s různými abnormalitami dělohy. Faktory životního prostředí, jako je kouření, mikrobiální a virová infekce, ale především emoční stres, mohou také způsobovat vážný problém při selhávání plodnosti. Autoimunitní onemocnění s projevy zahrnujícími různé orgánové systémy a poškození tkáně mají obecně neznámou etiologii. Před vyšetřením a léčbou v poradně reprodukční imunologie byly sestry vyšetřeny revmatologem, endokrinologem, gynekologem a genetikem. Normální hormonální hladiny i časovaná ultrasonografi cká hodnocení ovarií prokazovaly u obou sester ovulace, obě v remisi s lehkou podporou gestagenů ve II. fázi cyklu otěhotněly. Pacientka LK porodila předčasně (hypertenze, proteinurie, oligohydramnion a IUGR), její sestra SJ znovu potratila a rozhodla se pro adopci dítěte.
V této kazuistice jsme analyzovali ojedinělý případ dvou sester se stejnou autoimunitní nemocí (SLE, APS II) a podobnou porodnickou anamnézou. Autoimunitní onemocnění může způsobovat selhávání imunologické tolerance mezi matkou a plodem [6]. Jedná se o složité, navzájem se ovlivňující a spolu související imunitní mechanizmy, především o snížení T-regulačních lymfocytů (CD4+, CD25+, FoxP3+, Treg), subpopulací CD8+ T-lymfocytů, regulačních B-lymfocytů, NK T-buněk a dalších imunoregulačních molekul, jako je např. TGF-beta, IL-10, změna poměru z Th2/ Th1 na Th1/ Th2 buněk a dalších molekul s inhibičními vlastnostmi intimně se uplatňujícími ve stavech imunologické tolerance matka–plod [6–8]. Obecně tedy ztráta imunologické tolerance u osob s autoimunitním onemocněním spočívá v reakci B-buněk k různým antigenním složkám, vazebným proteinům, nukleové kyselině např. i tím, že antinukleární protilátky vyvolají proliferaci autoreaktivních lymfocytů, což vede k rozšíření jejich specificity. Zánětlivé buňky ovlivněné mnoha prozánětlivými cytokiny a chemokiny migrují do cílových orgánů, aktivují jejich efektorové mechanizmy a způsobují chronický zánět. Naše kazuistika představuje dvě sestry s chronickým, vysoce variabilním, multisystémovým autoimunitním onemocněním. Obecně autoimunitní nemoci, jako je např. SLE se sekundárním APS II, představují v reprodukčním věku ženy vyšší nebezpečí potrácivosti [9–14].
Závěr
Popsali jsme vzácnou kazuistiku dvou sester se závažnými autoimunitními onemocněními (SLE, APS II) a následnými graviditami. Pouze jedna z pacientek se však stala šťastnou matkou.
ORCID autorky
Z. Ulčová-Gallová 0000-0002-0010-7452
Doručeno/ Submitted: 10. 11. 2021
Přijato/ Accepted: 25. 3. 2022
prof. MUDr. Zdenka Ulčová-Gallová, DrSc.
Genetika Plzeň, s.r.o.
Parková 1254/ 11a
326 00 Plzeň-Černice
Sources
1. Kivity S, Ehrenfeld N. Can we explain the higher prevalence of autoimmune disease in women? Expert Rev Clin Immunol 2010; 6(5): 691–694. doi: 10.1586/ eci.10.60.
2. Battaglia M, Garret-Sinha LA. Bacterial infection in lupus: roles in promoting activation and in pathogenesis of the disease. J Transl Autoimmun 2021; 4 : 100078. doi: 10.1016/ j.jtauto.2020.100078.
3. Krejsek J, Kopecký O. Klinická imunologie. Hradec Králové: Nukleus 2004.
4. Mockova A, Ulcova-Gallova Z, Nahlovsky J et al. Occurrence of selected antiphospholipid antibodies in offspring born from mothers with autoimmunity. Lupus 2012; 21(7): 793–795. doi: 10.1177/ 0961203312437808.
5. Kwak-Kim J, Park JC, Ahn HK et al. Immunological modes of pregnancy loss. Am J Reprod Immunol 2010; 63(6): 611–623. doi: 10.1111/ j.1600-0897.2010.00847.x.
6. Holáň V. Imunologická tolerance. In: Ulčová - Gallová Z, Madar J eds. Imunologie a imunopatologie lidské reprodukce. 2. vyd. Praha: Maxdorf 2020.
7. Larosa M, Del Ros T, Calligaro A et al. Clinical outcomes and predictors of maternal and fetal complications in pregnancies of patients with systemic lupus erythematosus. Expert Rev Clin Immunol 2019; 15(6): 617–627. doi: 10.1080/ 1744666X.2019.1601557.
8. Hickman RA, Gordon C. Causes and management of infertility in systemic lupus erythematosus. Rheumatology (Oxford) 2011; 50(9): 1551–1558. doi: 10.1093/ rheumatology/ ker105.
9. Carp HJ, Selmi C, Shoenfeld Y. The autoimmune bases of infertility and pregnancy loss. J Autoimmun 2012; 38(2–3): J266–J274. doi: 10.1016/ j.jaut.2011.11.016.
10. Rekvig PO. Autoimmunity and SLE: factual and semantic evidence based critical analysis of definition, etiology, and pathogenesis. Front Immunol 2020;
11 : 569234. doi: 10.3389/ fimmu.2020.569234. 11. Ulčová-Gallová Z, Bouda J. Gravidita u žen s ně kte rými autoimunitními chorobami. Ceska Gynekol 1993; 58(4): 28–30.
12. Ulčová-Gallová Z. Poznámky k léčbě žen s autoimunitním onemocněním. Gynekolog 1994; 3 : 208–209.
13. Ulčová-Gallová Z, Rokyta Z. Systémový lupus erythematodes a pohlavní hormony. Ceska Gynekol 1998; 63(3):251–253.
14. Nováčková M, Binder T, Jančíková B et al. Průběh těhotenství a porodu u pacientky se systémovým lupus erythematodes. Ceska Gynekol 2004; 69(3): 193–196.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2022 Issue 3
-
All articles in this issue
- Vztah změn mobility uretrovezikální junkce a pooperační progrese stresové inkontinence po sakrospinální fixaci – subanalýza multicentrické randomizované studie
- Screening vrozených vad a geneticky podmíněných onemocnění plodu ve Fakultní nemocnici Olomouc a odesílání/ hlášení do Národního registru reprodukčního zdraví v České republice
- Průběh porodu před císařským řezem a incidence avulze musculus levator ani při prvním následném vaginálním porodu – pilotní studie
- Syndrom úplné androgenní insenzitivity – raritní kazuistika malignizace dysgenetických gonád
- Hydronefróza jako příznak asymptomatické ureterální endometriózy
- Gravidita v jizvě po císařském řezu
- Systémový lupus erythematosus a sekundární antifosfolipidový syndrom u rodných sester se sníženou plodností
- Fertilitu zachovávající postupy u mladých žen s karcinomem endometria
- Balonková vaginoplastika jako miniinvazivní metoda při řešení vaginální aplazie
- Nádory ovaria a genetická dispozice
- Steroidní metabolom a vícečetné těhotenství
- Recenze knihy Pôrodníctvo
- Prof. MUDr. Alois Martan, DrSc. – 70letý
- Akutní peripartální hysterektomie – naše 6letá zkušenost
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Gravidita v jizvě po císařském řezu
- Hydronefróza jako příznak asymptomatické ureterální endometriózy
- Nádory ovaria a genetická dispozice
- Syndrom úplné androgenní insenzitivity – raritní kazuistika malignizace dysgenetických gonád
