Představuje asymptomatické nosičství mutace FV Leiden a FII protrombin v heterozygotní konfiguraci zvýšené riziko trombembolických komplikací v průběhu těhotenství, porodu a šestinedělí?
Does the asymptomatic carriage of FV Leiden and FII prothrombin in heterozygous configuration represent the inccreased risk of thrombembolic complications during pregnancy, childbirth and postpartum?
Objective:
To evaluate the course of pregnancy and puerperium in asymptomatic carriers of FV Leiden and FII prothrombin mutation in heterozygous configuration in terms of risk of thrombembolic disease and late pregnancy complications. To evaluate whether global prophylactic LMWH administration already during pregnancy has brought some benefit to these women.
Type of study:
Prospective study.
Methods:
From June 2007 to June 2011, we monitored the incidence of thrombembolic events (TED) and severe late pregnancy complications in 473 asymptomatic carriers of FV Leiden and FII prothrombin mutation in heterozygous configuration. We also compared the ongoing changes of commonly clinically available hemocoagulation tests. In selected women, we added to coagulation tests a thrombin generation test (TGA) and thrombin-antithrombin test (TAT). In 253 women (Group A), preventive LMWH application was introduced already during pregnancy. In 220 women (Group B), the application of LMWH was commenced as late as on the delivery day. In both groups application of LMWH continued during the puerperium. ¨
Results:
The incidence of TED in the whole group of carriers of thrombophylic mutations accounted for 0.19%. The incidence of severe late pregnancy complications was very low – 3%. Medians of the monitored parameters of the hemocoagulation in compared groups and ‘healthy’ controls did not show statistically significant differences at any stage of pregnancy, labor or end of puerperium, with the exception of the results of TAT test at the end of puerperium.
Conclusions:
No direct causal relationship has been established between asymptomatic carriage of Leiden and prothrombin mutation in heterozygous configuration and the occurrence of severe late pregnancy complications. These types of mutation represent only a slightly increased risk in terms of development of thrombophylic events. General LMWH prophylaxis during pregnancy is not indicated. However, individual careful monitoring of hemocoagulation changes and early detection of associated transient situations potentiating risk of thrombembolic events is desirable. Statistically significant differences in the TAT results between group A and B at the end of puerperium revealed that the recommended extended LMWH prophylaxis until the end of puerperium was not followed by a number of women who started the prophylaxis on the date of labor.
Key words:
pregnancy, asymptomatic carriage of Leiden and prothrombin mutation in heterozygous configuration, late pregnancy complications, coagulation changes.
Autoři:
T. Binder 1; B. Vavřinková 1; I. Hadačová 2; I. Hrachovinová 3; P. Salaj 3; Martin Hruda 1
Působiště autorů:
Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. L. Rob, CSc.
1; Hematologické odd. FN Motol, Praha, primářka MUDr. I. Hochová
2; ÚHKT Praha, přednosta prof. MUDr. M. Trněný, CSc.
3
Vyšlo v časopise:
Ceska Gynekol 2012; 77(1): 25-30
Kategorie:
Původní práce
Souhrn
Cíl studie:
Vyhodnotit průběh těhotenství a šestinedělí asymptomatických nosiček mutace FV Leiden a protrombinové mutace v heterozygotní konfiguraci z hlediska rizika vzniku trombembolické nemoci a pozdních těhotenských komplikací. Vyhodnotit, zda plošné profylaktické podávání LMWH již v průběhu těhotenství přináší těmto ženám nějaký prospěch.
Druh studie:
Prospektivní studie.
Soubor a metodika:
Od června 2007 do června 2011 jsme sledovali výskyt trombembolické nemoci (TEN) a závažných pozdních těhotenských komplikací u 473 asymptomatických nosiček leidenské nebo protrombinové mutace v heterozygotní konfiguraci. Zároveň jsme v průběhu těhotenství a šestinedělí porovnávali probíhající změny běžně klinicky dostupných hemokoagulačních vyšetření. U vybraných žen jsme peripartálně rozšířili hemokoagulační vyšetření o trombin generační test (TGA) a trombin-antitrombinový test (TAT). U 253 žen (skupina A) byla zavedena preventivní aplikace LMWH již v průběhu těhotenství. U 220 žen (skupina B) byla aplikace LMWH zahájena až dnem porodu. U obou skupin se pokračovalo v aplikaci LMWH v průběhu celého šestinedělí.
Výsledky:
Incidence TEN v celém souboru nosiček mutací představovala 0,19 %. Incidence pozdních těhotenských komplikací byla velmi nízká – 2,5 %. Mediány sledovaných hemokoagulačních parametrů porovnávaných skupin a „ zdravých“ kontrol nevykazovaly v žádné fázi těhotenství, peripartálně ani na konci šestinedělí, statisticky významné rozdíly. Výjimku tvořily výsledky trombin-antitrombinového testu na konci šestinedělí.
Závěr:
Asymptomatické nosičství leidenské mutace a protrombinové mutace není v přímé příčinné souvislosti s výskytem závažných pozdních těhotenských komplikací. Z hlediska rizika vzniku TEN představuje jen mírně zvýšené riziko. Plošná profylaxe LMWH v průběhu těhotenství není indikovaná. Individuální pečlivé monitorování hemokoagulačních změn a přidružených tranzitorních trombofilních situací potencujících riziko vzniku trombembolie je však žádoucí. Statistické rozdíly výsledků TAT testu na konci šestinedělí u skupiny B v porovnání se skupinou A odhalily, že doporučená prodloužená profylaxe LMWH do konce šestinedělí není mnohými ženami, u kterých byla profylaxe zahájena až dnem porodu, dodržována.
Klíčová slova:
těhotenství, asymptomatické nosičství leidenské a protrombinové mutace v heterozygotní konfiguraci, pozdní těhotenské komplikace, hemokoagulační změny.
ÚVOD
Těhotenství nosiček trombofilních mutací (TM) je obecně pokládáno za vysoce rizikové nejen z hlediska vzniku trombembolické nemoci, ale i z hlediska vzniku závažných pozdních těhotenských komplikací. Incidence mutace FV Leiden se v evropské populaci odhaduje mezi 5–7 % a protrombinové mutace mezi 2–3 % jedinců. Plošný screening TM se nikde ve světě z důvodu finanční náročnosti neprovádí. V porodnictví je aktuálně prováděn selektivní screening u žen s rodinou zátěží, s anamnézou trombembolické příhody a poměrně nově i u žen s habituálním potrácením, infertilitou jako takovou nebo u žen s anamnézou závažné pozdní těhotenské komplikace [2, 4, 5]. Z uvedeného vyplývá, že každý rok absolvuje bezproblémově těhotenství tisíce nosiček trombofilních mutací, o kterých nevíme. Nejpočetnější skupinu nosiček TM tvoří jednoznačně asymptomatičtí heterozygoti leidenské a protrombinové mutace. V praxi se běžně setkáváme s faktem, že u více než poloviny z nich je hematology zahájeno profylaktické podávání LMWH již v průběhu těhotenství, obvykle mezi 20. až 30. gestačním týdnem. Převažujícím důvodem k tomuto kroku jsou hemokoagulační změny, které se však v průběhu těhotenství objevují fyziologicky. Patří k nim zvýšené plazmatické hladiny fibrinogenu, FVII, FVIII, von Wilebrandova faktoru, pozitivita D-dimerů a pokles volného proteinu S.
Cílem naší studie bylo zjistit, zda nosičství těchto nejčastějších forem TM představuje zvýšené riziko vzniku závažných pozdních těhotenských komplikací, zda toto nosičství ovlivní plazmatické hladiny klinicky rutinně sledovaných hemokoagulačních parametrů a zda profylaktické podávání LMWH průběh těhotenství a jeho výsledek pozitivně ovlivní.
METODIKA A SOUBOR ŽEN
Perinatologické centrum Gynekologicko-porodnické kliniky FN Motol je specializované pracoviště, které mimo jiné soustřeďuje těhotné s hematologickými poruchami a nemocemi. Od června 2007 do června 2011 jsme prospektivně sledovali 473 těhotných žen, asymptomatických nosiček mutace FV Leiden (401) a protrombinové mutace (72) v heterozygotní konfiguraci zařazených do studie. Studie byla schválena etickou komisí nemocnice a všechny zařazené ženy potvrdily souhlas se svým zařazením do studie podpisem informovaného souhlasu. 253 žen (skupina A) jsme převzali do prenatální péče s již zahájenou profylaktickou aplikací LMWH hematologickými pracovišti v Praze a Středočeském kraji. Důvody pro zahájení profylaxe LMWH u těchto žen uvádíme v grafu l. Nejčastějším důvodem bylo těhotenství jako takové a fyziologické těhotenské hemokoagulační změny, které je provázejí (52 %). U 220 žen (skupina B) sledovaných od počátku těhotenství v naší režii, byla zahájena profylaxe LMWH až dnem porodu.

Do studie nebyly zařazeny těhotné s vícečetným těhotenstvím, ženy s 2 i více časnými těhotenskými ztrátami, ženy s pozdními těhotenskými komplikacemi v předchozí graviditě a ženy chronicky nemocné. U všech žen zařazených do studie bylo profylaktické podávání LMWH doporučeno prolongovat po celou dobu šestinedělí.
V obou skupinách jsme sledovali výskyt trombembolických příhod a závažných pozdních těhotenských komplikací, jako jsou IUGR pod 5. percentilem národních hmotnostních tabulek, abrupce placenty, HELLP syndrom, závažná forma preeklampsie a intrauterinní odumření plodu. Porovnávali jsme porodní hmotnosti a obvod hlavy novorozenců.
Plazmatické hladiny fibrinogenu, antitrombinu III, proteinu C, volného proteinu S, D-dimerů a FVIII jsme u žen zařazených do studie stanovovali na konci I., II. trimestru, před porodem, 3. den po porodu a na konci šestinedělí. Kontrolní skupinu pro sledování hemokogulačních změn (skupina C) tvořilo 50 „zdravých“ žen. Trombin generační test (TGA) a trombin-antitrombinový test (TAT) jsme z důvodu přiděleného finančního limitu mohli provést jen u náhodně vybraného vzorku žen před porodem, 3. den po porodu a na konci šestinedělí.
Za sledované období se ve FN Motol narodilo 13 853 dětí, odečteme-li vícečetná těhotenství a těhotenství žen se symptomatickým nosičstvím některé z trombofilních mutací či prokázaným nosičstvím více mutací či nosičství mutace v homozygotní konfiguraci, pak z hlediska výskytu závažných pozdních těhotenských komplikací srovnáváme 12 431 jednočetných těhotenství žen, u kterých nebylo nosičství trombofilní mutace vyšetřeno nebo nebylo prokázáno.
VÝSLEDKY
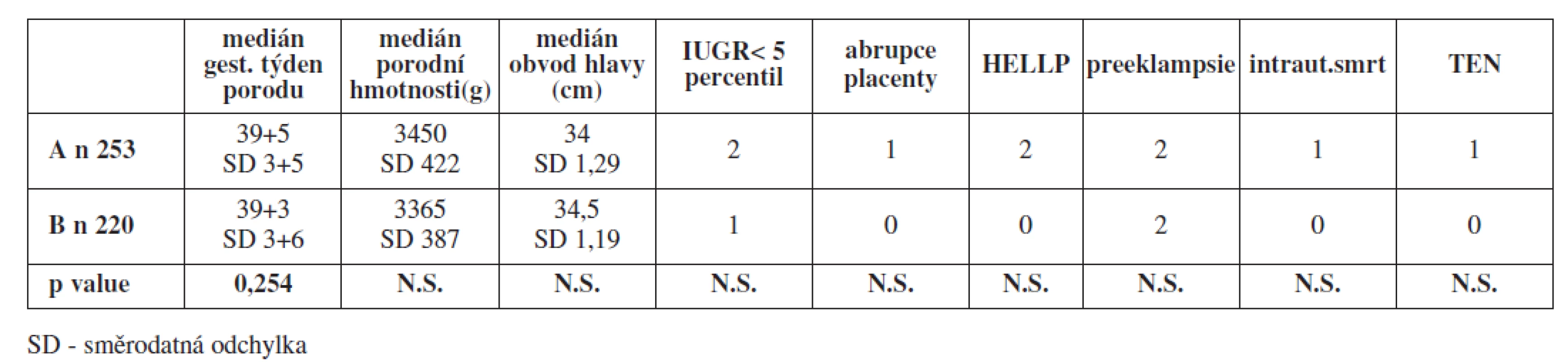
Ve skupině 253 žen (skupina A) s profylaktickým podáváním LMWH v průběhu těhotenství byl medián gestačního stáří v době porodu 39+5, medián porodní hmotnosti novorozenců činil 3450 g, medián obvodu hlavičky novorozence činil 34 cm. Zaznamenali jsme 2 případy závažné IUGR (0,79 %), 1 případ abrupce placenty (0,39 %), 2 případy HELLP syndromu (0,79 %), 2 případy závažnější formy preeklampsie (0,79 %) a jeden případ intrauterinního odumření plodu (0,39 %). U jedné ženy jsme diagnostikovali 3. den po porodu hlubokou žilní trombózu levého lýtka (0,39 %). Celkově pozdní těhotenské komplikace a TEN matky ohrozily 3,56 % těhotenství.
Ve skupině 220 žen (skupina B) bez profylaktického podávání LMWH v průběhu těhotenství byl medián gestačního stáří v době porodu 39+3, medián porodní hmotnosti novorozenců činil 3365 g, medián obvodu hlavičky novorozenců 34,5 cm. Zaznamenali jsme jeden případ závažné IUGR (0,45 %) a žádné případy abrupce placenty, HELLP syndromu či intrauterinní smrti plodu. Zaznamenali jsme pouze 2 případy závažnější formy preeklampsie (0,9 %). V této skupině byla incidence závažných pozdních těhotenských komplikací 1,4 %.
Souhrnně jsme za sledované období u všech asymptomatických nosiček některé ze sledovaných trombofilních mutací v heterozygotní konfiguraci zaznamenali incidenci pozdních těhotenských komplikací ve 2,5 % případů.
V selektovaném souboru 12 431 jednočetných těhotenství bez prokázaného nosičství trombofilní mutace bylo diagnostikováno 57 případů závažné IUGR (0,46 %), 83 případů abrupce placenty (0,67 %), 78 případů HELLP syndromu (0,63 %) a 525 případů závažné formy preeklampsie (4,22 %). Intrauterinní smrt plodu jsme zaznamenali v 39 případech (0,31 %). Medián gestačního stáří v době porodu činil 39+3, medián porodní hmotnosti novorozenců byl 3412 g a medián obvodu hlavy 34,45 cm. V průběhu těhotenství a šestinedělí jsme zaznamenali 16 případů hluboké žilní trombózy a 2 případy plicní embolie (0,16 %). Celkově byla v tomto souboru incidence závažných pozdních těhotenských komplikací a případů TEN 6,4 %.
V tabulce 1 je uvedeno srovnání sledovaných ukazatelů mezi nosičkami trombofilních mutací s profylaktickým podáváním LMWH zahájeným již v průběhu těhotenství a nosičkami TM s profylaxí LMWH zahájenou dnem porodu. Pro žádný ze sledovaných ukazatelů jsme nenalezli rozdíly, které by byly statisticky významné.
V tabulce 2 je uvedeno srovnání sledovaných ukazatelů všech asymtomatických nosiček mutace FV Leiden a FII protrombin v heterozygotní konfiguraci se selektovaným souborem jednočetných těhotenství s vyloučeným nebo nezjištěným nosičstvím TM.
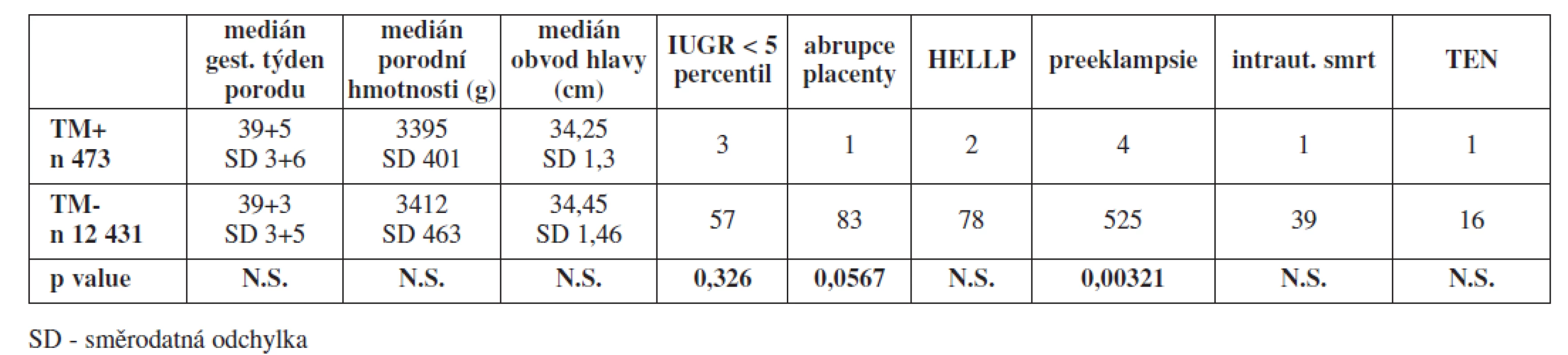
Statisticky signifikantní rozdíl v neprospěch skupiny s vyloučeným nebo nezjištěným nosičstvím trombofilní mutace jsme zaznamenali u preeklampsie, u ostatních sledovaných ukazatelů jsme statisticky významné rozdíly nezjistili.
Hemokoagulační změny (plazmatické hladiny fibrinogenu, antitrombinu III, proteinu C, volného proteinu S, D-dimerů a FVIII) v průběhu těhotenství, peripartálně a v průběhu šestinedělí, pokud porovnáváme mediány sledovaných hodnot, probíhaly ve všech sledovaných skupinách prakticky identicky a nenalezli jsme žádné statisticky významné rozdíly.
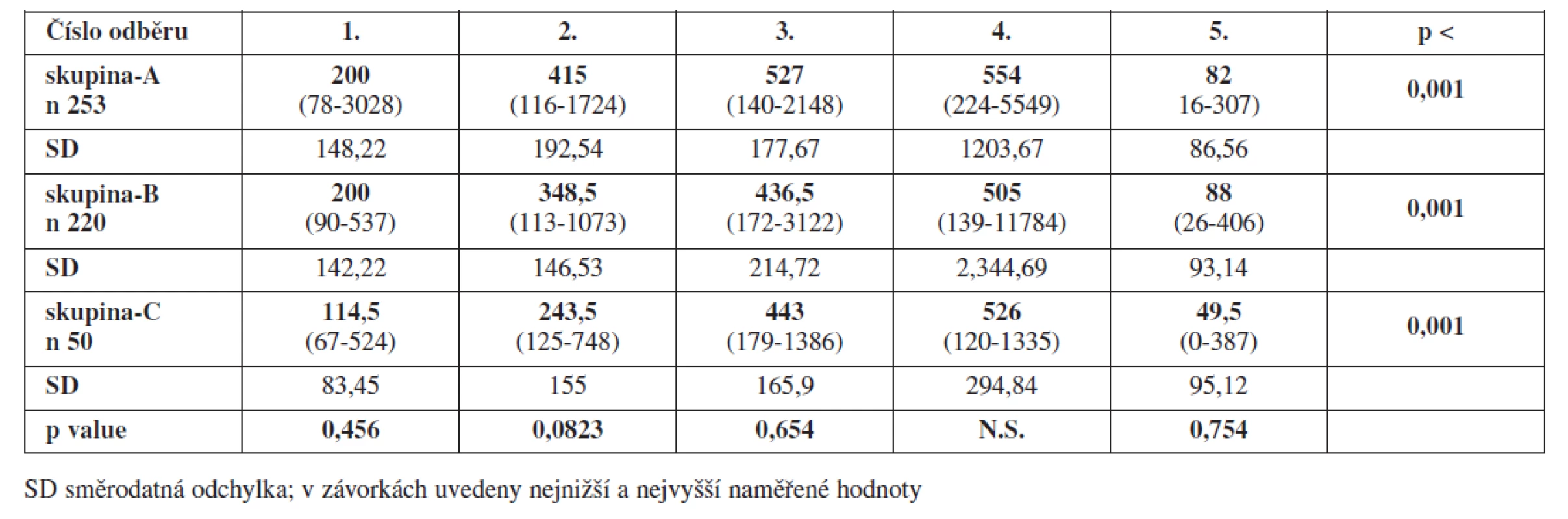
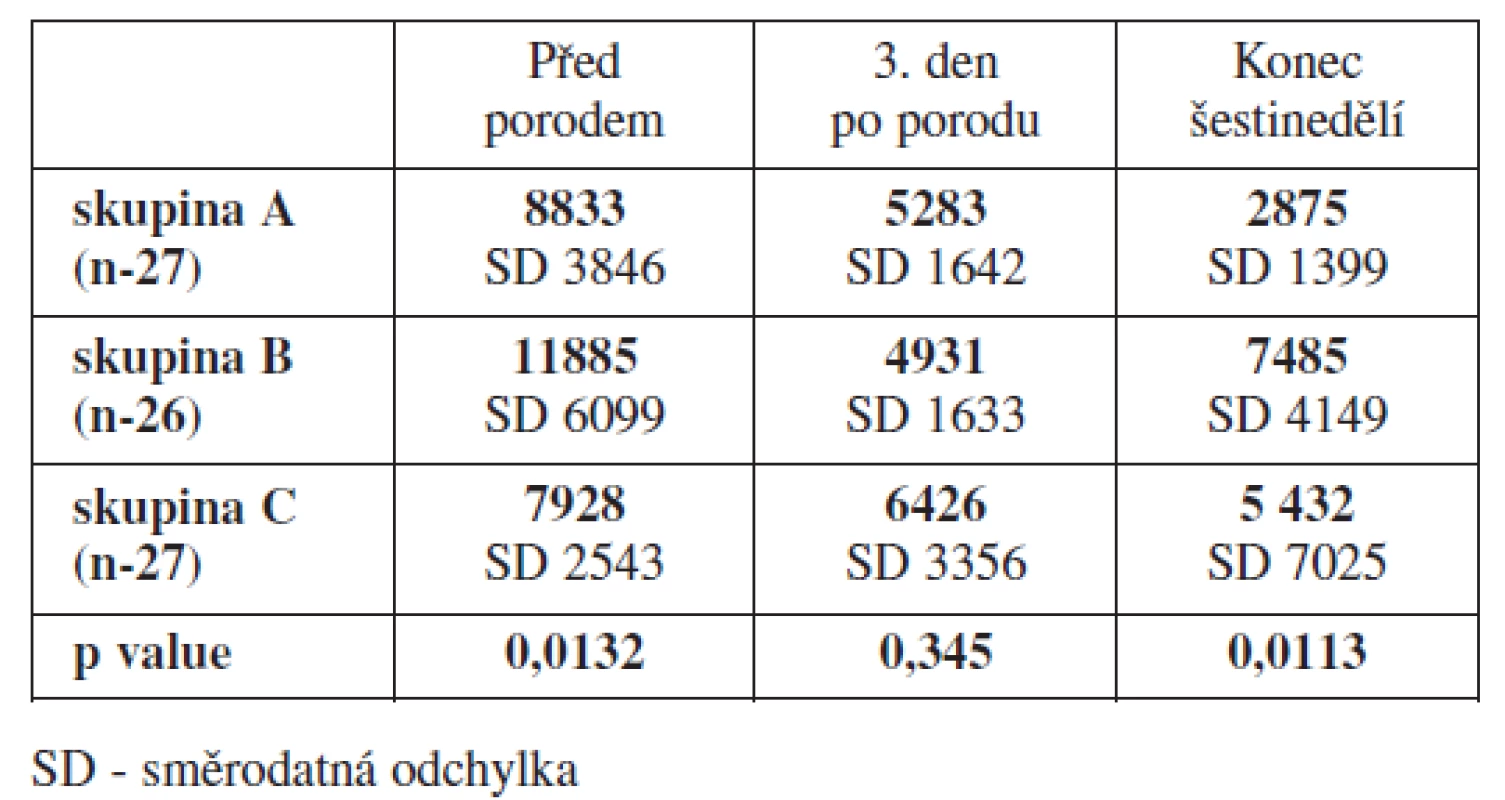
U D-dimerů dochází ve všech 3 sledovaných skupinách v průběhu těhotenství k jejich postupnému zvyšování, které vrcholí před porodem, toto zvýšení prokazatelně přetrvává ještě první dny po porodu. Na konci šestinedělí dochází k jejich prudkému poklesu. Změny jsou v každé ze sledovaných skupin statisticky významné (p < 0,001). Pokud porovnáváme mediány hodnot v jednotlivých skupinách navzájem, nenacházíme statisticky významné rozdíly. Bereme-li hodnotu D-dimerů nad 500 μg/l jako hodnotu, která představuje zvýšené riziko vzniku TEN, pak u nosiček trombofilních mutací bez ohledu na to, zda dostávaly, nebo nedostávaly profylaktické dávky LMWH, jsme zaznamenali tyto hodnoty těsně před porodem statisticky signifikantně více zastoupeny, a to 57 resp. 52 % proti 33 % u kontrol (p = 0,0244). Stejně tak to platí pro zastoupení hodnot D dimerů více než 1000 μg/l, které u nosiček TM prokazujeme ve 26 resp.30 % proti 9 %u kontrol (p = 0,0213). Již v průběhu těhotenství jsme v každé ze sledovaných skupin zaznamenali ojedinělé případy, kdy sérové hladiny D-dimerů přesáhly rizikovou hodnotu více než 500 μg/l, rozdíly mezi jednotlivými skupinami však nebyly statisticky významné.V přehledu jsou mediány hodnot D-dimerů uvedeny v tab. 3 a grafu 2. V grafu 3 jsou zobrazeny percentuální rozdíly zastoupení rizikových hodnot D-dimerů před porodem.


Stanovení trombinogramů bylo provedeno fluorescenční metodou. Peaky hodnot generace trombinu byly vysoké ve všech sledovaných skupinách. TGA neprokázal žádné statisticky významné rozdíly při porovnání sledovaných skupin mezi sebou (tab. 4).
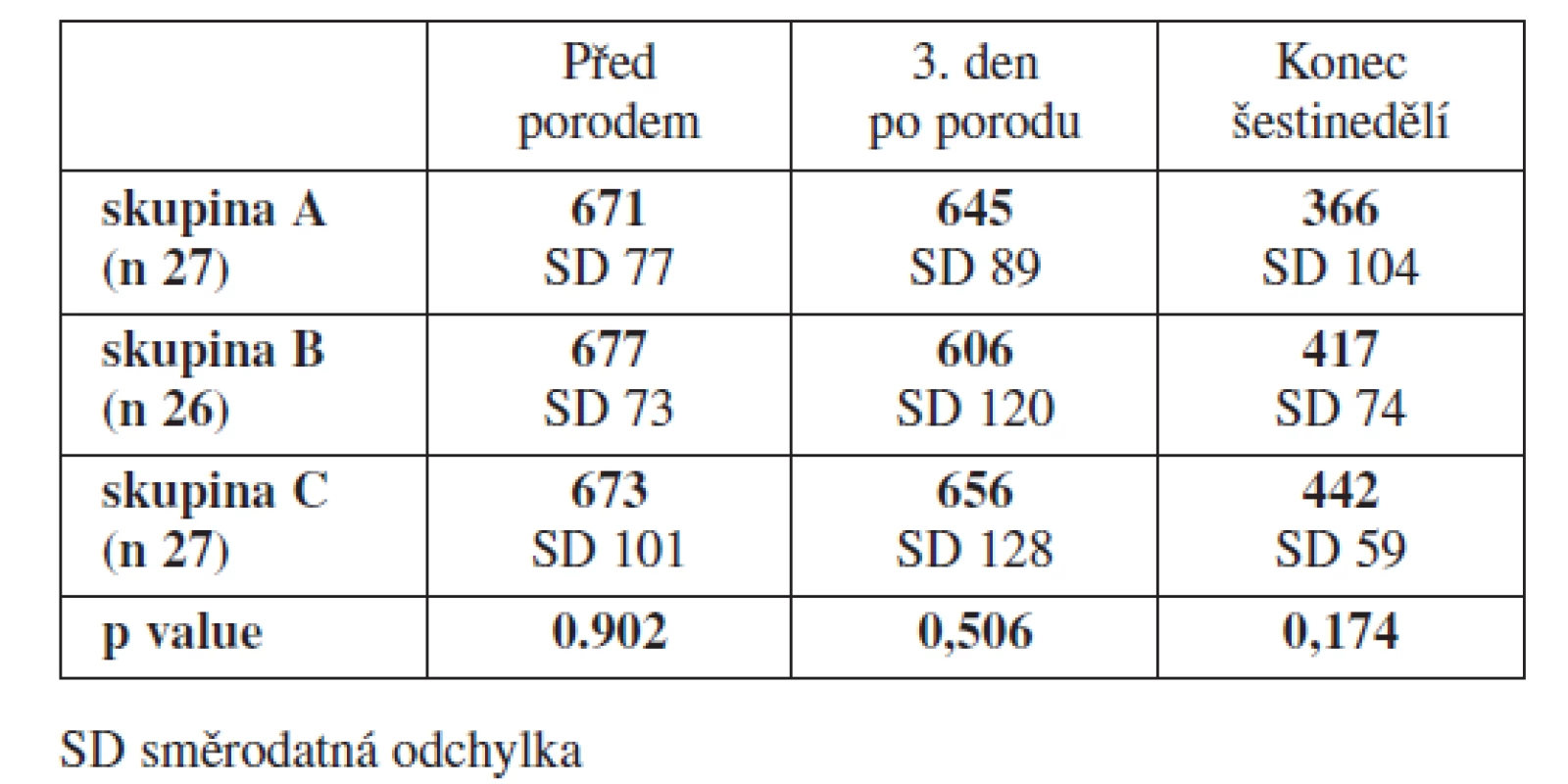
Výsledky trombin-antitrombinového testu (TAT) odhalily jednu skutečnost. Naměřené hodnoty zdravých kontrol a žen, u kterých byla zahájena profylaxe LMWH dnem porodu, byly na konci šestinedělí prakticky identické a vykazovaly statisticky významné rozdíly proti ženám, u kterých byla profylaxe LMWH zahájena již v průběhu těhotenství (tab. 5).
DISKUSE
V obou sledovaných skupinách nosiček TM v heterozygotní konfiguraci jsme prokázali velmi nízkou incidenci závažných pozdních těhotenských komplikací. Mezi jednotlivými srovnávanými skupinami TM jsme nenalezli statisticky významné rozdíly. Z výsledků studie vyvozujeme, že neexistuje přímá souvislost mezi vznikem závažných pozdních těhotenských komplikací a asymptomatickým nosičstvím leidenské mutace a protrombinové mutace v heterozygotní konfiguraci. Tyto závěry jsou ve shodě se závěry metaanalýzy publikovaných prací Rogera [4, 11]. Nepodařilo se prokázat ani často zmiňovaný názor, že nosičkám TM se rodí děti s nižší porodní hmotností.
Asymptomatické nosičství leidenské mutace a protrombinové mutace v heterozygotní konfiguraci pokládáme za méně závažný rizikový faktor trombembolických komplikací v průběhu těhotenství [2, 3, 5]. Plošné profylaktické podávání LMWH těmto ženám již v průběhu těhotenství jen z důvodu samotného nosičství pokládáme za zbytečné [2, 7, 8, 9, 10].
Neprokázali jsme žádný benefit této profylaxe. Pravidelné kontroly hemokoagulačních parametrů v průběhu těhotenství a pečlivé sledování výskytu případných dalších tranzitorních rizikových faktorů vzniku trombembolických komplikací (imobilizace, dehydratace, obezita, varixy, kouření, drogová závislost, věk nad 35 let apod. ale pokládáme u těchto žen za nezbytné [6].
Zvýšené hladiny D-dimerů v plazmě sledovaných pacientů jistě nejsou v korelaci vzniku TEN, odráží však do určité míry zvýšené riziko. V současnosti jinou klinicky rutinně dostupnou validnější metodu nemáme [1].
I když se mediány hladin D-dimerů peripartálně u nosiček TM od zdravých kontrol statisticky neliší, vyšší percentuální zastoupení jedinců s hladinami nad 500 resp. 1000 μg/l u nosiček TM považujeme za pádný argument k zahájení profylaxe TEN LMWH dnem porodu.
TGA na rozdíl klasických koagulačních testů TP a ATPP, které dokážou postihnout pouze iniciální fáze koagulace, dokáže postihnout i propagační fázi (kdy je generován objem trombinu zpětnou vazbou na FV, VIII a XI) a terminální fázi (kdy je formování trombinu přerušeno antikoagulačními procesy a aktivita trombinu je potlačena inhibitory plazmatických proteáz). Peak trombin generačních křivek TGA byl ve všech sledovaných skupinách identicky výrazně zvýšen patrně samotným těhotenstvím. Rozdíly, které jsme přepokládali u nosiček trombofilní mutace, patrně těhotenské hemokoagulační změny vymazaly. Výsledky jsou jistě ovlivněny velmi malým počtem vyšetření a pro definitivní závěry je potřeba dalších velkých randomizovaných studií. Z našich pilotních výsledků se zdá, že v případě těhotenství bude TGA jako screeningová metoda zvýšeného rizika vzniku TEN obtížně aplikovatelná [12].
Překvapením pro nás byly výsledky trombin-antitrombinového testu. Logicky jsme předpokládali identické výsledky testu u obou skupin TM. U žen skupiny B s profylaxí LMWH zahájenou dnem porodu, byly výsledky TAT testu na konci šestinedělí identické s výsledky kontrol. Důvodem tohoto překvapivého výsledku byla skutečnost, že téměř polovina žen ze skupiny B ukončila aplikaci LMWH předčasně kolem 14. dne po porodu.
Běžnou praxí v nemocnicích je, že ženy odcházejí domů s předpisem na 1 balení (10 inj.) LMWH a doporučením, aby se hlásily na kontrolu u svého regionálního hematologa. Ženy, u kterých byla profylaxe TEN LMWH zahájena již v průběhu těhotenství, jednak vědí, kam se mají obrátit, protože tam již absolvovaly několik hematologických kontrol v průběhu těhotenství, a jednak jsou injekcemi LMWH většinou vybaveny na celou dobu šestinedělí. V průběhu těhotenství se s aplikací LMWH smířily. Naopak ženy, u kterých byla profylaxe LMWH zahájena až v porodnici, doberou předepsané injekce a pak se ke kontrole na hematologii velmi často nepřihlásí, a tím profylaxi ukončí. Důvody, které ženy uváděly, byly různé. Nejčastěji uváděly mateřské povinnosti, které nadřazovaly ostatním činnostem, včetně starosti o své zdraví. Dalším častým důvodem bylo, že nebyly dostatečně informované při propuštění z porodnice. Doporučení v propouštěcí zprávě nečetly, zprávu považovaly za dokument určený svému gynekologovi. Mezi důvody se objevovala i špatná dostupnost hematologa v místě bydliště a v neposlední řadě asymptomatičnost samotného nosičství TM a bagatelizace možných rizik ženou samotnou. Ve třech případech jsme se setkali s doporučením obvodního lékaře aplikaci LMWH po 14 dnech ukončit jako nadále zbytečnou.
Všeobecně přijímaným doporučením je prolongovat profylaxi TEN pomocí LMWH na celou dobu šestinedělí u všech nosiček TM. Statisticky je incidence trombembolických příhod v šestinedělí nejvyšší.
Z výsledku studie vyplývá, že na konci šestinedělí sledované hemokoagulační ukazatele nevykazují statisticky významné rozdíly mezi porovnávanými skupinami navzájem, bez ohledu na to, zda u nosiček trombofilních mutací v tomto případě asymptomatických heterozygotů byl aplikován LMWH, či nikoliv. Dochází-li k normalizaci hemokoagulačních parametrů dříve, pak by se teoreticky dalo uvažovat o zkrácení délky aplikace LMWH po porodu. Tato otázka však vyžaduje další randomizované studie.
ZÁVĚRY
Těhotenství žen, asymptomatických nosiček trombofilní mutace FV Leiden a FII protrombin v heterozygotní konfiguraci neprobíhá odlišně od těhotenství „zdravých žen“. Tato těhotenství nejsou obecně spojena s vyšším rizikem vzniku závažných pozdních těhotenských komplikací, jako jsou IUGR, abrupce placenty, HELLP syndromu, preeklampsie či intrauterinní smrti plodu. Nepotvrdili jsme ani markantně vyšší riziko vzniku trombembolických příhod v průběhu samotného, jinak nekomplikovaného těhotenství. Nepotvrdili jsme ani domněnku, že tyto nosičky TM rodí děti s nižší porodní hmotností.
Nenalezli jsme žádný důkaz, že by tyto ženy profitovaly z preventivního podávání LMWH zahájeného již v průběhu těhotenství. Pokládáme jej za zbytečné.
Peripartálně zahájenou profylaxi TEN aplikací LMWH prolongovanou na celou dobu šestinedělí pokládáme za indikovanou. Při propuštění nedělky z porodnice je třeba zlepšit její informovanost a zdůraznit nutnost dalšího hematologického sledování v průběhu šestinedělí.
Statistická analýza
Jednotlivé skupiny souboru byly porovnávány pomocí Kruskalova-Wallisova ANOVA testu. Vztahy f dichotomických proměnných byly vyhodnoceny pomocí longlineárních modelů. Výpočty byly provedeny pomocí NCSS 2002 statistického softwaru (Number Cruncher Statistical Systems, Kaysville, UT, USA).
Studie byla realizována za finanční podpory grantu IGA-MZ CR NS9905-4.
Doc. MUDr. Tomáš Binder, CSc.
Gynekologicko-porodnická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
Zdroje
1. Bates, SM., Greer, IA., Hirsh, J., Gingsberg, JS. Use of antithrombotic agents during pregnancy. Chest, 2004, 126 (3 Suppl.), p. 627S-644S.
2. Martinelli, I., Battaglioli, T., De Stefano, V., et al. The risk of first venousus thrombembolism during pregnancy and puerperium in double heterozygotes for factor V Leiden and prothrombin G20210A. J Thromb Haemost, 2008, 6(3), p. 494-498.
3. Samama, MM., Rached, RA., Conard, J., et al. Pregnancy – associated venous thrombosis in women with hereditary heterozygous factor Leiden and /or factor II gene mutations. Bull Acad Natl Med, 2004, 188(8), p. 1377-1393.
4. Rodger, MA., Carrier, M., Keely, E., et al. The management of thrombophilia during pregnancy: a Canadian survey. J Obstet Gynaecol Can, 2002, 24(12), p. 946-952.
5. Middeldorp, S., Meinardi, JR., Koopman, MM., et al. A prospective study of asymptomatic carriers of the factor V Leiden mutation to dermine the incidence of venous thrombembolism. Ann Intern Med, 2001, 135(5), p. 322-327.
6. Papaian, LP., Kobilianskaia, VA., Sheldina, AM., et al. Changes in hemostasis system in patients with hereditary thrombophilia caused by mutation of blood coagulation factor V (factor V Leiden). Ter Arkh, 2001, 73(7), p. 47-51.
7. Greer, IA. Prevention and management of venous thrombembolism in pregnancy. Clin Chest Med, 2003, 24, p. 123‑137.
8. O’Connor, DJ., Scher, LA., Gargiulo, NJ., et al. Incidence and characteristics of venous thrombembolic disease during pregnancy and the postnatal period: a contemporary series. Ann Vasc Surg, 2011, 25(1), p. 9-14.
9. Bates, SM., Greer, IA., Pubinger, I., et al. Venous thrombembolism, thrombophilia, antithormbotic therapy and Pregnancy. Chest, 2008, 133, 6, suppl. P. 844S-886S.
10. Geerts, WH., Berquist, D., Pineo, GF., et al. Prevention of venous thrombembolism: American Chest Physicians Evidence – Based Clinical Practice Guidelines (8th Edition) Chest, 2008, 133, 6 ,suppl. p. 381S-453S.
11. Roger, MA. Anticoagulant prophylaxis for placenta mediated pregnancy complications. Thromb Res, 2011, 127, suppl. 3, p. S76-S80.
12. Castoldi, E., Rosing, J. Thrombin generation tests. Thromb Res, 2011, 127, Suppl. 3, p. S21-S25.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2012 Číslo 1
-
Všechny články tohoto čísla
- Fytoestrogeny v menopauze: mechanismus účinku a výsledky léčby v sestavě 28 pacientek
- Psychosociální potřeby novorozence v kontextu perinatální péče
- Nové kolposkopické znaky – výběžky a vnitřní hranice
- Představuje asymptomatické nosičství mutace FV Leiden a FII protrombin v heterozygotní konfiguraci zvýšené riziko trombembolických komplikací v průběhu těhotenství, porodu a šestinedělí?
- Centralizace gynekologicko-porodnické péče
- Rizikové faktory pro vznik recidivy u borderline nádorů ovaria
- Je hysteroskopie správná volba pro řešení reziduí těhotenských tkání?
- Nákladová efektivita a další ekonomické aspekty strategií prenatálního screeningu trizomie 21 v České republice
- Infekce dolních močových cest u žen – možnosti diferencovaného přístupu léčby a prevence
- Neinvazívne meranie dĺžky bunkového cyklu v prvých dňoch embryonálneho vývoja - objektívne merateľný ukazovateľ životaschopnosti ľudských embryí
- Genetické faktory v etiopatogenezi děložních myomů
- Invazivní karcinom cervixu od depistážních akcí k národnímu screeningu v České republice
- Reakce na závěry Sekce UZ diagnostiky ČGPS publikované v Zpravodaji SSG ČR 4, 2011
- Reakce na připomínky MUDr. Petra Poláka, CSc., k dokumentům České gynekologické a porodnické společnosti (ČGPS) České lékařské společnosti (ČLS) Jana Evangelisty Purkyně (JEP)
- Změny ve specializačním vzdělávání v gynekologii a porodnictví od roku 2012
- PERIPARTÁLNÍ ŽIVOT OHROŽUJÍCÍ KRVÁCENÍ mezioborové konsenzuální stanovisko
- Problematika nabízení LBC v rámci screeningu karcinomu děložního hrdla v gynekologických ordinacích za úhradu pacientkou
- Metoda redukce odlesku v kolposkopii
- CELOSTÁTNÍ KONFERENCE České gynekologické porodnické společnosti ČLS JEP a Sdružení soukromých gynekologů ČR
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Je hysteroskopie správná volba pro řešení reziduí těhotenských tkání?
- Nové kolposkopické znaky – výběžky a vnitřní hranice
- Rizikové faktory pro vznik recidivy u borderline nádorů ovaria
- Psychosociální potřeby novorozence v kontextu perinatální péče
