Metylácia vybraných tumor-supresorických génov v benígnych a malígnych ovariálnych nádoroch
Methylation of selected tumor-supressor genes in benign and malignant ovarian tumors
Objective:
To evaluate the usefullness of examination of methylation status of selected tumor-supressor genes in early diagnosis of ovarian cancer.
Design:
Prospective clinical study.
Setting:
Department of Gynecology and Obstetrics, Department of Molecular Biology, Jessenius Medical Faculty, Commenius University, Martin, Slovak Republic.
Methods:
In this study we analyzed hypermethylation of 5 genes RASSF1A, GSTP, E-cadherin, p16 and APC in ovarian tumor samples from 34 patients – 13 patients with epithelial ovarian cancer, 2 patients with border-line ovarian tumors, 12 patients with benign lesions of ovaries and 7 patients with healthy ovarian tissue. The methylation status of promoter region of tumor-supressor genes was determined by Methylation Specific Polymerase Chain Reaction (MSP) using a nested two-step approach with bisulfite modified DNA template and specific primers.
Results:
Gene methylation analysis revealed hypermethylation of gene RASSF1A (46%) and GSTP (8%) only in malignant ovarian tissue samples. Ecad, p16 and APC genes were methylated both in maignant and benign tissue samples. Methylation positivity in observed genes was present independently to all clinical stages of ovarian cancer and to tumor grades. However, there was observed a trend of increased number and selective involvement of methylated genes with increasing disease stages. Furthermore, there was no association between positive methylation status and histological subtypes of ovarian carcinomas.
Conclusion:
RASSF1A and GSTP promoter methylation positivity is associated with ovarian cancer. The revealed gene-selective methylation positivity and the increased number of methylated genes with advancing disease stages could be considered as a useful molecular marker for early detection of ovarian cancer. However, there is need to find diagnostic approach of specifically and frequently methylated genes to determining a methylation phenotype for early detection of ovarian malignancies.
Key words:
ovarian cancer, DNA methylation, early detection.
Authors:
M. Cuľbová 1; Z. Lasabová 2; A. Štanclová 2; P. Tilandyová 2; P. Žúbor 1; R. Fiolka 1; J. Danko 1; J. Višňovský 1
Authors‘ workplace:
Gynekologicko-pôrodnícka klinika JLF UK a UNM, Martin, prednosta prof. MUDr. J. Danko, CSc.
1; Ústav molekulovej biológie, Vrútky, prednostka RNDr. Z. Lasabová, Ph. D.
2
Published in:
Ceska Gynekol 2011; 76(4): 274-279
Overview
Cieľ štúdie:
Zhodnotenie využiteľnosti vyšetrovania metylačného stavu vybraných tumor-supresorických génov vo včasnej diagnostike ovariálneho karcinómu.
Typ štúdie:
Prospektívna klinická štúdia.
Názov a sídlo pracoviska:
Gynekologicko-pôrodnícka klinika, Ústav molekulovej biológie, Jesseniova lekárska fakulta, Univerzita Komenského, Martin, Slovenská republika.
Metodika:
V tejto štúdii bola analyzovaná hypermetylácia 5 génov RASSF1A, GSTP, E-kadherín, p16 a APC vo vzorkch ovariálnych tkanív od 34 pacientok – od 13 pacientok s epiteliálnym karcinómom ovárií, od 2 pacientok s border-line tumorom ovária, od 12 pacientok s benígnymi ovariálnymi léziami a od 7 pacientok so zdravým ovariálnym tkanivom. Metylačný stav promotorových oblastí tumor-supresorických génov bol stanovený na základe metylačne špecifickej polymerázovej reťazovej reakcie s využitím dvojkrokového prístupu s bisulfidovou modifikáciou DNA a špecifickými primermi.
Výsledky:
Analýza metylácie génov odhalila hypermetyláciu génu RASSF1A (46%) a GSTP (8%) len vo vzorkách malígnych ovariálnych tkanív. Gény E-cad, p16 a APC boli metylované v malígnych aj benígnych tkanivových vzorkách. Metylácia vyšetrovaných génov bola prítomná nezávisle od klinického štádia a od gradingu tumorov. Bol pozorovaný trend zvýšeného počtu a selektívnej prítomnosti metylovaných génov so stúpajúcim štádiom ochorenia. Nebola zaznamenaná asociácia medzi pozitivitou metylácie a histologickými subtypmi ovariálneho karcinómu.
Záver:
Metylácia RASSF1A a GSTP je asociovaná s ovariálnym karcinómom. Odhalená génovo-selektívna pozitivita metylácie a zvyšujúce sa množstvo metylovaných génov so stúpajúcim štádiom ochorenia by mohli byť užitočným molekulárnym markerom pre včasnú detekciu ovariálneho karcinómu. Stále je však potrebné pátrať po ďalších špecificky a frekventne metylovaných génoch, determinujúcich metylačný fenotyp pre včasnú diagnostiku ovariálnych malignít.
Kľúčové slová:
ovariálny karcinóm, DNA metylácia, včasná diagnostika.
ÚVOD
Ovariálny karcinóm je závažné ochorenie s vyskokou mortalitou, ktorá je z veľkej časti spôsobená jeho neskorým záchytom v pokročilom štádiu, kedy je 5-ročné prežívanie pacientiek len okolo 30 %. Skoršia diagnostika ochorenia v štádiu I–II by mohla zvýšiť prežívanie pacientiek v niektorých prípadoch až na 80–90 % [1]. Súčasný skríning ovariálneho karcinómu, pozostávajúci z ultrasonografie a vyšetrenia sérovej hladiny tumormarkerov však nie je dostatočne efektívny v detekcii včasných štádií tohto ochorenia, preto aj napriek pokrokom v liečbe počas posledných 30 rokov mortalita ovariálnych malignít neklesla [2].
Jednou z novo sa otvárajúcich možností včasnej diagnostiky malígnych ochorení je detekcia metylácie DNA. DNA hypermetylácia je kovalentná chemická modifikácia, ktorá spočíva v pripojení metylovej skupiny na piaty uhlík v cytozínovom kruhu. Je to fyziologický proces, založený už vo včasných štádiách embryogenézy a veľmi precízne kontrolovaný. Jeho úlohou je udržiavať určité všeobecné vlastnosti vo všetkých bunkách a vytvárať špecifické vlastnosti v bunkách rôznych tkanív a orgánov. Metylácia DNA je realizovaná prostredníctvom DNA metyltransferáz, ktorých aktivita v dospelosti prudko klesá, väčšina genómu je teda za fyziologických okolnosti v nemetylovanom stave [3].
Nadmerná metylácia promotorových oblastí génov vedie spolu s deacetyláciou histónov k potlačeniu ich expresie [4]. Metylácii podliehajú gény, zapojené do regulácie bunkového cyklu, diferenciácie, reparácie DNA, apoptózy, detoxifikácie, angiogenézy, adhezivity buniek a metastazovania, ale aj rezistencie na chemoterapiu. Hypermetylácia génov patrí ku včasným udalostiam v procese karcinogenézy a je detekovateľná nielen v postihnutých tkanivách, ale aj rôznych telesných tekutinách [24]. Vďaka týmto vlastnostiam by mohla byť vhodným markerom pre včasnú diagnostiku malignít. Jej využitie je možné aj v predikcii prognózy ochorenia a odpovede na liečbu, a dokonca i v liečbe samotnej, keďže metylácia génov je reverzibilný proces, ktorý je možné ovplyvniť pomocou demetylačných činidiel (inhibítory DNA metyltransferáz a histónových deacetyláz) [6, 7].
Kým niektoré gény sa vyskytujú v hypermetylovanom stave u viacerých malignít, iné sú špecifické len pre určitý typ zhubných nádorov [5]. Pri ovariálnom karcinóme nebol dosiaľ objavený jeden univerzálny gén, potvrdzujúci jeho ochorenia. Doterajšie štúdie ukazujú, že bude potrebné zostaviť tzv. metylačný fenotyp, pozostávajúci zo skupiny génov, ktoré sa vyskytujú pri ovariálnom karcinóme s najvyššou frekvenciou [11]. Keďže takúto skupinu génov sa pri ovariálnom karcinóme zatiaľ nepodarilo zostaviť, alternatívou je tzv. metylačný index. Index je založený na celkovom počte metylovaných génov u pacienta s nádorovým ochorením. Čím je vyšší, tým je vyššie riziko prítomnosti malígneho nádoru a jeho nepriaznivej prognózy. U invazívnych ovariálnych lézií je metylačný index signifikantne vyšší ako u neinvazívnych tumorov [26].
Cieľom tejto štúdie je zistiť súvislosť metylácie vyšetrovanej skupiny tumor-supresorických génov s etiopatogenézou ovariálneho karcinómu a posúdiť eventuálnu využiteľnosť tohoto vyšetrenia vo včasnej diagnostike ochorenia.
METODIKA
Do štúdie bolo zapojených 34 pacientiek, u ktorých bola na základe palpačného a ultrasonografického vyšetrenia zistená prítomnosť ovariálneho tumoru a nebolo u nich potvrdené iné malígne ochorenie. Všetky pacientky sa podrobili operačnej liečbe. Z čerstvého nefixovaného tkaniva nádoru bola odobratá vzorka 3x3 mm, ktorá bola následne zaliata fyziologickým roztokom a v chladiacom boxe transportovaná do ústavu molekulovej biológie, kde prebiehalo jej ďalšie spracovanie.
Izolácia DNA
Do nádobky, obsahujúcej ovariálne tkanivo, bolo pridaných 300 μl jadrá rozkladajúceho roztoku a 20 μl proteinkinázy. Nasledovala inkubácia pri 56 °C až do rozrušenia tkaniva. Do nukleárneho lyzátu bolo pridaných 100 μl proteín precipitačného roztoku a po 15 sekundách sa vytvorili skupinky bielkovín, ktoré boli potom centrifugované 3 minúty. Centrifugát bol transferovaný do čistých 1,5 ml mikrocentrifugačných túb, obsahujúcich 300 μl izopropanolu izbovej teploty. Po jemnom premiešaní roztoku sa vytvorili biele prúžky DNA. Nasledovala centrifugácia pri 14 000 rpm 1 minútu pri izbovej teplote. Po odstránení supernatantu bol do DNA pridaný 70% etanol izbovej teploty a skúmavka bola jemne premiešaná, aby sa očistili čiastočky DNA. Pokračovalo sa v centrifugovaní pri 14 000 rpm 1 minútu pri izbovej teplote. Potom bol etanol opatrne aspirovaný pipetovou špičkou. Čiastočky DNA sa nechali vysušiť 10–15 minút a znovu rozpustili v 20–50 μl TE. DNA bola uskladnená pri 2–8 °C.
Bisulfidová modifikácia
Bisulfidová modifikácia nemetylovaného cytozínu vo vzorkách genomickej DNA, vedúca k jeho konverzii na uracil, bola realizovaná pomocou CpGenom DNA modifikačného kitu (Millipore, USA) podľa protokolu výrobcu. 1 μg genomickej DNA, rozpustenej v 100 μl vody, bol denaturovaný pomocou 7,0 μl of 3 M NaOH a inkubovaný cez noc. DNA bola potom naviazaná na 5 μl mikročiastkový nosič v prítomnosti 750 μl Reagens II, zodpovedného za desulfonáciu. Modifikovaná DNA bola získaná opakovaným premytím 70% etanolom a nasledujúcou centrifugáciou. DNA bola nakoniec odlúčená od nosiča zohriatím v 25 μl TE nárazníka, rozdelená po 5 μl a uskladnená pri -20 °C.
Metylačne špecifická PCR
Metylačný stav promotorových oblastí génov GSTP1, Ecad, APC, p16 a RASSF1A bol determinovaný prostredníctvom MSP. Polymerázová reťazová reakcia (polymerase chain reaction – PCR) bola realizovaná s 1,0 μl bisulfidovo modifikovanej vzorky DNA v 25 μl reagenčnej zmesi, obsahujúcej 2,5 mmol/l MgCl2, 10 pmol/l dopredu idúceho a reverzného primeru, 0,5 mmol/l každého zo štyroch dNTPáz, 2,5 μl 10x PCR nárazníka (ABgene, United Kingdom) a jednu jednotku Thermostart Taq polymerázy (ABgene, United Kingdom). Sekvencie primerov ukazuje tabuľka 1. Prvý krok PCR bol realizovaný pomocou externých primerov, viažúcich sa na metylovanú aj nemetylovanú DNA. PCR produkty z prvého kroku boli rozriedené 1 : 500 a nasledovala druhá PCR s primermi, viažúcimi sa na metylovanú DNA. Teplota PCR reakcie stúpala na 95 °C počas 5 minút, nasledovalo 35 cyklov denaturácie pri 95 °C 30 sekúnd, annealing pri 56 °C 30 sekúnd, extenzia pri 72 °C 30 sekúnd a ako posledný krok 4 minúty pri 72 °C. Druhý krok PCR bol realizovaný identicky okrem annealingovej teploty, ktorá bola v rozmedzí 58–62 °C, a počtu cyklov 25–30. Pre každý set bisulfidovej modifikácie a PCR bola použitá pozitívna a negatívna kontrola pre metylovanú a nemetylovanú DNA – CpGenome Universal Methylated DNA (Millipore, USA) and CpGenome Unmethylated DNA (Millipore, USA). Voda bez vzorky DNA bola použitá ako kontrola možnej kontaminácie. 12 μl každej PCR reakcie bolo naložených na 1,75% agarózový gél, nasledovalo farbenie ethidium bromidom a vizualizácia výsledkov prostredníctvom UV iluminátora. 100 bp rebrík (Fermentas, Germany) bol použitý ako štandard molekulárnej hmotnosti.
![Sekvencie primerov [34]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/331d3bcd89e0827069775cda34e88b04.png)
VÝSLEDKY
Do štúdie bolo zaradených 34 pacientok vo vekovom rozmedzí 34 až 78 rokov, ktoré podpísali informovaný súhlas so zaradením do štúdie. Vekové rozloženie pacientok v jednotlivých sledovaných skupinách zobrazuje tabuľka 2. Priebeh štúdie bol odsúhlasený Etickou komisiou UK v Martine.
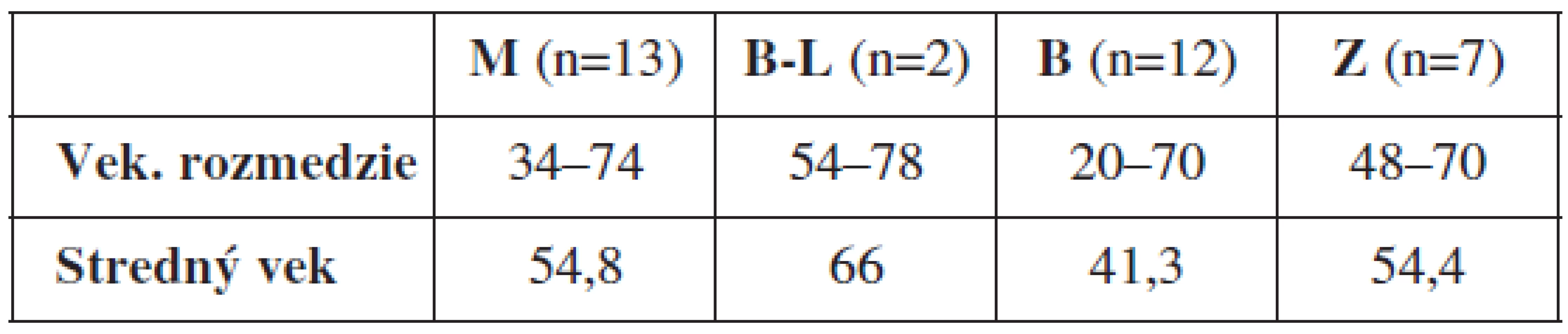
Typ nádoru bol určený na základe histologického vyšetrenia. U 13 pacientok bol diagnostikovaný ovariálny karcinóm, u 2 border-line tumor ovária, 12 žien malo benígnu ovariálnu léziu a 7 ovariálnych tkanív bolo od zdravých žien. Výsledky vyšetrenia metylácie promotorov génov RASSF1A, GSTP, Ecad, p16 a APC zobrazuje tabuľka 3.
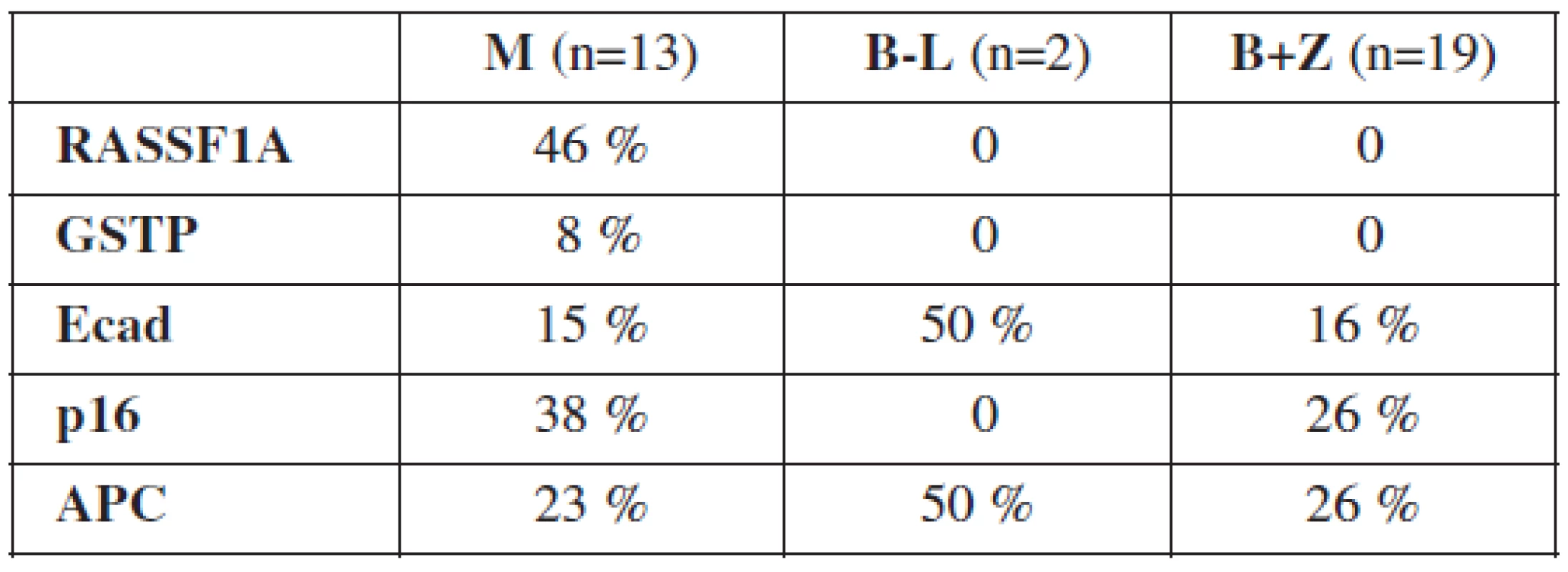
Gény RASSF1A a GSTP boli metylované výlučne vo vzorkách ovariálnych karcinómov, kým gény Ecad, p16 a APC sa nachádzali v metylovanom stave aj u border-line a benígnych tumorov ovárií. Najvyššia frekvencia metylácie v skupine malígnych nádorov bola zistená u génov RASSF1A, p16 a APC. U border-line tumorov ovárií boli hypermetylované gény Ecad a APC. 69 % malígnych vzoriek malo metylovaný aspoň 1 gén, 31 % 2 a viac génov a 8 % malo metylovaných všetkých 5 génov. Border-line tumory mali metylovaný aspoň 1 gén v 50 %. U benígnych a zdravých ovariálnych tkanív bola detekovaná metylácia najviac 2 génov a 42 % z nich nemalo metylovaný ani jeden z vyšetrovaných génov.
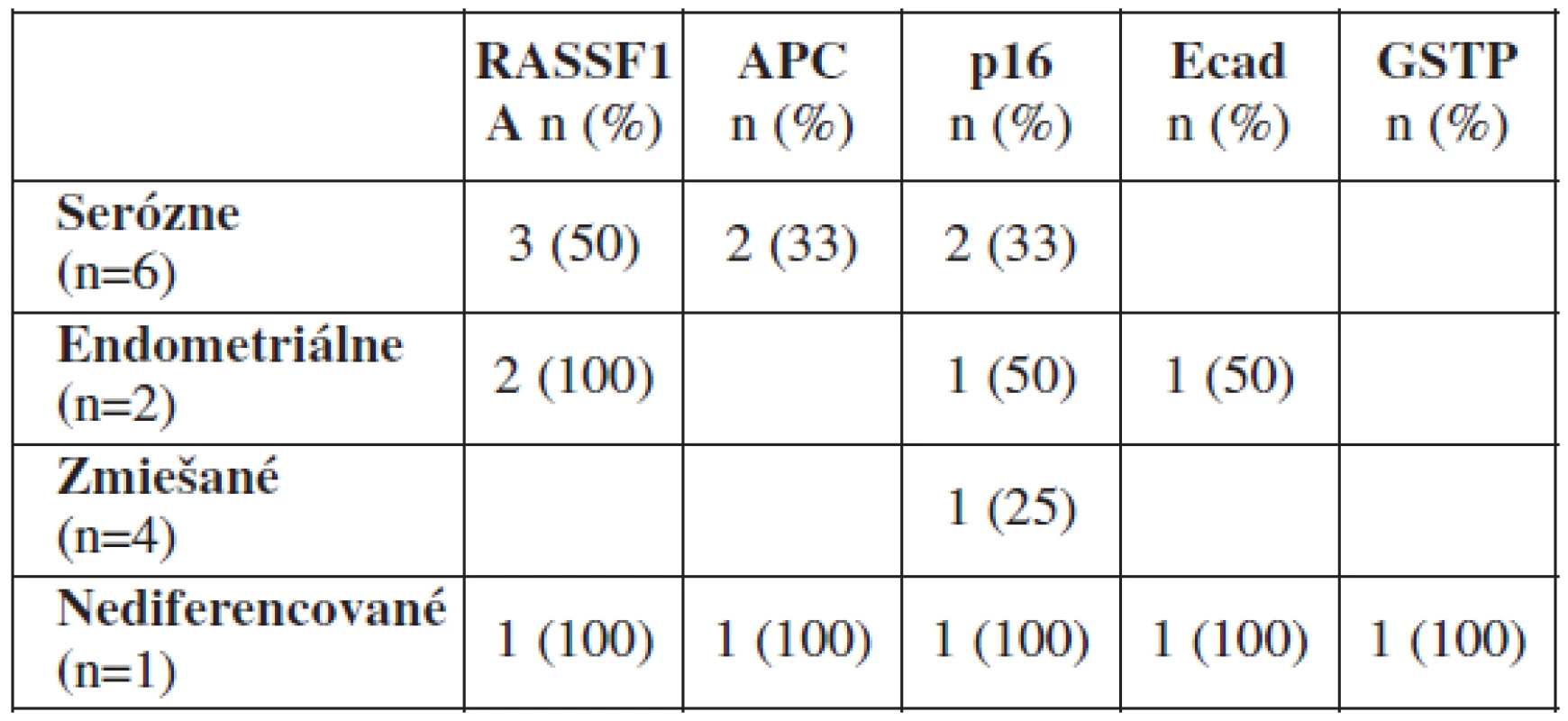
Medzi vyšetrenými vzorkami nebol pozorovaný signifikantný rozdiel v metylácii génov v závislosti od histologického subtypu nádoru. Z 13 malígnych ovariálnych nádorov bolo 6 seróznych (metylované gény RASSF1A, APC, p16), 2 endometroidné (metylované gény RASSF1A, p16 a Ecad), 1 nediferencovaný (metylované všetky gény) a 4 zmiešané karcinómy (tabuľka 4).
Hypermetylácia promotorov génov RASSF1A, p16 a Ecad bola detekovaná už u dobre diferencovaných tumorov (grade 1, 2), u zle diferencovaných boli metylované všetky vyšetrované gény. U génov RASSF1A, p16 a Ecad bola potvrdená metylácia už v 1. štádiu ochorenia. V štádiu 3 bola prítomná hypermetylácia všetkých vyšetrovaných génov.
DISKUSIA
V štúdii bolo analyzovaných 34 vzoriek ovariálnych tkanív na prítomnosť hypermetylácie promotorových oblastí génov RASSF1A, GSTP, Ecad, p16 a APC.
RASSF1 gén je lokalizovaný na chromozóme 3p21.3 [14]. Ras GTPázy tvoria rodinu molekúl, regulujúcich bunkovú proliferáciu, diferenciáciu, motilitu a apoptózu na základe extracelulárnych signálov [9]. Mechanizmus účinku génu RASSF1A spočíva v asociácii s mikrotubulmi počas interfázy, čo je esenciálny krok pre inhibíciu rastu buniek [8]. Strata expresie RASSF1A je zvyčajne podmienená promotorovou hypermetyláciou. Jeho somatické mutácie nie sú bežné [12]. Metylácia RASSF1A sa vyskytuje so stredne vysokou až vysokou frekvenciou u viacerých rôznych typov malígnych tumorov (karcinóm prsníka, pľúc, prostaty, obličky, ovária) a zriedkavo sa vyskytuje v normálnych tkanivách [33]. U border-line nádorov ovárií metylácia RASSF1A koreluje s prítomnosťou mikroinvázie, peritoneálnych implantátov a s bilateralitou [13]. Frekvencia hypermetylácie stúpa so štádium ochorenia a jeho zhoršujúcou sa diferenciáciou, indikuje zlú prognózu [15]. V tejto štúdii bola potvrdená prítomnosť metylácie génu RASSF1A výlučne u malígnych ovariálnych tumorov s frekvenciou 46% bez subtypovej diferenciácie, a to už v štádiu 1 a u dobre diferencovaných nádorov. Mohol by teda byť potenciálne využiteľný vo včasnej diagnostike malígnych ovariálnych lézií.
Gén GSTP je lokalizovaný na chromozóme 11q13. Glutatión-S-transferázy katalyzujú konjugáciu glutatiónu s mnohými potenciálne genotoxickými zlúčeninami. Zabezpečujú detoxifikáciu produtov oxidačného stresu v bunkách. Sú zahrnuté do regulácie bunkovej proliferácie a apoptózy [19]. Hypermetylácia GSTP sa vyskytuje u viacerých typov malignít (typicky pri karcinóme prostaty) [29]. V prípade ovariálnych tumorov je dosiaľ popisovaná len u invazívnych lézií [20]. Takýto záver bol potvrdený aj v tejto štúdii, kde bola detekovaná jeho metylácia v 8% vyšetrených vzoriek ovariálnych karcinómov.
Gén Ecad je lokalizovaný na chromozóme 16q22.1 a patrí do rodiny kalcium dependentných bunkových adhezívnych molekúl [16]. Nachádza sa predominantne v epiteliálnych bunkách a jeho úloha spočíva v udržiavaní integrity tkanív [21]. Metylácia Ecad bola popisovaná u rôznych typov karcinómov (karcinóm žalúdka, prsníka, močového mechúra, kolorekta, ovária) [28]. Metylačné potlačenie jeho funkcie vedie ku zvýšenej invazivite a metastazovaniu [27]. U ovariálnych tumorov môže byť prítomná metylácia Ecad už u benígnych lézií a u invazívnych nádorov koreluje s ich štádiom, prítomnosťou metastáz v lymfatických uzlinách a stupňom diferenciácie [17]. Táto štúdia zistila metyláciu Ecad v 15 % vo vzorkách malígnych ovariálnych tumorov, v 50 % border-line nádorov a v 16 % benígnych lézií. V prípade vzoriek ovariálnych karcinómov bola detekovaná metylácia Ecad už v 1. štádiu a u dobre diferencovaných tumorov.
Gén p16 je tumor-supresorický gén, lokalizovaný na chromozóme 9p21 a patrí do rodiny inhibítorov cyklín-dependentných kináz [30]. Zasahuje do regulácie bunkového cyklu [31]. Strata jeho expresie je prítomná v širokom spektre tumorov a súvisí s progresiou ochorenia a zhoršením prognózy [22]. Pri ovariálnom karcinóme bola detekovaná znížená expresia p16 v 71–79 % endometroidných a mucinóznych tumorov, kým len asi v 10 % seróznych tumorov [25]. Redukcia jeho expresie je najčastejšie spôsobená metyláciou promotorovej oblasti, no môže byť aj dôsledkom mutácií, delécií či kombináciou genetických a epigenetických zmien [23]. Metylácia môže byť prítomná už u benígnych lézií [32]. V tejto štúdii bol p16 gén metylovaný v 38 % malígnych ovariálnych tumorov, a to už v 1. štádiu a u dobre diferencovaných nádorov, a v 26 % benígnych lézií.
APC gén je lokalizovaný na chromozóme 5q21-q22 [10]. Je to tumor-supresorický gén, ktorý kontroluje bunkové delenie a podmieňuje zastavenie bunkového cyklu a apoptózu. Hypermetylácia APC génu vedie k nekontrolovanému deleniu buniek a bola potvrdená u karcinómu kolorekta, pľúc, ovárií, prsníka, prostaty i u ďalších typov malignít [18]. V tejto štúdii bola detekovaná hypermetylácia APC v 23 % malígnych ovariálnych tumorov, v 50 % border-line nádorov a v 26 % benígnych lézií. U vzoriek malígnych tkanív bola metylácia prítomná až v pokročilom štádiu ochorenia a u zle diferencovaných nádorov.
ZÁVER
Ovariálny karcinóm zapríčiňuje viac úmrtí u žien ako ktorýkoľvek iný zhubný nádor ženského genitálu. Keďže chýbajú včasné špecifické symptómy tohto ochorenia, v prevažnej väčšine prípadov je diagnostikované až v pokročilom štádiu. Včasné štádiá ovariálneho karcinómu sa vyznačujú signifikantne lepšou prognózou, problémom však ostáva ich diagnostika. Súčasný skríning ochorenia nemá dostatočnú senzitivitu ani špecificitu a nie je teda efektívny vo vyhľadávaní skorých štádií invazívnych ovariálnych lézií. Hľadanie nových účinnejších skríningovýcn metód sa stále viac posúva na molekulárnu úroveň – genetické a epigenetické zmeny, súvisiace s etiopatogenézou ovariálneho karcinómu. Výhodou využitia detekcie DNA metylácie je jej prítomnosť v postihnutých tkanivách, ale aj v telesných tekutinách vrátane krvi, a to už vo včasnom, klinicky nemanifestnom štádiu.
V tejto štúdii bola zistená metylácia génov RASSF1A (46%) a GSTP (8%) len vo vzorkách malígnych ovariálnych tkanív a metylácia génov Ecad, p16 a APC u benígnych i malígnych tumorov ovárií. Najvyššia frekvencia metylácie vo vzorkách ovariálnych karcinómov bola pozorovaná u génov RASSF1A, p16 a APC. Hypermetylácia génov RASSF1A, p16 a Ecad bola prítomná už v 1. štádiu ochorenia a u dobre diferencovaných nádorov. Z uvedených výsledkov vyplýva, že vyšetrovanie metylácie génu RASSF1A by mohlo byť potenciálne využiteľné vo včasnej diagnostike ovariálneho karcinómu. Je však potrebné pátrať po ďalších génoch, ktoré by v kombinácii s ním vytvorili metylačný fenotyp s dostatočnou senzitivitou a špecificitou pre diagnostiku ovariálneho karcinómu prostredníctvom korelácie cez univerzálny epigenetický signál medzi nádorom a metylačnou zmenou v sére.
Táto práca bola podporená projektom „Dobudovanie Centra excelentnosti pre perinatologický výskum“, ITMS kód: 26220120036, ktorý je spolufinancovaný zo zdrojov EÚ-ERDF.
Priebeh tejto štúdie bol podporovaný grantmi UK/420/2008 a UK/60/2009.
MUDr. Martina Cuľbová
Gynekologicko-pôrodnícka klinika
JLF UK a UNM
Kollárova 2
036 59 Martin
Slovensko
e-mail: culbova@jfmed.uniba.sk
Sources
1. Hoskins, WJ., Perez, CA., Young, RC., et al. Principles and practice of gynecologic oncology, 4th ed. Philadelphia: Lippincott Williams and Wilkins, 2005, p. 9-13, 33-36, 109-113, 157-167, 190-193, 250-259, 895-987.
2. Woodward, ER., Sleightholme, HV., Considine, AM., et al. Annual surveillance by CA 125 and transvaginal ultrasound for ovarian cancer in both high-risk and population risk women is ineffective. BJOG, 2007, 114, p. 1500-1509.
3. Das, PM., Singal, R. DNA methylation and cancer. J Clin. Oncol, 2004, 22, p. 4632-4642.
4. Paluszczak, J., Baer-Dubowska, W. Epigenetic diagnostics of cancer – the application of DNA methylation markers. J Appl Genet, 2006, 47, p. 365-375.
5. Wiley, A., Katsaros, D., Chen, H., et al. Abberant promoter methylation of multiple genes in malignant ovarian tumors and in ovarian tumors with low malignant potential. Cancer, 2006, 107, p. 299-308.
6. Watts , GS., Futscher, BW., Holtan, N., et al. DNA methylation changes in ovarian cancer are cumulative with disease progression and identify tumor stage. BMC Med Genomics, 2008, 1, p. 47-59.
7. Barton, CA., Hacker, NF., Clark, SJ., et al. DNA methylation changes in ovarian cancer: implications for early diagnosis, prognosis and treatment. Gynec Oncol, 2008, 109, p. 129-139.
8. Vos, MD., Martinez, A., Elam, C., et al. A role for the RASSF1A tumor supressor in the regulation of tubulin polymerization and genomic stability. Cancer Res, 2004, 64, p. 4244-4250.
9. Van der Weyden, L., Adams, DJ. The Ras-association domain family (RASSF) members and their role in human tumorigenesis. Biochim Biophys Acta, 2007, 1776, p. 58-85.
10. Xiao, L., Yu, L., Can, M. Expression of beta-catenin and APC protein in ovarian epithelial tumor and its implication. Chinese J Cancer Res, 2007, 19, p. 72-75.
11. Su, HY., Lai, HC., Lin, YW., et al. An epigenetic marker panel for screening and prognostic prediction of ovarian cancer. Int J Cancer, 2009, 124, p. 387-393.
12. Pfeifer, GP., Dammann, R. Methylation of the tumor supressor gene RASSF1A in human tumors. Biochemistry, 2005, 70, p. 699-707.
13. Ma, L., Guo, Q., Ma, Y., et al. Clinicopathological implications of inactivation of RASSF1A in serous epithelial ovarian cancers. Eur J Gynaecol Oncol, 2009, 30, p. 370-374.
14. Ma, L., Zhang, JH., Liu, FR., et al. Hypermethylation of promoter region of RASSF1A gene in ovarian malignant epithelial tumors. Zhongua Zhong Liu Za Zhi, 2005, 27, p. 657‑659.
15. Choi, YL., Kang, SY., Shin, YK., et al. Abberant hypermethylation of RASSF1A promoter in ovarian borderline tumors and carcinomas. Virchows Arch, 2006, 448, p. 331-336.
16. Yuecheng, Y., Hongmei, L., Xiaoyan, X. Clinical evaluation of E-cadherin expression and its regulation mechanism in epithelial ovarian cancer. Clin Exp Metastasis, 2006, 23, p. 65-74.
17. Koensgen, D., Freitag, C., Klaman, I., et al. Expression and localization of e-cadherin in epithelial ovarian cancer. Anticancer Res, 2010, 30, p. 2525-2530.
18. Liggett, TE., Melnikov, A., Yi, Q., et al. Distinctive DNA methylation patterns of cell-free plasma DNA in women, with malignant ovarian tumors. Gynecol Oncol, 2011, 120, p. 113-120.
19. Houshdara, S., Hawley, S., Palmer, C., et al. DNA methylation profiles of ovarian epithelial carcinoma tumors and cell lines. PLoS ONE, 2010, 5, e9359.
20. Balch, C., Fang, F., Matei, DE., et al. Minireview: Epigenetic changes in ovarian cancer. Endocrinology, 2009, 150, p. 4003‑4011.
21. Strathdee, G. Epigenetic versus genetic alterations in the inactivation of E-cadherin. Cancer Biol, 2002, 12, p. 373-379.
22. Huang, ZW., Jansen, RA., Fabbry, E., et al. Identification of candidate epigenetic biomarkers for ovarian cancer detection. Oncol Res, 2009, 22, p. 853-861.
23. Teschendorff, AE., Menon, U., Gentry-Maharaj, A., et al. An epigenetic signature in peripheral blood predicts active ovarian cancer. PLoS ONE, 2009, 4, e8274.
24. Asadollahi, R., Hyde, CAC., Zhong, XY. Epigenetics of ovarian cancer: from lab to clinic. Gynecol Oncol, 2010, 118, p. 81-87.
25. Konstantinopoulos, PA., Spentzos, D., Cannistra, SA. Gene-expression profiling in epithelial ovarian cancer. Nature Clin Pract Oncol, 2008, 5, p. 577-587.
26. Helou, K., Padilla-Nash, H., Wangsa, D., et al. Comparative genome hybridization reveals specific genomic imbalances during the genesis from benign, through borderline to malignant ovarian tumors. Cancer Genet Cytogenet, 2006, 170, p. 1-8.
27. Makarla, PB., Soboorian, H., Ashfaq, R., et al. Promoter hypermethylation profile of ovarian epithelial neoplasms. Clin Cancer Res, 2005, 11, p. 5365-5369.
28. Melnikov, A., Scholtens, D., Godwin, A., et al. Differential methylation profile of ovarian cancer in tissues and plasma. J Molec Diagnost, 2009, 11, p. 60-65.
29. Bol, GB., Suijkerbuijk, PM., Bart, J., et al. Methylation profiles of hereditary and sporadic ovarian cancer. Histopathology, 2010, 57, p. 363-370.
30. Katsaros, D., Cho, W., Singal, R., et al. Methylation of tumor-supressor gene p16 and prognosis of epithelial ovarian cancer. Gynecol Oncol, 2004, 94, p. 685-692.
31. Mc Cluskey, LL., Chen, C., Delgadillo, E., et al. Differencies in p16 gene methylation and expression in benign and malignant ovarian tumors. Gynecol Oncol, 1999, 72, p. 87-92.
32. Auerkari, EI. Methylation of tumor-supressor genes p16 (INK4a), p27 (KIP1) and Ec-cadherin in carcinogenesis. Oral Oncol, 2006, 42, p. 5-13.
33. Dammann, R., Schagdarsurengin, U., Seidel, C., et al. The tumor supressor RASSF1A in human carcinogenesis: an update. Histol Histopathol, 2005, 20, p. 245-263.
34. House, MG., Guo, M., Iacobuzio-Donahue, C., et al. Molecular progression of promoter methylation in intraductal papillary mucosinous neoplasms (IPMN) of the pancreas. Carcinogenesis, 2003, 24, p. 193-198.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2011 Issue 4
-
All articles in this issue
- Transabdominální ultrazvukové vyšetření v gynekologii
- Minimálně invazivní výkony pod ultrazvukovou kontrolou v onkogynekologii
- Aplikace metody SNP array v prenatální diagnostice
- Vplyv exogénneho luteinizačného hormónu na parametre IVF/ICSI cyklov
- Metylácia vybraných tumor-supresorických génov v benígnych a malígnych ovariálnych nádoroch
- Současná klasifikace zhoubných nádorů v onkogynekologii – část I
- Biochemické aspekty fetálnej hypoxie
- Trikuspidální regurgitace u plodu
- Je třeba revidovat doporučení prevence trombembolické nemoci u těhotných?
- Riziko vzniku prolapsu „de novo“ v primárne nepostihnutom kompartmente pri použití syntetického implantátu v rámci operačnej liečby prolapsu panvových orgánov
- Nová metoda screeningu Downova syndromu v I. trimestru: One-Stop-Clinic for Assessment of Risk (OSCAR)
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Trikuspidální regurgitace u plodu
- Aplikace metody SNP array v prenatální diagnostice
- Transabdominální ultrazvukové vyšetření v gynekologii
- Současná klasifikace zhoubných nádorů v onkogynekologii – část I

