Sakrokokcygeální teratom
Sacrococcygeal teratoma
Objective: Description of newborn with early prenatal diagnosis of sacrococcygeal teratomia.
Desing: Case report.
Setting: Department of Obstetrics and Gynecology, 2nd Faculty of Medicine and Faculty Hospital Motol Prague.
Case report: In this case report a term neonate with a massive sacrococcygeal teratoma was delivered by a cesarean section (approach by Geppert) with an intrapartal relieving punction of the tumor. It was a type II SCT with both pelvic end extracorporal component with a size of 60×35 centimeters. The tumor was completely resected during the first day of life and was followed by a normal function of lower extremities, normal bowel function and only transitional urinary tract symptoms.
Conclusion: A sacrococcygeal teratoma (SCT) is the most common congenital tumor in newborns with reported incidence of 1 : 35000-40000 live births affecting more frequently females (4 : 1). This germinal tumor is either benign (mature) or malignant (immature), mature types are more common in neonates. A SCT is usually diagnosed by prenatal ultrasound, magnetic resonance is performed to characterize it‘s size and content, type of tumor (type I–IV Altman classification) and relation to surrounding tissues. Preemptive early delivery by cesarean section is recommended when the tumor exceeds the diameter of 5 centimeters to avoid complications during vaginal delivery (rupture, bleeding etc.). The primary treatment of SCT is an early surgical resection with a complete resection of the coccyx („en bloc“ resection), malignant tumors are indicated for adjuvant chemotherapy. Long term complications can be urinary tract or bowel dysfunctions, lower extremity muscle weakness or paralysis and recurrence of the tumor with potential malignancy.
Keywords:
sacrococcygeal teratoma – SCT – delivery technique – intrapartal punction
Autoři:
G. Mlčochová 1; L. Kučerová 2; B. Rousková 2; M. Rygl 2; B. Prosová 3; J. Matěcha 4
; Michal Černý 1
; L. Hercíková 5; J. Sochůrek 6; Tomáš Fait 4
Působiště autorů:
Novorozenecké oddělení s JIRP, Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha, prim. MUDr. M. Černý
1; Klinika dětské chirurgie 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. M. Rygl, Ph. D.
2; Klinika zobrazovacích metod 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. M. Roček, CSc.
3; Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha, přednosta MUDr. R. Chmel, Ph. D., MHA
4; Gynekologická ambulance, Poliklinika Škoda, Mladá Boleslav, vedoucí MUDr. L. Hercíková
5; Gynekologie Amáta, Mladá Boleslav, vedoucí MUDr. J. Sochůrek
6
Vyšlo v časopise:
Ceska Gynekol 2019; 84(2): 140-144
Kategorie:
Kazuistika
Souhrn
Cíl studie: Popis případu novorozence s časně zjištěným sakrokokcygeálním teratomem (SCT).
Typ studie: Kazuistika.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha.
Vlastní pozorování: Přes monstrózní rozměry sakrokokcygeálního teratomu se v našem případě podařilo díky intrapartální odlehčovací punkci děvče s nádorem porodit k děloze nejšetrnějším řezem podle Gepperta. Teratom byl kompletně odstraněn, hybnost končetin i kontinence moči a stolice byla zachována.
Závěr: Tento germinální nádor s nízkou incidencí častěji postihuje dívky. Diagnostika se provádí na základě prenatálního ultrazvukového vyšetření a následné magnetické rezonance ke zhodnocení velikosti nádoru, jeho typu a vztahu k okolním tkáním. Těhotenství plodů s nádory většími než 5 cm jsou indikovány k ukončení císařským řezem s cílem minimalizace komplikací při vaginálním porodu (ruptura, krvácení atd.). Terapií je časná operační „en bloc“ resekce nádoru s kostrčí. Mezi dlouhodobé komplikace patří poruchy vyprazdňování stolice nebo moči, hybnosti dolních končetin a recidiva nádoru s možnou malignizací.
Klíčová slova:
sakrokokcygeální teratom – SCT – technika porodu – punkce teratomu
ÚVOD
Sakrokokcygeální teratom (SCT) je nejčastějším nádorem novorozenců a řadí se mezi germinální nádory vznikající z pluripotentních zárodečných buněk v extragonadální lokalizaci [3, 8]. Incidence se uvádí 1 5 00–40 00 živě narozených, častěji bývají postiženy dívky v poměru 4 [2, 7, 10]. SCT je nádor obsahující tkáně pocházející ze všech tří zárodečných listů (ektoderm, mezoderm a endoderm), až v 50 % teratomy obsahují osifikovanou či kalcifikovanou tkáň, ale jsou známy tím, že díky přítomnosti všech tří zárodečných listů mohou obsahovat kteroukoli lidskou tkáň (různé druhy epitelu až po formované oko či části končetin) [8, 9, 10, 11]. Tyto tumory jsou solidní či cystické a mohou být benigní nebo maligní podle přítomnosti nezralých elementů [7]. V neonatálním období jsou nejčastější formy benigní, tedy zralé teratomy [7, 9].
V současnosti se uvádějí čtyři hlavní typy SCT podle Altmanovy klasifikace: I. typ (nejčastější) je převážně extrakorporální s minimální pánevní komponentou, u II. typu je podíl intraabdominální a extraabdominální složky nádoru přibližně stejný (popisuje se jako vzhled přesýpacích hodin), III. typ obsahuje z větší části intraabdominální podíl tumoru a IV. typ je uložen kompletně v pánvi v presakrální oblasti. Intradurální invaze je vzácná, nádor ale svou velikostí může tlačit na páteřní kanál a útlakem míchy způsobovat neurologické příznaky [3, 7]. Asociovanými vadami u SCT jsou anorektální a genitální malformace, sakrální ageneze, meningokéla, dislokace pánve velmi objemnými tumory, defekt komorového septa, gastrointestinální anomálie a další [9].
VLASTNÍ POZOROVÁNÍ
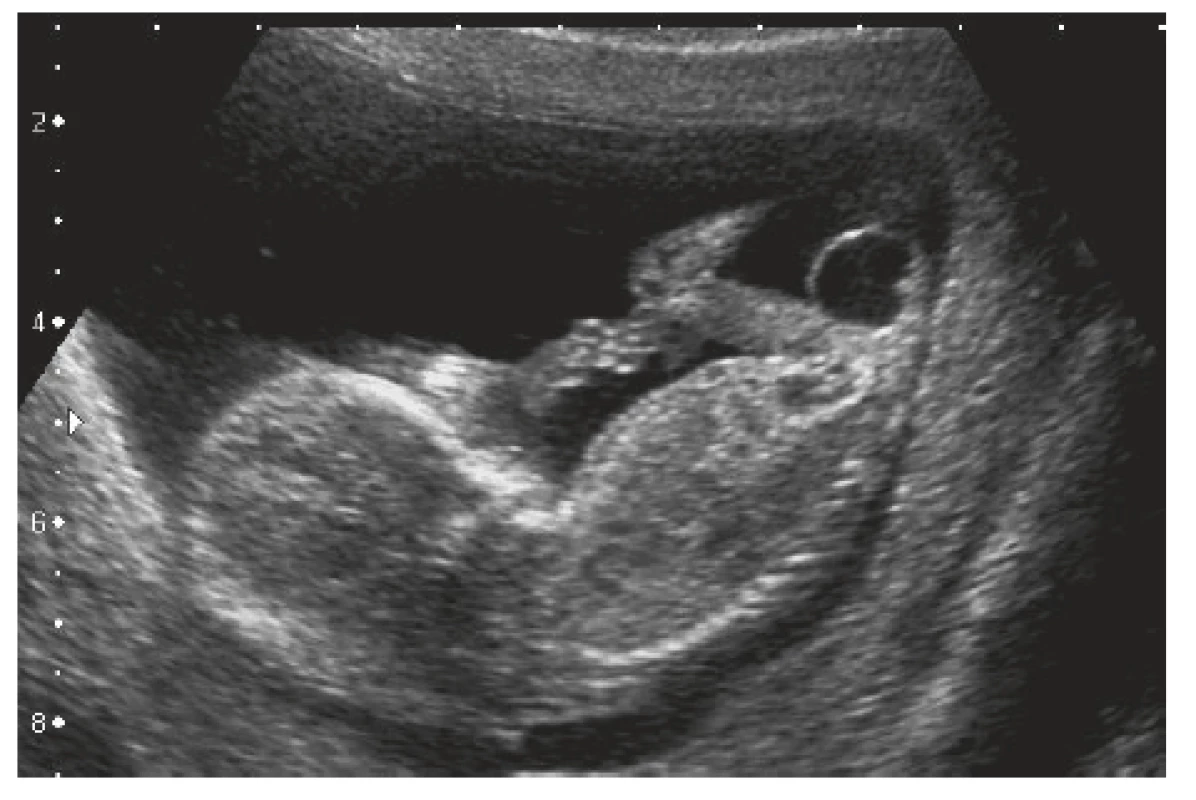
Dívka pochází z první rizikové gravidity sledované od 12. gestačního týdne pro sakrokokcygeální expanzi. Anamnéza matky byla nevýznamná, prvotrimestrální biochemický screening byl hodnocen jako negativní. Na prvotrimestrálním screeningovém ultrazvukovém (UZ) vyšetření v místě bydliště byla patrna expanze v sakrokokcygeální oblasti (obr. 1), proto byla gravidní žena odeslána k dovyšetření a naplánování následného postupu do fakultní nemocnice v Motole. Vstupně byla na UZ patrna expanze o velikosti 20×20×18 mm, v diferenciální diagnóze byla zvažována cystická spina bifida nebo sakrální teratom.
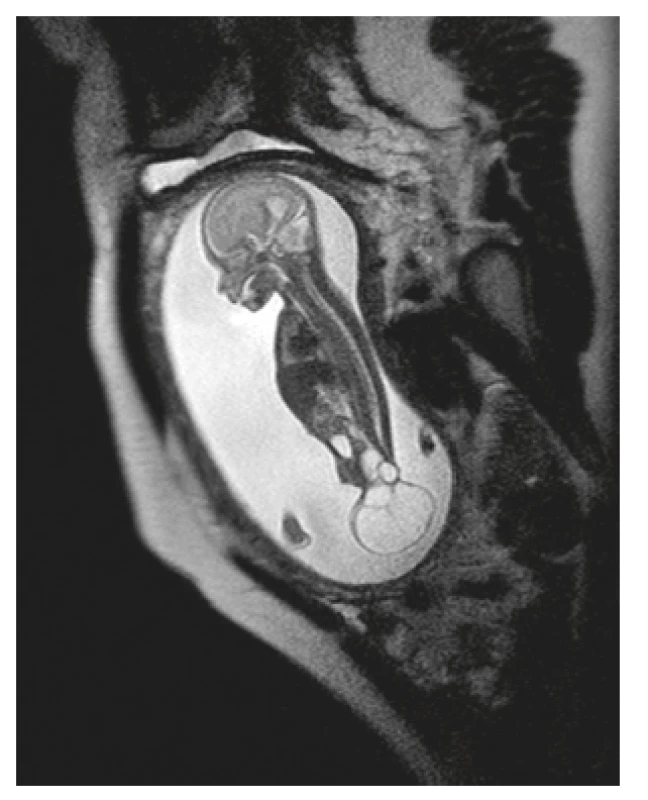
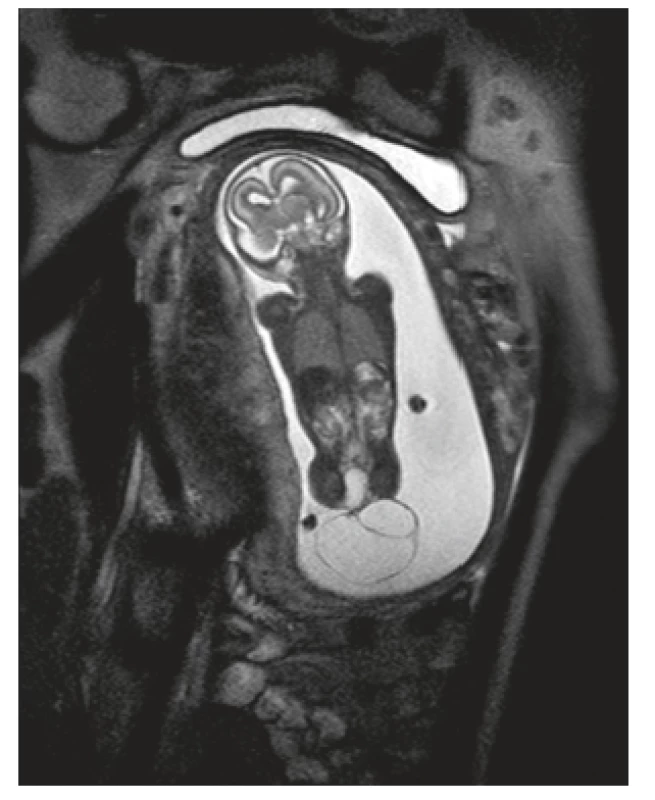
V 18. gestačním týdnu proběhla magnetická rezonance, kde byla přítomna expanze s intrapelvickou a extrakorporální složkou naléhající na gluteální oblast, bez známek rozštěpové vady či fixace míchy, oblast rekta byla bez mekoniové akumulace se střevními kličkami bez dilatace (obr. 2 a 3). Nález byl interpretován jako sakrokokcygeální teratom II. typu. Týž den byla provedena amniocentéza s následným komplexním genetickým vyšetřením, které nepotvrdilo genetickou odchylku. Na multioborovém semináři byla doporučena kontrolní UZ vyšetření každé tři týdny a plánované ukončení těhotenství per sectionem cesaream. Během následujících týdnů došlo k nárůstu velikost útvaru a rozvoji polyhydramnia, bez známek srdečního selhání plodu.
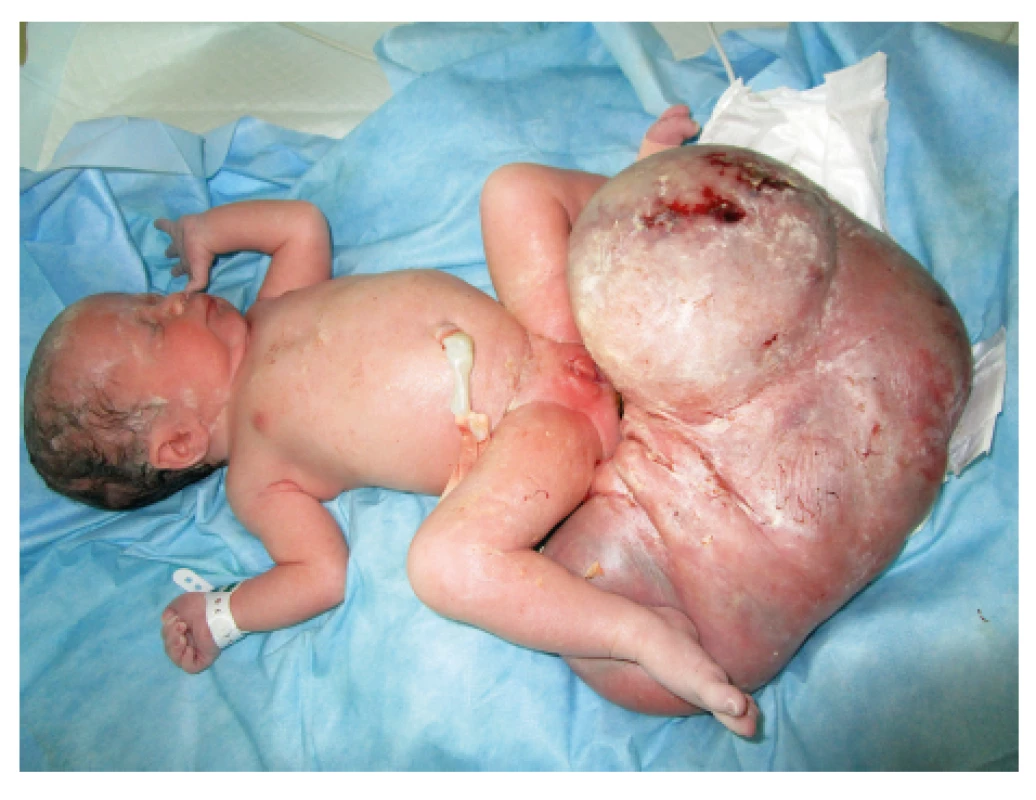
Pro progresi velikosti nádoru a rozvoj polyhydramnia bylo těhotenství ukončeno císařským řezem v 38 + 1 gestačním týdnu. Vzhledem k primiparitě rodičky a cystickému charakteru teratomu byl pro císařský řez volen klasický přístup ze suprapubického Pfannenstielova řezu a na děloze byl proveden obloučkovitý řez podle Gepperta v oblasti dolního děložního segmentu. Čirá plodová voda odtekla peroperačně po dirupci vaku blan. Tělo plodu bylo vybaveno bez komplikací, novorozenec křičel na pupečníku. Podle předpokladu v děloze zůstala extrakorporální část sakrálního teratomu a nedařilo se ji vybavit, proto byla provedena punkce útvaru s odsátím 340 ml serózní tekutiny. Po úspěšném odsátí došlo k porození tumoru a uvolnění celého těla dívky s obrovským sakrálním tumorem o velikosti 60×35 cm se spontánně odtékající tekutinou z defektu (obr. 4 a 5). Adaptace dítěte byla dobrá (skóre podle Apgarové 9–10–10 bodů), po porodu vážilo 5710 g. Dívka byla zajištěna na porodním sále a po předchozí domluvě převezena na Kliniku dětské chirurgie FN Motol.
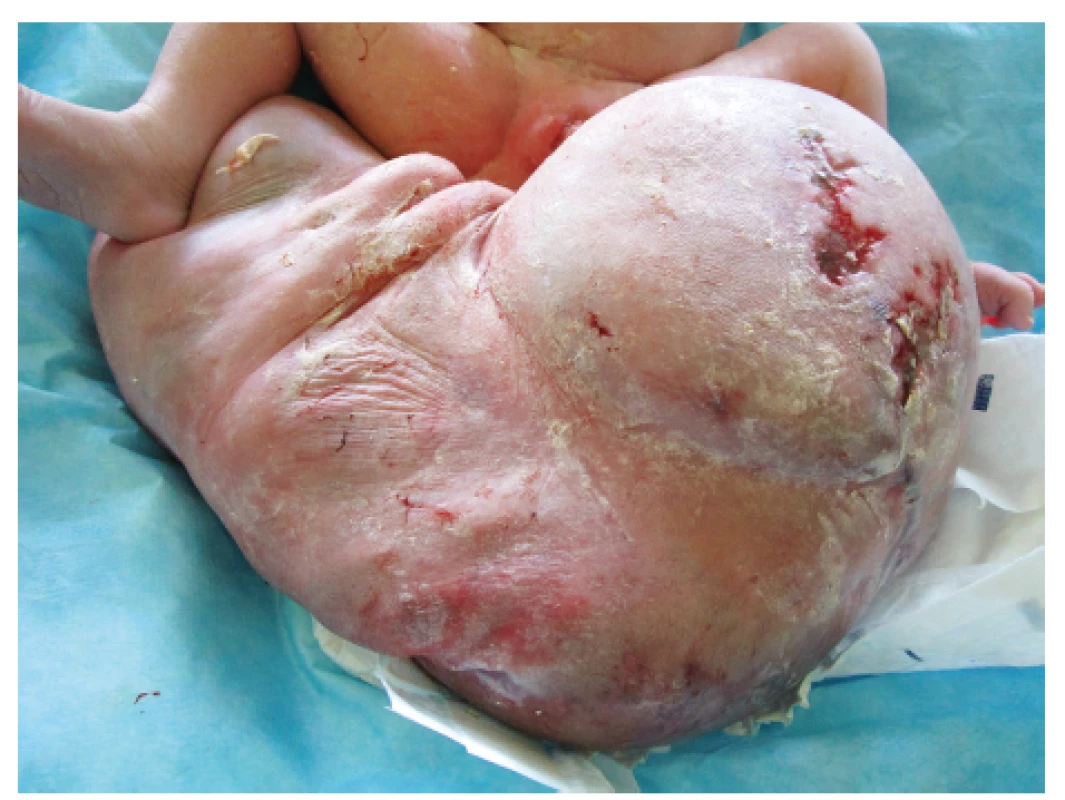
Při příjmu bylo děvče ventilačně i oběhově stabilní s přetrvávajícím únikem serózní tekutiny z útvaru (odhadem během desetiminutové cesty asi 200 ml). Po provedení nezbytných předoperačních odběrů a vyšetření, vč. UZ mozku a břicha, který potvrdil přítomnost podílu SCT v malé pánvi, bylo dítě operováno. Z podkovovitého řezu byl nádor exstirpován a byla provedena rekonstrukce svěračového komplexu. Tumor byl odeslán k histopatologickému vyšetření. Makroskopicky byl nádor o hmotnosti přibližně 2 700 g kryt kůží se známkami macerace a s exkoriacemi, na řezu byl patrný multicystický útvar s čirou a hemoragickou tekutinou. Histologicky byla potvrzena diagnóza SCT, výstelka cyst byla tvořena oploštělým epitelem, místy i cylindrickým s řasinkami až vzhledu tubulárního epitelu, přítomna byla také zralá chrupavčitá, kostní a neurogliální tkáň. Operační výkon proběhl bez komplikací (obr. 6), během operace byla podána mražená plazma a erytrocytární koncentrát, ke konci výkonu byla nutná podpora oběhu. Po operaci byla dívka dále na umělé plicní ventilaci a do třetího dne po operaci na farmakologické oběhové podpoře. Extubace pátý den byla neúspěšná s následnou obtížnou reintubací. Dívka byla úspěšně extubována až sedmý pooperační den po kúře kortikoidů a s následnou oxygenoterapií a inhalací adrenalinu pro laryngeální stridor. Třetí pooperační den byl zahájen enterální příjem nazogastrickou sondou, od pátého dne byla pacientka na plném enterálním příjmu a od osmého dne se začala krmit perorálně.
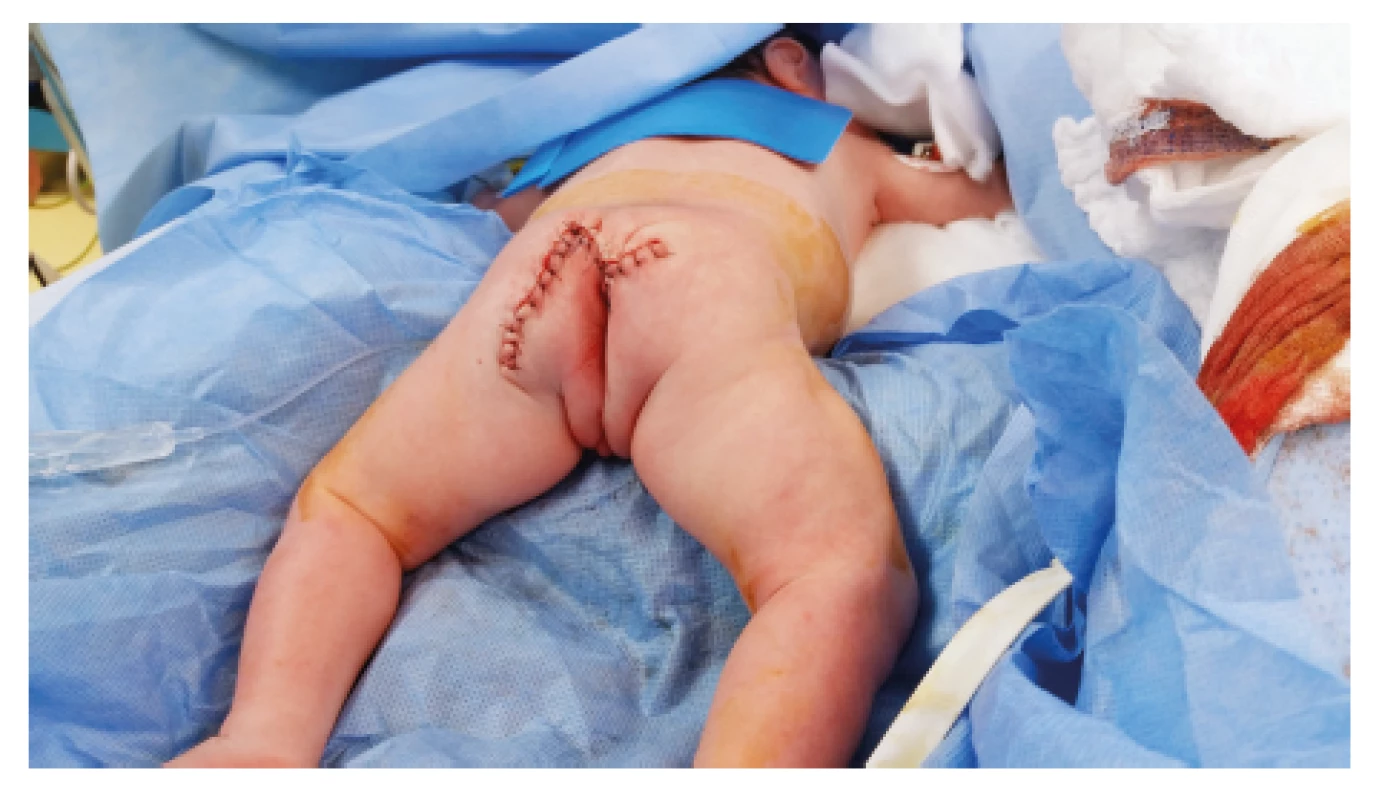
Hybnost dolních končetin byla po výkonu v normě. Pro výrazný neklid byla vyšetřena neurologem s natočením EEG a UZ vyšetřením centrální nervové soustavy, které byly bez patologického nálezu. Neurologické projevy postupně ustoupily. Stolice odcházela pravidelně v porcích. Po odstranění močové cévky dívka nemočila, opakované pokusy o spontánní mikci se nedařily, proto byla dívka indikována k založení epicystostomie, které proběhlo 13. den života. Během výkonu v celkové anestezii bylo doplněno ORL vyšetření s průkazem mírné subglotické stenózy vysvětlující obtížnou reintubaci. Kontrolní UZ uropoetického traktu a sakra byl proveden 15. den života s normálním nálezem, rezidua teratomu nebyla detekována. Pokusy s uzavíráním epicystostomie během hospitalizace nevedly ke spontánní mikci. Děvče bylo v celkově dobrém klinickém stavu propuštěno 18. pooperační den do domácí péče, při dimisi bylo plně kojeno.
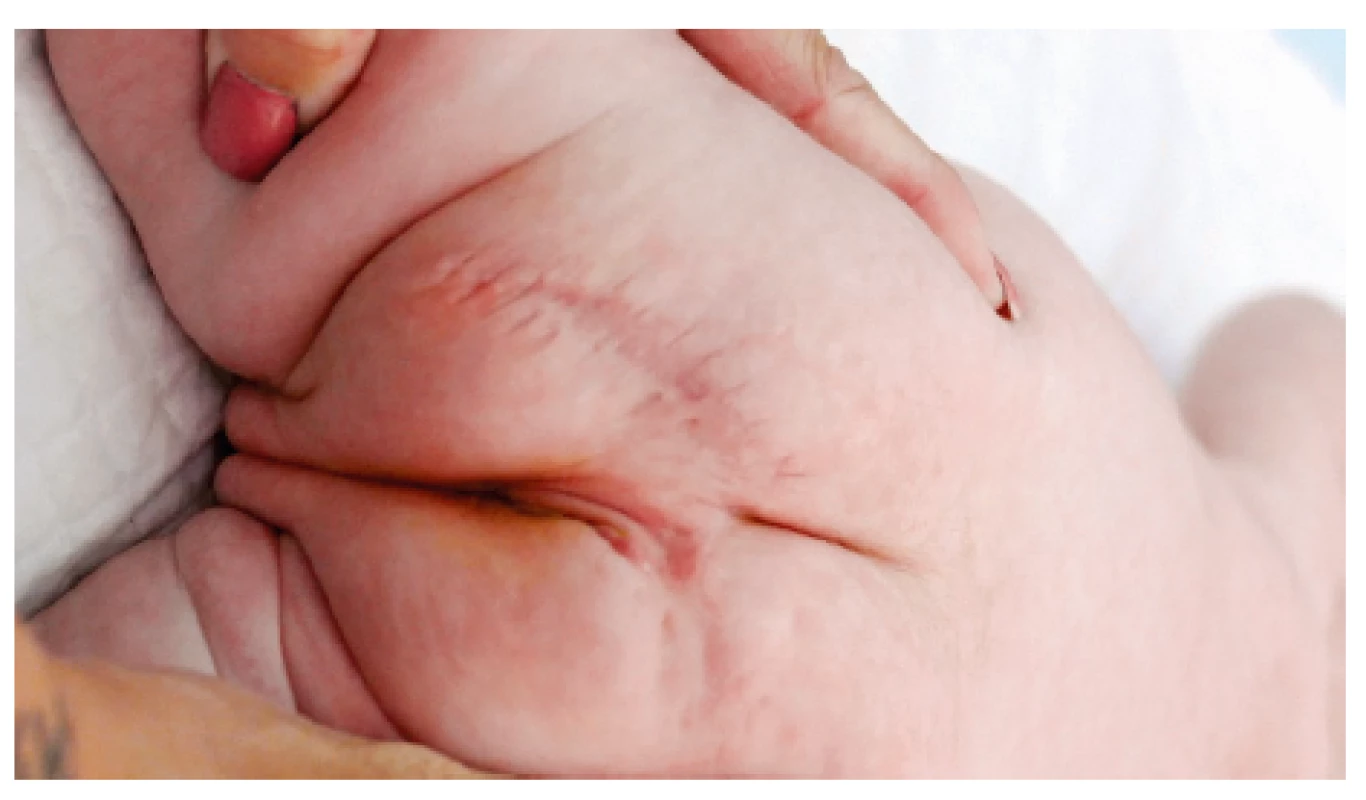
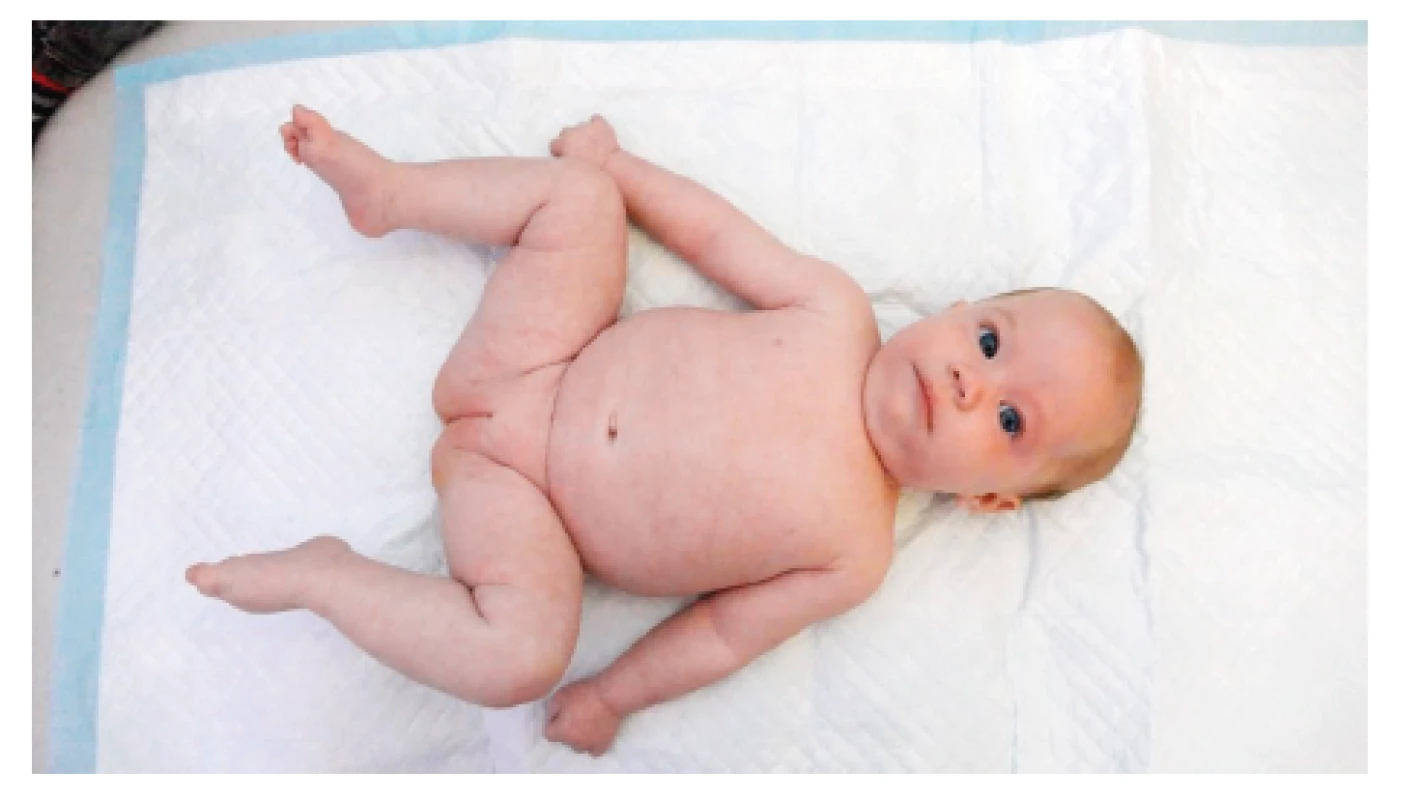
Dále je dívka sledována proktologem, urologem, neurologem a hematoonkologem ve FN v Motole. Krátce po dimisi se objevila hnisavá sekrece v okolí epicystostomie léčená lokálně, pro pozitivní kultivaci v moči byla nasazena antibiotika podle citlivosti a poté byla pacientka zajištěna profylaktickou dávkou antibiotika. Během prvních týdnů po propuštění začala postupně spontánně močit. Ve dvou měsících bylo kontrolní UZ vyšetření uropoetického traktu bez patologického nálezu a epicystostomie mohla být extrahována. Pro přechodnou obstipaci (udávána jedna stolice za 1–2 dny) byla zavedena režimová opatření, terapie laktulózou a intermitentně byla podávána klyzmata, postupně se pacientka začala vyprazdňovat bez potíží. Kontrolní UZ vyšetření malé pánve má pacientka opakovaně v normě a hodnoty α-fetoproteinu v širších mezích normy se sestupnou tendencí. Dívka prospívá, operační rána se zhojila bez komplikací (obr. 7 a 8). Do budoucna trvá riziko neurogenní dysfunkce močového měchýře, poruchy vyprazdňování stolice a poruchy hybnosti dolních končetin, pro které musí být dívka dlouhodobě sledována.
DISKUSE
Diagnostika SCT se provádí prenatálně UZ vyšetřením (nejčastěji jsou tumory nalezeny mezi 22. a 34. gestačním týdnem), bývá také sdružena s rozvojem polyhydramnia. Udává se, že tumory diagnostikované již prenatálně jsou asociovány s vyšší mortalitou, ale jejich včasná diagnostika snižuje riziko komplikací před porodem a v průběhu porodu [3, 7, 10]. K verifikaci, stanovení typu a zhodnocení vztahu teratomu k okolí se využívá magnetické rezonance. Horší prognóza se uvádí při rozvoji placentomegalie, kardiomegalie či neimunitního hydropsu plodu. Mechanismus vzniku těchto komplikací je dán zvýšenou vaskularizací některých SCT chovajících se jako obrovské arteriovenózní spojky, které navíc mimo zvýšeného cirkulujícího objemu krve zvyšují podíl odkysličené krve a způsobují přetížení plicních cév s následnou respirační insuficiencí [10]. V průběhu těhotenství se UZ vyšetřením pravidelně kontroluje velikost tumoru, vztah k okolí a přítomnost útlaku okolních struktur, vaskularizace a známky srdečního selhání. Postnatálně lze provést UZ, MRI či CT ke zhodnocení obsahu nádoru, přítomnosti kalcifikací či vztahu k okolním tkáním a RTG hrudníku k vyloučení přítomnosti metastáz v případě vzácnějšího maligního typu [3, 9].
Management porodu plodu se SCT závisí na gestačním týdnu, asociovaných malformacích, velikosti nádoru a jeho vaskularizaci. Porod by měl proběhnout v nemocnici III. typu se zázemím perinatologického centra a dětského chirurgického oddělení. Těhotenství s nádory většími než pět cm (některá literatura udává až 10 cm) by měly být plánovaně ukončeny císařským řezem [2, 5]. Během vaginálního porodu může dojít k ruptuře tumoru a následnému krvácení s rizikem rozvoje diseminované intravaskulární koagulapatie (uvolněním tromboplastinu a aktivací koagulační kaskády při krvácení) [9].
Při volbě přístupu do děložní dutiny je možno zvolit cervikokorporální řez, který výrazně zvětšuje otvor v děloze, tento typ řezu v anamnéze indikuje v dalších těhotenstvích porod císařským řezem.
Terapií SCT je jejich kompletní resekce včetně kostrče, u maligních teratomů i adjuvantní chemoterapie [7, 10, 11]. Mezi časné pooperační komplikace patří oběhová a ventilační nestabilita, hypotermie (velká kožní plocha nádoru a vaskularizace) a rovněž infekce operační rány. V novorozeneckém věku je většina SCT benigních (70–80 %) [1, 7, 10]. Při neúplném odstranění SCT může dojít k recidivě – ta se udává při nekompletním odstranění s kostrčí až 35 % [2, 7]. Pacienti jsou po operaci dlouhodobě sledováni [3]. V pravidelných šestiměsíčních kontrolách se provádí podrobné fyzikální vyšetření, stanovení tumor markeru (α-fetoproteinu) a zobrazovací vyšetření k vyloučení recidivy nádoru [2, 7]. Hodnoty α-fetoproteinu mohou být u pacientů po resekci SCT zvýšeny až do devátého měsíce věku [7]. Jeho přetrvávající vysoké hodnoty mohou svědčit pro přítomnost reziduální části tumoru, recidivu nebo maligní zvrat. Hodnoty se proto kontrolují až do pěti či více let věku [9].
Dlouhodobá prognóza pacientů po operaci je obvykle příznivá, mezi komplikace patří poruchy inervace dolních končetin, poruchy vyprazdňování stolice (až 50 %) nebo dysfunkce močového systému. Jsou popsány také poruchy spermatogeneze, dysfunkce Leydigových buněk či hypergonadotropní hypogonadismus související s kongenitálním defektem germinálních buněk. Tyto komplikace společně s rizikem recidivy nádoru mohou být limitujícími prognostickými faktory a vyžadují další terapii včetně chirurgického řešení [6, 7, 9].
Vysoké riziko neurologických poruch hybnosti, inkontinence a možnost malignizace by mělo vést k odeslání těhotné ženy čekající dítě s SCT ke konzultaci s odborníky řešícími tyto komplikace, aby se mohla rozhodnout o pokračování nebo přerušení těhotenství. Naše kazuistika ukazuje velmi dobrý funkční i kosmetický výsledek, přestože rozměr SCT byl monstrózní.
ZÁVĚR
Sakrokokcygeální teratom je nejčastější nádor v novorozeneckém věku vyskytující se častěji u dívek. Jedná se nejčastěji o I. typ podle Altmanovy klasifikace s převahou extrakorporální složky, v neonatálním období jsou tyto nádory většinou histologicky benigní (70–80 %). Prenatální diagnostika a pravidelné sledování plodu se SCT jsou důležité především k zabránění intrauterinních a peripartálních komplikací a k vytvoření poporodního managementu. Terapií je kompletní exstirpace nádoru. Pacienti jsou dlouhodobě sledováni podrobným fyzikálním a zobrazovacím vyšetřením včetně stanovení hladiny tumor markeru (α-fetoprotein). Prognóza pacientů se odvíjí od rozsahu resekce, při „en bloc“ resekci nádoru a kostrče je procento recidiv malé. Při zachování kostrče se popisuje až 35% recidiva s rizikem maligního zvratu nádoru. Možnost recidivy, poruchy kontinence moči a stolice, vznik neurogenního močového měchýře a poruchy hybnosti dolních končetin ovlivňují dlouhodobou prognózu a kvalitu života pacientů.
MUDr. Gabriela Mlčochová
Novorozenecké odd. s JIRP
Gynekologicko-porodnická klinika
2. LF UK a FN Motol
V Úvalu 84
150 00 Praha
e-mail: gabriela.mlcochova@fnmotol.cz
Zdroje
1. Ahmad, M., Arora, M., Ullah, E., et al. Neonatal sacrococcygeal teratoma with acute renal failure. Case Reports, 2013, doi: 10.1136/bcr-2013-009304.
2. Aktepe Keskin, E., Arikan Onaran, Y., Derbent, A., et al. Prenatal diagnosis and follow-up of giant sacrococcygeal teratoma. Taiwan J Obstet Gynecol, 2011, 50(2), p. 242–244.
3. Coleman, A., Shaaban, A., Keswani, S., et al. Sacrococcygeal teratoma growth rate predicts adverse outcomes. J Ped Surg, 2014, 49(6), p. 985–989.
4. Firszt, OP., Myga-Porosilo, J., Pośpieszny, K., et al. Radiological features of sacrococcygeal teratomas in fetal magnetic resonance imaging and computed tomography – a case report. Polish J Radiol, 2018, 83, p. 19–23.
5. Gross, SJ., Benzie, RJ., Sermer, M., et al. Sacrococcygeal teratoma: Prenatal diagnosis and management. AJOG, 1987, 156 (2), p. 393–396.
6. Hambraeus, M., Hagander, L., Stenström, P., et al. Long-Term Outcome of Sacrococcygeal Teratoma: A Controlled Cohort Study of Urinary Tract and Bowel Dysfunction and Predictors of Poor Outcome. J Pediatr, 2018, 198, p. 131–136.
7. Hussam, SH., Akram, ME. Sacrococcygeal teratoma: management and outcomes. Ann Ped Surg, 2014, 10, p. 72-77.
8. Krška, Z., Hoskovec, D., Petruželka, L. Chirurgická onkologie. Praha: Grada, 2014.
9. Tuladhar, R., Patole, SK., Whitehall, JS. Sacrococcygeal teratoma in the perinatal period. Postgrad Med J, 2000, 76, p. 754–759.
10. Yoon, HM., Byeon, S., Hwang, JY., et al. Sacrococcygeal teratomas in newborns: a comprehensive review for the radiologists. Acta Radiol, 2017, 59(2), p. 236–246.
11. Gebb, JS., Khalek, N., Qamar, H., et al. High tumor volume to fetal weight ratio is associated with worse fetal outcomes and increased maternal risk in fetuses with sacrococcygeal teratoma. Fetal Diagn Ther, 2018. doi: 10.1159/000486782.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2019 Číslo 2
-
Všechny články tohoto čísla
- Sakrospinální fixace sec. Miyazaki – komplikace a dlouhodobé výsledky
- Pilotní studie srovnávající snášenlivost transperineálního a endoanálního ultrazvukového vyšetření svěrače konečníku
- Je korelace mezi hodnotami maximálního uzavíracího uretrálního tlaku a sestupem uretry?
- Ruptura dělohy v těhotenství a při porodu: rizikové faktory, příznaky a perinatální výsledky – retrospektivní analýza
- Materská morbidita a mortalita v Slovenskej republike v rokoch 2007–2015
- Sakrokokcygeální teratom
- Embolická příhoda v šestinedělí s tragickým koncem
- Gynekologické a urologické aspekty pánevních vaskulitid
- Nejnovější poznatky o placentě z pohledu imunologie, tolerance a mezenchymálních kmenových buněk
- Bisfenoly v patologii reprodukce
- Korelace mezi integrací genomu vysoce rizikových HPV do lidské DNA detekované molekulárním combingem a závažností cervikální léze: první výsledky EXPL-HPV-002 studie
- Porodnické vaginální extrakční operace a jejich vliv na traumatismus matky a dítěte – prospektivní studie
- Střednědobé výsledky chirurgické léčby recidivující cystokély po hysterektomii s využitím transvaginálního implantátu
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Ruptura dělohy v těhotenství a při porodu: rizikové faktory, příznaky a perinatální výsledky – retrospektivní analýza
- Sakrokokcygeální teratom
- Porodnické vaginální extrakční operace a jejich vliv na traumatismus matky a dítěte – prospektivní studie
- Nejnovější poznatky o placentě z pohledu imunologie, tolerance a mezenchymálních kmenových buněk
