Kryokonzervace ovariální tkáně jako metoda pro zachování fertility u žen
Cryopreservation of ovarian tissue as a method for fertility preservation in women
Objective: To summarize the current possibilities of ovarian tissue cryopreservation as one of the other possible methods for fertility preservation in women. Methods: Literature review obtained from studies and literature related to ovarian tissue cryopreservation. Conclusion: Cryopreservation of ovarian tissue and its subsequent transplantation has a significant potential for preserving fertility not only for prepubertal and oncological patients, but also for patients with various medical indications leading to premature ovarian insufficiency. In order to maintain the best possible quality of oocytes in cryopreserved ovarian tissue, it is necessary to constantly optimize, standardize and compare both cryopreservation protocols, procedures and strategies, as well as the process of thawing ovarian tissue with its subsequent transplantation.
Keywords:
assisted reproduction – In vitro fertilization – oncofertility – vitrification – fertility preservation – cryopreservation of ovarian tissue – slow freezing – in vitro maturation
Autoři:
Veronika Hončová
Působiště autorů:
Porodnicko-gynekologická klinika LF UP a FN Olomouc
Vyšlo v časopise:
Ceska Gynekol 2023; 88(1): 44-51
Kategorie:
Přehledový článek
doi:
https://doi.org/10.48095/cccg202344
Souhrn
Cíl: Shrnout aktuální možnosti kryokonzervace ovariální tkáně jako jednu z dalších možných metod pro zachování plodnosti u žen. Metodika: Literární přehled získaný ze studií a prací týkajících se kryokonzervace ovariální tkáně. Závěr: Kryokonzervace ovariální tkáně a její následná transplantace má významný potenciál pro zachování plodnosti nejen pro prepubertální a onkologické pacientky, ale také pro pacientky s různými zdravotními indikacemi vedoucími k předčasné ovariální insuficienci. Pro zachování co nejlepší kvality oocytů v kryokonzervované ovariální tkáni je nezbytné neustále optimalizovat, standardizovat a porovnávat jak kryokonzervační protokoly, postupy a strategie, tak i proces rozmražení ovariální tkáně s její následnou transplantací.
Klíčová slova:
asistovaná reprodukce – in vitro fertilizace – onkofertilita – vitrifikace – zachování fertility – kryokonzervace ovariální tkáně – pomalé mražení – in vitro maturace
Úvod
Fertilita žen může být v průběhu života ovlivněna různými faktory:
- věkem;
- onkologickými, metabolickými, autoimunitními nebo genetickými onemocněními;
- poškozením či chirurgickým zásahem do reprodukčních orgánů.
V důsledku těchto stavů může u žen dojít k rozvoji předčasné ovariální insuficience (POI – primary ovarian insufficiency). Pokud se u pacientek vyskytne riziko vzniku neplodnosti, měly by jim být včas sděleny dostupné možnosti zachování jejich plodnosti. Pro zachování fertility žen je možné kryokonzervovat oocyty či embrya. Metoda vyžaduje dostatečný čas na kontrolovanou stimulaci vaječníků a následný odběr oocytů. Navíc je při stimulaci získán pouze omezený počet oocytů či embryí z jednoho daného cyklu [1,2]. Tyto metody kryokonzervace mají limity pro prepubertální dívky, kde je ovariální stimulace vyloučena, či u žen, u nichž je nutné okamžité zahájení onkologické léčby, a jedinou možností zachování plodnosti je tak kryokonzervace ovariální tkáně (OTC – ovarian tissue cryopreservation) s její následnou autotransplantací [3,4]. Hlavním rozdílem mezi kryokonzervací oocytů a embryí je, že metodou OTC lze uchovat několik tisíc nezralých oocytů současně. Tím se zvýší nejen počet zachovaných oocytů, ale také nedochází k oddálení terapeutické léčby a také není potřeba stimulace vaječníků [5]. OTC je metoda, která není závislá na menstruačním cyklu a nevyžaduje partnera či dárce spermatu [2].
Indikace ke kryokonzervaci ovariální tkáně
Kryokonzervace ovariální tkáně je metoda nejen pro zachování reprodukčního potenciálu, ale i pro zachování endokrinní funkce. Kryokonzervace a následná autotransplantace je jednou z možných metod zachování plodnosti u prepubertálních dívek a žen s vysokým rizikem rozvoje POI [6]. OTC zachovává ovariální struktury a fyziologii a může být prospěšná i pro pacientky s různými zdravotními indikacemi. Primordiální folikuly se nacházejí pod povrchem ovarií v kortikální oblasti, která obsahuje v daném okamžiku každé ženy více než 90 % přítomných folikulů. Tím se vysvětluje, proč je rozmražená ovariální tkáň schopna obnovit ovariální funkci a mít potenciál se vyvinout z primordiálního folikulu do preovulačního stadia [7].
Maligní onemocnění
Hlavní indikací k OTC je zachování fertility u pacientek s onkologickým onemocněním, jako jsou hematologické malignity (Hodgkinův lymfom, non-Hodgkinův lymfom, leukemie), karcinom prsu, sarkom a další karcinomy v oblasti pánve [4,6,8]. U pacientek s ranými stadii rakoviny je kryokonzervace ovariální tkáně relativně bezpečná, kdežto u pacientek s leukemiemi je riziko, že ovariální tkáň může obsahovat maligní buňky, pokud by pacientka v dané době nebyla v plné remisi [9]. Díky včasné diagnostice a zvyšující se úspěšnosti léčby se u onkologických pacientek zvyšuje i interval přežití. Dostupné přístupy léčby rakoviny, jako jsou chemoterapie nebo radioterapie, zajistí remisi onemocnění a prodlouží očekávanou délku života, avšak riziko této léčby je především významné pro ovlivnění plodnosti ženy. Ztráta plodnosti je pro ženu traumatizující [7,10]. Gonadotoxicita chemoterapie, radioterapie, operace nebo kombinace této léčby mohou vést k POI. Ovaria jsou velmi citlivá především na alkylační cytotoxická léčiva, která jsou obecně klasifikována jako vysoce riziková a mohou způsobovat dysfunkci gonád. Alkylační činidlo, konkrétně cyklofosfamid, nejvíce poškozuje oocyty a granulózní buňky, a to v závislosti na dávce. Dalším významným rizikem poškození pro oocyt je pak radioterapie [4,8]. Lidské oocyty jsou velmi citlivé na záření, kdy se dávka menší než 2 Gy odhaduje jako dostačující k poškození až 50 % primordiálních folikulů a expozice záření 5–10 Gy je pro oocyty již toxická [8,11]. Poškození fertility závisí na typu onemocnění, věku pacientky a typu léčby. S chemoterapeutickou léčbou je často spojen také vznik sekundárních nádorů [12].
Benigní onemocnění
Kryokonzervace ovariální tkáně je vhodná i pro ženy s benigními onemocněními, které mohou vést k POI. Mezi tato onemocnění řadíme benigní hematologická onemocnění (aplastická anemie, srpkovitá anemie, thalassemia major), dále také autoimunitní onemocnění (autoimunitní trombocytopenie, systémový lupus erythematodes), recidivující ovariální endometriózu, recidivující ovariální mucinózní cysty, torze vaječníků a genetická onemocnění [4,6,8,13]. Další z indikací je pak také Turnerův syndrom, galaktosemie či POI v rodinné anamnéze, kdy u těchto skupin žen transplantace ovariální tkáně zajistí funkci reprodukční a endokrinní [8,14].
Osobní/sociálních důvody
Odkládáním mateřství z různých důvodů (kariéra, vzdělání, finanční nestabilita či absence partnera) dochází ke snižování nejen kvality oocytů, ale také množství folikulů. OTC se nabízí jako možná alternativa k vitrifikaci oocytů. Vitrifikace oocytů je u těchto žen nejčastěji využívána k zachování plodnosti, avšak v době vitrifikace oocytů je nyní průměrný věk pacientek 37 let, což z hlediska stárnutí reprodukčních buněk není optimální, a snižuje se tak úspěšnost na pozdější otěhotnění [15]. Navíc kryokonzervace oocytů jsou vzhledem k vysokému obsahu vody v buňce velmi náchylné ke kryopoškození oproti kryokonzervaci embryí, kde jsou minimální dopady kryopoškození na embryo, a to z důvodu zavedené techniky a protokolu kryokonzervace [16]. Dále také zralé oocyty (metafáze II) jsou mnohem náchylnější ke kryopoškození než primordiální folikuly, a to pravděpodobně z důvodu jejich menší velikosti, absence zony pellucidy, pomalejší metabolické aktivitě a také chromozomálnímu uspořádání [5,16]. Proto se pak nabízí možnost OTC a její následná transplantace. Výhodou OTC oproti vitrifikaci oocytů je vyšší pravděpodobnost spontánního otěhotnění bez nutnosti využití metod asistované reprodukce. Dalším benefitem je to, že pokud by žena ovariální tkáň nevyužila pro zachování plodnosti, mohla by být transplantována za účelem oddálení menopauzy namísto využití hormonální substituční terapie (HRT – hormon replacement therapy). Pro obě metody je nejdůležitějším faktorem nejen věk pacientky, ale i ovariální rezerva [15].
Kryokonzervace ovariální tkáně jako hormonální substituční terapie
Kryokonzervace ovariální tkáně se v dnešní době nabízí jako řešení pro oddálení nástupu menopauzy. Celkové zvýšení průměrné délky života se kombinuje s nárůstem počtu žen v menopauze. Menopauza u žen, která je způsobena zástavou produkce steroidních hormonů, se spojuje s nežádoucími účinky, jako je osteoporóza, ateroskleróza, kardiovaskulární nemoci, pokles kognitivních funkcí, dřívější úmrtí, obezita, deprese, demence či sexuální dysfunkce [7,15]. OTC za účelem oddálení menopauzy by se mohla provádět u žen podstupujících operaci v pánevní oblasti, jako je císařský řez či apendektomie, kdy by mohla být odebrána část ovariální tkáně za účelem pozdější transplantace pro toto využití, avšak dosud nejsou studie, které by popisovaly odběr ovariální tkáně za tímto účelem. Rozmražená kortikální tkáň a její následná transplantace obnovuje přirozenou hormonální a endokrinní funkci ovarií, které se prokázaly vzestupem estradiolu, poklesem folikulostimulačního hormonu (FSH) a luteinizačního hormonu (LH) po 4–5 měsících po transplantaci. Po této době došlo k obnovení menstruačního cyklu a ústupu menopauzálních příznaků u velké většiny žen, které podstoupily transplantaci. Průměrná doba trvání funkce štěpu kortikální tkáně ovarií je 5 let, kdy funkce může přetrvat déle než 9 let, což závisí na hustotě a kvalitě folikulů, době odběru štěpu a následném zamražení [2]. Transplantaci ovariální tkáně lze provádět opakovaně, pokud má daná pacientka dostatečné množství zamražených štěpů ovariální tkáně, čímž se prodlouží ovariální endokrinní aktivita. Pokud je preferována pouze produkce hormonů, je upřednostňována transplantace heterotopická, kdy je štěp vložen do břišní stěny či podkoží, což vyžaduje méně invazivní výkon bez nutnosti celkové anestezie a laparoskopie [7,15].
Provedení odběru ovariální tkáně
Odběr ovariální tkáně a její následná kryokonzervace vyžaduje dva chirurgické zákroky, kdy první z nich je odběr samotné ovariální tkáně a druhý je následně její transplantace. Odběr ovariální tkáně by se měl provádět vždy před chemoterapeutickou léčbou z důvodu gonadotoxického vlivu na primordiální folikuly [2,4]. Primordiální folikuly se nacházejí těsně pod povrchem ovaria v kortikální oblasti. Při transplantaci tkáně u pacientek, u nichž byla zahájena chemoterapeutická léčba před odběrem, je snížená doba trvání aktivity ovariálního štěpu oproti pacientkám, které léčbu nezahájily. Odběr se provádí operací, kdy se odebere část kortikální tkáně či se odstraní jeden celý vaječník místo biopsie tkáně obou ovarií. Jeden vaječník tvoří polovinu ovariální rezervy a velikost zásoby kortikální tkáně pak odráží úspěšnost při hojení reimplantované tkáně a následné obnovení hormonální aktivity [14]. Při odběru ovariální tkáně se odebere 4–5 kusů kortikální části o velikosti 10 × 5 × 1 mm. Tloušťka štěpu je velice důležitá z důvodu přítomnosti folikulů, kdy se primordiální folikuly nacházejí 0,8 mm od mezotelu, proto je doporučená tloušťka štěpu 1–1,5 mm. Kritéria pro OTC je věk pacientky do 35 let, vysoké riziko POI, přežití pacientky > 5 let, žádná předchozí gonadotoxická léčba a nepřítomnost maligních buněk v ovariální tkáni. Dalším důležitým faktorem pro kryokonzervaci ovariální tkáně je ischemie štěpu, což může vést k poškození velkého množství folikulů, a tím ke zkrácení funkčnosti štěpu [2].
Odběr nezralých oocytů během přípravy ovariální tkáně
Před zpracováním ovariální tkáně, pokud se jedná o celé ovarium, lze provést také aspiraci folikulů. Nejprve se provede kontrola, zda jsou na povrchu ovaria patrné viditelné antrální folikuly (obr. 1). Pokud jsou folikuly přítomny, aspiruje se folikulární tekutina z každého folikulu do vyhřátého média při 37 °C a prohlédne se mikroskopicky (obr. 2). Nezralé oocyty se mohou nacházet také v médiu při zpracování ovariální tkáně či z přebytečné medulární části ovaria. Pokud jsou oocyty nalezeny, může se provést in vitro maturace (IVM). Míra úspěšnosti IVM závisí na věku pacientky. Dle studií se ukázalo, že míra úspěšné IVM je významně nižší u prepubertálních pacientek oproti těm post-prepubertálních [17]. Po získání oocytů (metafáze II) po IVM se tyto oocyty mohou vitrifikovat či oplozovat. Z důvodu transportu tkáně a vystavení tkáně nízkým teplotám může být snížená následná míra zrání oocytů. Dle literatury je vývoj embrya do stadia blastocysty z oocytů po IVM získaných aspirací z ovariální tkáně velmi vzácný. Oocyty takto získané a následně maturované vykazují dobrou morfologickou strukturu, avšak následná fertilizace a embryologický vývoj je často narušen. Dle studií bylo dosud nahlášeno pět živě narozených dětí pomocí této metody [18]. Tuto metodu řadíme jako doplňkovou pro zachování plodnosti pacientek z důvodu zatím ne příliš efektivního výsledku IVM takto získaných a následně maturovaných oocytů [17,19].
Fig. 1. Aspiration of oocytes from antral
follicles from the ovarian surface.
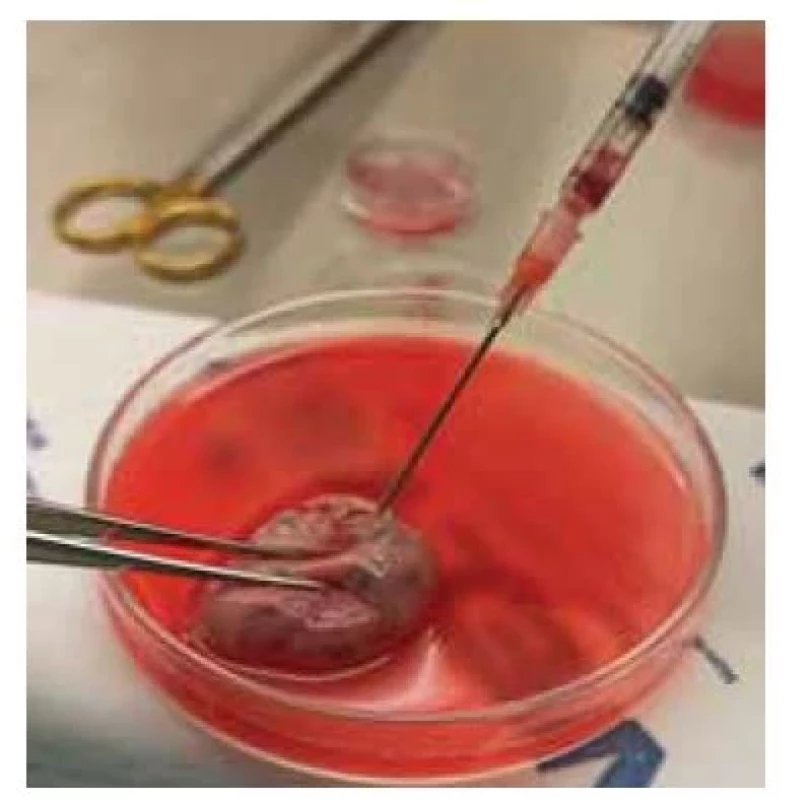
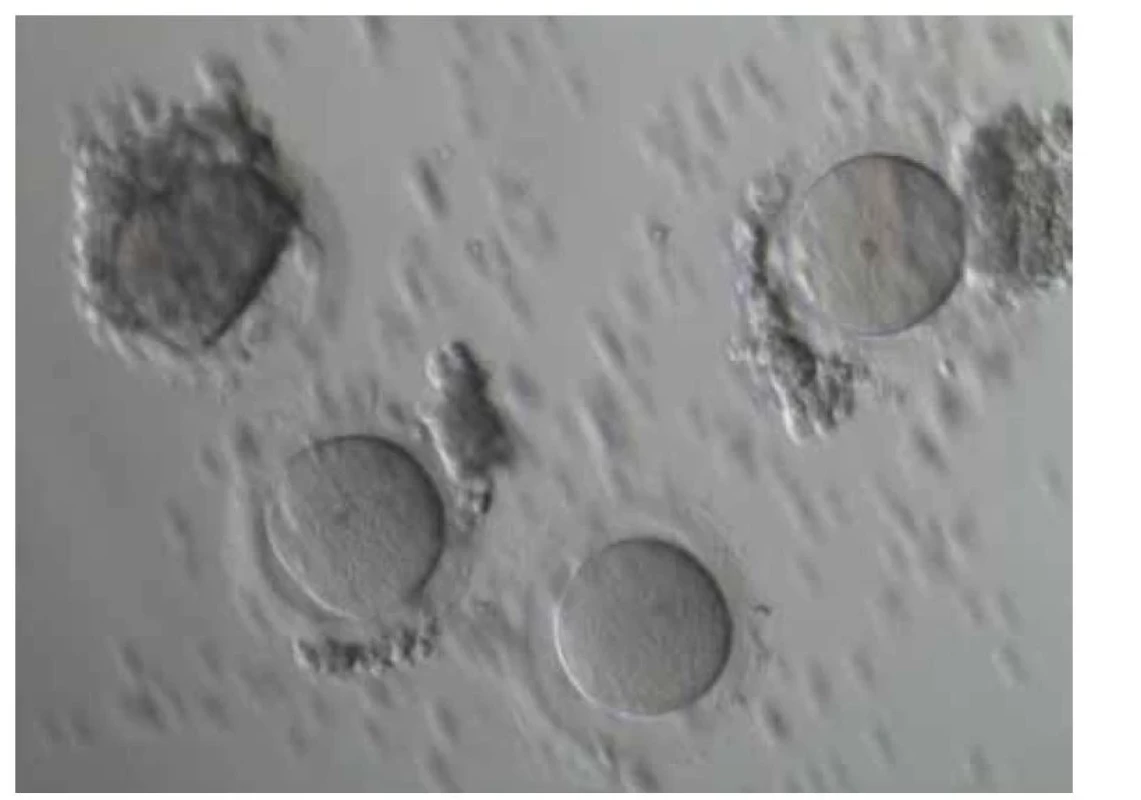
Fig. 2. Microscopically found oocytes after aspiration of antral follicles from the
ovarian cortex.
Zpracování ovariální tkáně
Ovariální tkáň by měla být před zpracováním transportována ve předem připraveném médiu při teplotě (0–5 °C) ve studeném izolovaném obalu. Následné zpracování tkáně by mělo proběhnout do 1 hod od odebrání tkáně (obr. 3). Veškerá manipulace tkáně by měla být prováděna ve sterilním prostředí pomocí sterilních pomůcek a techniky. Pomocí tupé disekce se oddělí tkáňové roviny a odstraní kortikální tkáň z dřeně vaječníku (obr. 4). Kortikální tkáň by měla být seškrábnutá a zbavena jakýchkoli tukových nebo medulárních tkání (obr. 5) a nakrájena na plochý plát (obr. 6). Kortikální tkáň by měla být nařezána na proužky o přibližných rozměrech 2,0 × 0,5 cm a tloušťce 1 mm a poté důkladně opláchnuta v zadržovacím médiu (obr. 7). Po zpracování je nutné spočítat počet kusů proužků kortikální tkáně a následně je rozdělit do zkumavek a přidat kryoprotektivum vhodné pro kryokonzervaci ovariální tkáně (obr. 8). Následně se zvolí vhodný mrazicí program.
Fig. 3. Ovary.
Fig. 4. Bisected ovary with antral follicles
in the medulla.
Fig. 5. Removal of the medullary portion
from the ovary.

Fig. 6. Cortical tissue after removal of
the medulla.
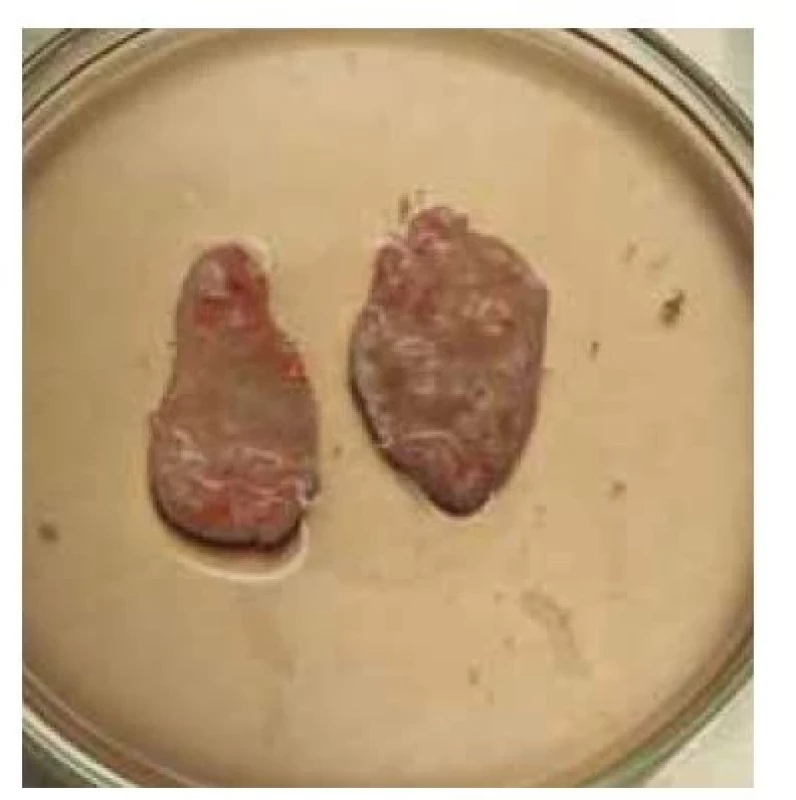
Fig. 7. Strips of cortical tissue prepared
for cryopreservation.
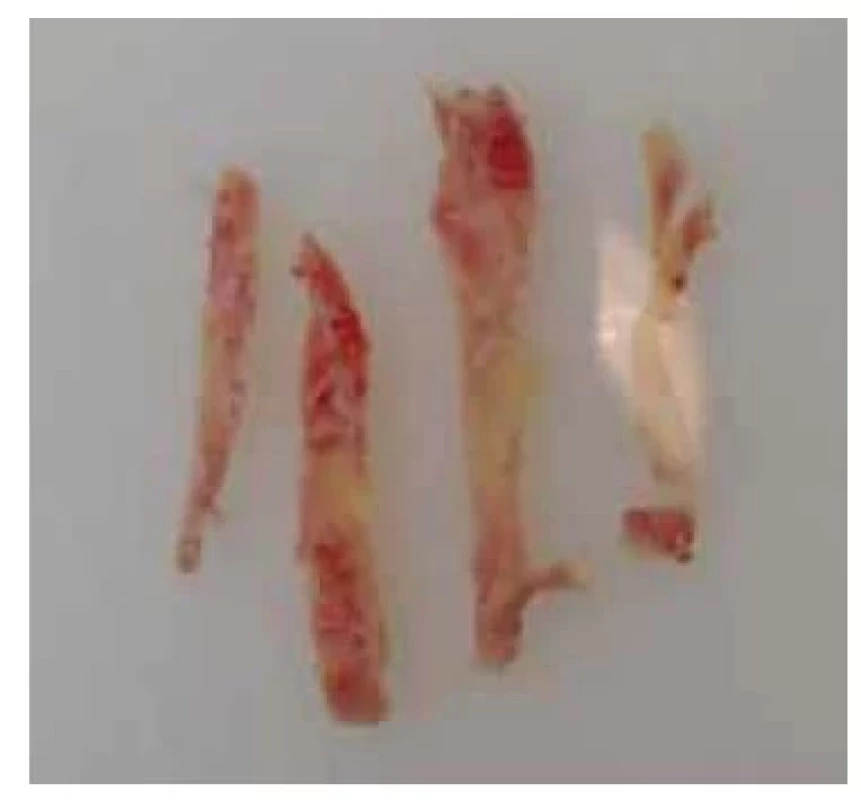
Fig. 8. Strips of cortical tissue during
the cryopreservation process.

Metody kryokonzervace ovariální tkáně
Pro kryokonzervaci ovariální tkáně jsou známy dva způsoby metod zamražení. Jednou z nich je konvenční zamražení – pomalé zamražení ovariální tkáně – a druhou je vitrifikace. Pomalé zamražení se od vitrifikace liší koncentrací kryoprotektiv a rychlostí ochlazování [7,18,20]. V dnešní době je pro kryokonzervaci upřednostňována metoda pomalého mražení, avšak vitrifikace se jeví jako jedna z dalších metod pro zamražení ovariální tkáně [2].
Konvenční zamražení (pomalé zamražení)
Tento způsob zamražení je používán nejčastěji ke kryokonzervaci ovariální tkáně, a to z důvodu zavedeného mrazicího protokolu a prokázané obnovené endokrinní aktivitě. Od roku 2017 je dosud narozených > 130 narozených dětí po celém světě po rozmražení a transplantaci tkáně touto metodou [21]. Principem tohoto zamražení je vystavení tkáně nízkým koncentracím kryoprotektiv a jeho následné pomalé ochlazování dle zvoleného mrazicího programu. Při procesu pomalého zamražení se krystaly ledu tvoří nejprve mimo buňky či tkáň. Při tuhnutí vody dochází k tomu, že se vnější prostředí stává hypertonickým. Rychlé ochlazení brání intracelulární vodě opustit buňky, což způsobí tvorbu ledových krystalů uvnitř buněk a jejich následné poškození. Naopak při pomalé rychlosti ochlazení dochází k osmotickým změnám mezi intracelulární a extracelulární tekutinou, a ty pak mohou vést k nadměrné dehydrataci a smrštění buněk [7]. Pro zamražení buněk se tak využívají kryoprotektiva, která buňky chrání před poškozením ledovými krystaly a hypertonicitou během kryokonzervace. Kryokonzervační médium obsahuje kryoproktektivní činidla, která mají osmotické účinky na buňky během procesu zamražení. Při postupu kryoprotektivního činidla dojde k dehydrataci a smrštění a poté následuje návrat do původního objemu. Aby nedošlo k poškození buněk těmito změnami, měla by být expozice těmito látkami optimálně dodržena z důvodu dostatečné permeace a dehydratace pro dosažení ochrany před mrazem. Kryoprotektivní činidla se dělí na permeační a na nepermeační. Pro protokol pomalého zamražení ovariální tkáně se používá kombinace obou těchto činidel (tab. 1). U pomalého zamražení ovariální tkáně je permeace velmi důležitá z toho důvodu, že vzorky tkáně obsahují velký počet různých typů buněk a extracelulárního matrixu a kryoprotektivní činidla by měla prostupovat do oblastí vnitřních tkání. Ovariální tkáň se zpracovává na velmi tenké proužky z důvodu snazšího prostupu kryoprotektivních látek do buněk. Tím dochází ke snížení toxických účinků na buňky způsobené nízkomolekulárními organickými sloučeninami, které jsou základem kryoprotektivních látek [7,21].
Tab. 1. Distribution of cryoprotectants [18].
![Rozdělení kryoprotektivních činidel [18].<br>
Tab. 1. Distribution of cryoprotectants [18].](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image_pdf/7909881b1ce90865a477270780c5d4f2.jpg)
Vitrifikace
Vitrifikace ovariální tkáně je zatím méně využívaná metoda pro kryokonzervaci, kdy dosud byly zaznamenány pouze dvě živě narozené děti ve světě pomoci této techniky [7,13]. Vitrifikace je metoda, kdy dochází k přeměně studené kapaliny na pevnou amorfní látku podobnou sklu, která zabrání tvorbě ledových krystalů. Proces vitrifikace je kombinace ultrarychlé rychlosti chlazení s vysokou koncentrací kryoprotektivních činidel. Využívá se kombinace dvou a více kryoprotektivních činidel, takže součet jejich koncentrací podporuje vitrifikaci a nízká koncentrace činidla naopak snižuje jejich toxicitu pro buňky. Důležitý faktor, který ovlivňuje vitrifikaci, je objem daného vzorku. Čím je vzorek menší, tím méně kapaliny je třeba chladit, a tím je nižší pravděpodobnost tvorby ledových krystalů. Vitrifikace je metoda rychlá, snadná a nevyžadující speciální a drahé vybavení pro její použití, avšak pokud metoda není provedena dostatečně rychle, může dojít k vytvoření krystalu [22]. Pokud je vitrifikace úspěšná, jsou tkáň a roztok průhledné. Jestliže však dojde k tomu, že je vzorek bílý, znamená to, že se vytvořily ledové krystaly a došlo k poškození buněk. Vitrifikace je velmi oblíbená u kryokonzervace embryí, avšak v dnešní době zatím neexistuje standardní vitrifikační protokol pro ovariální tkáň, proto se pro kryokonzervaci ovariální tkáně používá zřídkakdy [7].
Rozmražení ovariální tkáně
Rozmražení ovariální tkáně se provádí na základě toho, kterou metodou byla tkáň zamražena. Dle zvoleného mrazicí postupu a média se zvolí proces rozmražení.
Typy transplantací
Autotransplantace kortikální ovariální tkáně je buď ortotopická do pánevního místa nebo do zbývajícího ovaria, nebo heterotopická, což je do extrapelvického subkutánního místa, jako je předloktí nebo břišní stěna [17,20]. Dle literatury dosud vedla ortotopická transplantace ke všem živě narozeným dětem, u heterotopické transplantace vzniklo pouze jedno embryo [23]. Pokud je cílem transplantace dosažení gravidity, měla by se volit ortotopická transplantace, pokud je cílem obnovit přirozenou hormonální aktivitu, pak je vhodné využít heterotopickou transplantaci [24]. Transplantace ovariální tkáně by se měla provádět vždy po domluvě s klinickým onkologem. Pro transplantaci je důležitá remise nádorového onemocnění a dobrý zdravotní stav pacientky [12].
Ortotopická transplantace
U ortotopické transplantace se transplantují 3–6 kusy proužků kortikální ovariální tkáně o velikosti 1,0–1,5 mm do obnažené medulární části zbývajícího ovaria či do předem připravené peritoneální duplikatury v ligamentum latum uteri a zároveň do hormonálně inaktivního ovaria. Jsou vytvořeny dvě peritoneální kapsy v pravém a levém širokém vazu [12,20]. Pokud je u pacientky zachováno alespoň jedno ovarium, provede se nejprve dekortikace ovaria, kdy se odstraní kus kortexu k získání přístupu k medule a jejímu cévnímu zásobení. Poté se kortikální rozmražená tkáň umístí ke dřeni a zafixuje. V případě absence obou ovarií se provede peritoneální okno v oblasti vazu, kde je viditelná cévní síť. Do tohoto místa se umístí proužky rozmražené kortikální tkáně. Další možností je pak při zachování obou ovarií u pacientky transplantovat tkáň na dvě ortotopická místa zároveň, v případě dostatku ovariální tkáně na obnažené ovarium nebo do peritoneálního okna. U tohoto typu transplantace je důležité posoudit dostatečné množství tkáně pro transplantaci a předvídat potřebu tkáně pro další využití. Doporučeno je rozmrazit třetinu kryokonzervované tkáně pacientky [13]. Odběr ovariální tkáně se provádí nejčastěji laparoskopicky z důvodu minimálního zatížení organizmu pacientky a kratší délky hospitalizace po zákroku [25]. Největší výhodou ortotopické transplantace je možnost spontánního otěhotnění z důvodu těsné blízkosti tkáně ovarií u vejcovodů a vhodných podmínek pro vývoj folikulů, pokud nebyla poškozena děloha a vejcovody. V jiných případech je nutné využít metod asistované reprodukce [20].
Heterotopická transplantace
Heterotopická transplantace je prováděna do lépe přístupné části těla, jako jsou předloktí, břišní či hrudní stěna. Výhodou tohoto typu transplantace je umístění štěpu na místo, kde je velmi snadné monitorovat růst folikulů a oocytů pro další využití v in vitro fertilizaci a dále monitorovat recidivu daného onkologického onemocnění. Nevýhodou této transplantace je snížená funkčnost štěpu z důvodu, že heterotopická místa jsou více náchylná k neovaskularizaci. Nevýhodou je také nemožnost spontánního otěhotnění a je vždy vyžadováno využít metod asistované reprodukce (obr. 9) [20].
A) Prepubertálním pacientkám či pacientkám vyžadující okamžitou chemoterapii se odebere ovariální tkáň, která je následně
zpracována a zamražena pomoci techniky konvenčního pomalého zamražení. Pokud není riziko přenosu maligních
buněk, lze ovariální tkáň zpět pacientce transplantovat buď ortotopicky, dle toho, zda má pacientka alespoň jeden vaječník,
nebo heterotopicky do speciálně vytvořeného peritoneální místa. Pokud je riziko přenosu maligních buněk, jsou izolovány
primordiální folikuly a následně jsou oocyty in vitro maturace maturovány k zisku zralých oocytů (metafáze II), které lze pak
fertilizovat. Vzniklá embrya pak můžeme transferovat do dělohy ženy či vitrifikovat.
B) Postprepubertální pacientky a pacientky s benigními onemocněními, které mohou oddálit chemoterapií přibližně
o 2 týdny, lze pacientku stimulovat, zralé oocyty vitrifikovat a po rozmražení oocyty fertilizovat.
Techniky v případech A a B lze také kombinovat.
Fig. 9. Fertility preservation options [5].
A) Ovarian tissue is taken from prepubertal patients or patients requiring immediate chemotherapy, which is subsequently
processed and then frozen using the conventional slow freezing technique. If there is no risk of malignant cell transmission, the
ovarian tissue can be transplanted back into the patient either orthotopically, depending on whether the patient has at least one
ovary, or heterotopically – into a specially created peritoneal site. If there is a risk of malignant cell transfer, the primordial follicles
are isolated and then the in vitro maturation oocytes are matured to yield mature oocytes that can be immediately fertilized or vitrified, or the resulting embryos transferred or vitrified.
B) Post-pubertal patients and patients with benign diseases that can delay chemotherapy by approximately 2 weeks, the patient
can be instilled and the mature oocytes vitrified and then fertilized after thawing.
The techniques in cases A and B can also be combined.
![Možnosti zachování plodnosti [5].<br>
A) Prepubertálním pacientkám či pacientkám vyžadující okamžitou chemoterapii se odebere ovariální tkáň, která je následně
zpracována a zamražena pomoci techniky konvenčního pomalého zamražení. Pokud není riziko přenosu maligních
buněk, lze ovariální tkáň zpět pacientce transplantovat buď ortotopicky, dle toho, zda má pacientka alespoň jeden vaječník,
nebo heterotopicky do speciálně vytvořeného peritoneální místa. Pokud je riziko přenosu maligních buněk, jsou izolovány
primordiální folikuly a následně jsou oocyty in vitro maturace maturovány k zisku zralých oocytů (metafáze II), které lze pak
fertilizovat. Vzniklá embrya pak můžeme transferovat do dělohy ženy či vitrifikovat.<br>
B) Postprepubertální pacientky a pacientky s benigními onemocněními, které mohou oddálit chemoterapií přibližně
o 2 týdny, lze pacientku stimulovat, zralé oocyty vitrifikovat a po rozmražení oocyty fertilizovat.
Techniky v případech A a B lze také kombinovat.<br>
Fig. 9. Fertility preservation options [5].<br>
A) Ovarian tissue is taken from prepubertal patients or patients requiring immediate chemotherapy, which is subsequently
processed and then frozen using the conventional slow freezing technique. If there is no risk of malignant cell transmission, the
ovarian tissue can be transplanted back into the patient either orthotopically, depending on whether the patient has at least one
ovary, or heterotopically – into a specially created peritoneal site. If there is a risk of malignant cell transfer, the primordial follicles
are isolated and then the in vitro maturation oocytes are matured to yield mature oocytes that can be immediately fertilized or vitrified, or the resulting embryos transferred or vitrified.<br>
B) Post-pubertal patients and patients with benign diseases that can delay chemotherapy by approximately 2 weeks, the patient
can be instilled and the mature oocytes vitrified and then fertilized after thawing.
The techniques in cases A and B can also be combined.](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e53bee7b31dc8e6741aa6b50a37ec530.jpg)
Závěr
Kryokonzervace ovariální tkáně je ve světě stále více využívanou metodou nejen pro zachování plodnosti. V dnešní době existuje několik protokolů a postupů kryokonzervace ovariální tkáně, kdy je dle dosavadních studií pro OTC metodou volby pomalé zamražování z důvodu lepšího zachování primordiálních folikulů, vaskularizace, proliferace folikulárních buněk, poškození DNA, exprese Anti-Müllerianského hormonu (AMH) a také počtu živě narozených dětí. Rozdíly v protokolech a postupech mezi vitrifikací a pomalým zamražením ztěžují srovnání výsledků laboratorních studií. Pro zachování co nejlepší kvality folikulů v kryokonzervované ovariální tkáni je nezbytné neustále optimalizovat, standardizovat a porovnávat jak kryokonzervační protokoly, postupy a strategie, tak i proces rozmražení ovariální tkáně a její následnou transplantaci.
ORCID autorky
V. Hončová 0000-0001-7066-7853
Doručeno/Submitted: 6. 11. 2022
Přijato/Accepted: 6. 12. 2022
Mgr. Veronika Hončová
Porodnicko-gynekologická klinika
LF UP a FN Olomouc
Zdravotníků 248/7
779 00 Olomouc
Zdroje
1. Mardešić T, Jelínková L, Melicharová L. Úspěšná transplantace ovariální tkáně u pacientky s ovariálním selháním po onkologické léčbě. Ceska Gynekol 2017; 82 (1): 38–41.
2. Vuković P, Kasum M, Orešković D et al. Importance of ovarian tissue cryopreservation in fertility preservation and anti-aging treatment. Gynecol Endocrinol 2019; 35 (11): 919–923. doi: 10.1080/09513590.2019.1611763.
3. Sugishita Y, Taylan E, Kawahara T et al. Comparison of open and a novel closed vitrification system with slow freezing for human ovarian tissue cryopreservation. J Assist Reprod Genet 2021; 38 (10): 2723–2733. doi: 10.1007/s10815-021-02297-9.
4. Donnez J, Dolmans MM. Preservation of fertility in females with haematological malignancy. Br J Haematol 2011; 154 (2): 175–184. doi: 10.1111/j.1365-2141.2011.08723.x.
5. Seli E, Tangir J. Fertility preservation options for female patients with malignancies. Curr Opin Obstet Gynecol 2005; 17 (3): 299–308. doi: 10.1097/01.gco.0000169108.15623.34.
6. Gjeterud J, Kristensen SG, Fedder J. Indications for cryopreservation and autotransplantation of ovarian tissue. Tidsskr Nor Laegeforen 2021; 141 (2021–15). doi: 10.4045/tidsskr.21.0030.
7. Rivas Leonel EC, Lucci CM, Amorim CA. Cryopreservation of human ovarian tissue: a review. Transfus Med Hemother 2019; 46 (3): 173–181. doi: 10.1159/000499054.
8. Donnez J, Dolmans MM. Fertility preservation in women. N Engl J Med 2017; 377 (17): 1657–1665. doi: 10.1056/NEJMra1614676.
9. Gellert SE, Pors SE, Kristensen SG et al. Transplantation of frozen-thawed ovarian tissue: an update on worldwide activity published in peer-reviewed papers and on the Danish cohort. J Assist Reprod Genet 2018; 35 (4): 561–570. doi: 10.1007/s10815-018-1144-2.
10. Talwar P, Awasthi P. Ovarian Tissue Cryopreservation. In: Allahbadia GN, Ata B, Lindheim SR et al (eds). Textbook of Assisted Reproduction. Singapore: Springer 2020.
11. Wallace WH, Thomson AB, Kelsey TW. The radiosensitivity of the human oocyte. Hum Reprod 2003; 18 (1): 117–121. doi: 10.1093/hum rep/deg016.
12. Huser M. Onkofertilita – nová oblast reprodukční medicíny. 1. vyd. Praha: Mladá fronta 2014.
13. Dolmans MM, Donnez J. Fertility preservation in women for medical and social reasons: oocytes vs ovarian tissue. Best Pract Res Clin Obstet Gynaecol 2021; 70 : 63–80. doi: 10.1016/ j.bpobgyn.2020.06.011.
14. Yding Andersen C, Mamsen LS, Kristensen SG. Fertility preservation: freezing of ovarian tissue and clinical opportunities. Reproduction 2019; 158 (5): F27–F34. doi: 10.1530/REP-18-0635.
15. Kristensen SG, Andersen CY. Cryopreservation of ovarian tissue: opportunities beyond fertility preservation and a positive view into the future. Front Endocrinol (Lausanne) 2018; 9 : 347. doi: 10.3389/fendo.2018.00347.
16. Morewood T, Getreu N, Fuller B et al. The effect of thawing protocols on follicle conservation in human ovarian tissue cryopreservation. Cryo Letters 2017; 38 (2): 137–144.
17. Dolmans MM, Hossay C, Nguyen TY et al. Fertility preservation: how to preserve ovarian function in children, adolescents and adults. J Clin Med 2021; 10 (22): 5247. doi: 10.3390/ jcm10225247.
18. De Roo C, Tilleman K. In vitro maturation of oocytes retrieved from ovarian tissue: outcomes from current approaches and future perspectives. J Clin Med 2021; 10 (20): 4680. doi: 10.3390/jcm10204680.
19. Kedem A, Yerushalmi GM, Brengauz M et al. Outcome of immature oocytes collection of 119 cancer patients during ovarian tissue harvesting for fertility preservation. J Assist Reprod Genet 2018; 35 (5): 851–856. doi: 10.1007/s10815-018-1153-1.
20. Practice Committee of American Society for Reproductive Medicine. Ovarian tissue cryopreservation: a committee opinion. Fertil Steril 2014; 101 (5): 1237–1243. doi: 10.1016/j.fertnstert.2014.02.052.
21. Kometas M, Christman GM, Kramer J et al. Methods of ovarian tissue cryopreservation: is vitrification superior to slow freezing? Ovarian tissue freezing methods. Reprod Sci 2021; 28 (12): 3291–3302. doi: 10.1007/s43032-021-00591-6.
22. Suzuki N, Yoshioka N, Takae S et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod 2015; 30 (3): 608–615. doi: 10.1093/humrep/deu353.
23. Oktay K, Buyuk E, Veeck L et al. Embryo development after heterotopic transplantation of cryopreserved ovarian tissue. Lancet 2004; 363 (9412): 837–840. doi: 10.1016/ S0140-6736 (04) 15728-0.
24. Donnez J, Dolmans MM. Natural hormone replacement therapy with a functioning ovary after the menopause: dream or reality? Reprod Biomed Online 2018; 37 (3): 359–366. doi: 10.1016/j.rbmo.2018.05.018.
25. Huser M, Žáková J, Crha I et al. Kryokonzervace ovariální tkáně u onkologických pacientek – 6 let klinických zkušeností. Ceska Gynekol 2012; 77 (2): 118–126.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2023 Číslo 1
-
Všechny články tohoto čísla
- Epidermolýza u novorodenca matky s kožnou manifestáciou covid-19 v III. trimestri gravidity
- Akutní recidivující pankreatitida v průběhu III. trimestru těhotenství
- Fertilitu šetřící terapie u ektopické gravidity
- Předčasný odtok plodové vody před termínem porodu
- Staré a nové pohľady na funkčnú morfológiu vajíčkovodov a ich význam pre gynekologickú prax
- Analýza tkáňové exprese proteomu cervikálního hlenu
- Kryokonzervace ovariální tkáně jako metoda pro zachování fertility u žen
- Zkušenosti s rekonstrukcí zanedbaných rozsáhlých porodních poranění zahrnujících poranění análního svěrače
- Oxytocin a další peptidová uterotonika – jejich pražské osudy
- Seznam recenzentů
- Zápis z jednání volební komise pro volbu výboru Onkogynekologické sekce České gynekologické a porodnické společnosti ČLS JEP
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Kryokonzervace ovariální tkáně jako metoda pro zachování fertility u žen
- Předčasný odtok plodové vody před termínem porodu
- Fertilitu šetřící terapie u ektopické gravidity
- Staré a nové pohľady na funkčnú morfológiu vajíčkovodov a ich význam pre gynekologickú prax
