Současný pohled na duktální karcinom in situ
Current knowledge of ductal carcinoma in situ
Objective:
With respect to an increasing incidence of ductal carcinoma in situ (DCIS) of the breast and thus growing importance of this disease we want to review the current data about the diagnostics and therapy of this leasion. We will also try to outline the future development of the management of this disease.
Design:
Review article describing the current knowledge of ductal carcinoma in situ.
Setting:
Department of Gyneacology and Obstetrics, MEDINOS Clinic, Sonneberg, Germany.
Methods:
Study of the current literature.
Conclusion:
Evidence-based guidelines for therapy of this disease are still not available. Up-to-date management is based on the theory of linear progression, which means that DCIS is an obligate precursor of invasive breast carcinoma. Consequently, we treat this leasion vigorously in order to prevent future recurrences or invasive disease. Existing prognostic and predictive markers do not allow a sufficient classification of low-grade and high-grade patients. Further studies are necessary in order to distinguish women who need only an observation from those who require a full-scale therapy.
Key words:
ductal carcinoma in situ, therapy, prognostic and predictive factors.
Autoři:
J. Böhm 1; Michal Zikán 2
Působiště autorů:
Gynekologicko-porodnické oddělení, klinika MEDINOS, Sonneberg, SRN
1; Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha
2
Vyšlo v časopise:
Ceska Gynekol 2009; 74(5): 339-347
Souhrn
Cíl studie:
S ohledem na rostoucí incidenci duktálního carcinoma in situ (DCIS) prsní žlázy, a tedy vzrůstající význam tohoto onemocnění podáváme přehledné informace o současné diagnostice a léčbě této léze. Zároveň se pokusíme nastínit možný vývoj managementu této choroby v budoucnosti.
Typ studie:
Přehledný článek mapující aktuální poznatky o DCIS.
Název a sídlo pracoviště:
Gynekologicko-porodnické oddělení, klinika MEDINOS, Sonneberg, SRN.
Metodika:
Studium dostupné literatury.
Závěr:
Stále chybějí jednoznačná evidence-based doporučení ke komplexní léčbě DCIS. Současný management vychází z teorie tzv. lineární progrese. Podle tohoto názoru představuje DCIS obligátní prekurzor invazivního karcinomu prsu, a tedy lézi, kterou je třeba energicky léčit, aby se předešlo recidivám nebo následnému přechodu do invazivity. Dnes používané prognostické a prediktivní faktory stále ještě neumožňují s jistotou odlišit ty ženy, u kterých se můžeme spokojit s observací, od těch, u nichž je třeba plně využít veškeré léčebné možnosti.
Klíčová slova:
duktální carcinoma in situ, léčba, prognostické a prediktivní faktory.
DUKTÁLNÍ KARCINOM IN SITU – STÁLE ČASTĚJŠÍ PROBLÉM
V dobách před zavedením mamografického screeningu činila incidence duktálního karcinomu in situ (DCIS) méně než 5 procent všech maligních onemocnění prsu [44]. Údaje ze screeningových programů o četnosti této léze se dnes pohybují v závislosti na věku pacientek okolo 20 procent [12]. Příčinou tak dramatického nárůstu je snadná detekovatelnost mikrokalcifikací, které typicky DCIS provázejí. Častěji než dříve tedy stojíme před otázkou, jak nejlépe zjištěné onemocnění léčit. Diagnostika i léčba preinvazivních stadií karcinomu prsu s sebou bohužel přináší i mnohá dosud nevyřešená dilemata. Následující článek nejprve seznámí čtenáře s aktuálními standardy léčby DCIS, zejména s ohledem na dosud známé prognostické a prediktivní faktory, které léčebnou strategii ovlivňují. V závěru se pokusíme přiblížit některé nejnovější poznatky o molekulárních vlastnostech DCIS, které by v budoucnu mohly pomoci odpovědět na mnohé dodnes nevyřešené otázky ohledně optimálního léčebného postupu.
POZADÍ PROBLÉMU – VÝVOJ A PREKURZORY DCIS
Duktální carcinoma in situ patří podle dnešních názorů spolu s atypickou duktální hyperplazií (ADH) k předstupňům invazivního karcinomu prsu (invasive breast carcinoma - IBC). Definován je jako proliferace maligních epiteliálních buněk prsní žlázy bez přítomnosti invaze přes bazální membránu. Souhrnným označením pro tyto změny je duktální intraepiteliální neoplazie (DIN). Všeobecně přijímaný model jejich vývoje je tzv. lineární progrese. Podle tohoto názoru je prvním stupněm změn tzv. usual ductal hyperplasia (UDH), následovaná plochou epiteliální atypií – flat epithelial atypia (DIN 1A), atypickou duktální hyperplazií (DIN 1B) a konečně low-grade (DIN 1C), intermediate-grade (DIN 2), a high-grade DCIS (DIN 3), přičemž diagnostikované léze podle této teorie dříve nebo později nevyhnutelně progredují, v konečné fázi až do IBC [1]. Tento model podporují například studie prokazující podobné genetické změny v ADH, DCIS a invazivních tumorech [34] (tab. 1).
![Analýza genetických změn metodami LOH (loss of heterozygosity) a CGH (comparative genomic hybridisation) pro jednotlivé prekurzory karcinomu prsu [34]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/23f86942328309271f5fd25f3e49655f.png)
V protikladu k těmto výsledkům stojí výzkumy jiné [14], srovnávající čistý DCIS a DCIS sdružený s IBC. Podle nich se i přes morfologickou podobnost jedná o změny geneticky odlišné. Čistý DCIS a DCIS spojený s IBC jsou tedy možná dvě velmi rozdílná onemocnění, a čistý DCIS tak nepředstavuje obligátní, ale jen potenciální prekurzor IBC. Spíše než o jednoduchou lineární progresi by tedy mohlo jít o několik složitých drah, kdy low-grade DCIS dává vzniknout dobře diferencovanému invazivnímu karcinomu a high-grade DCIS špatně diferencovanému invazivnímu karcinomu (obr. 1).
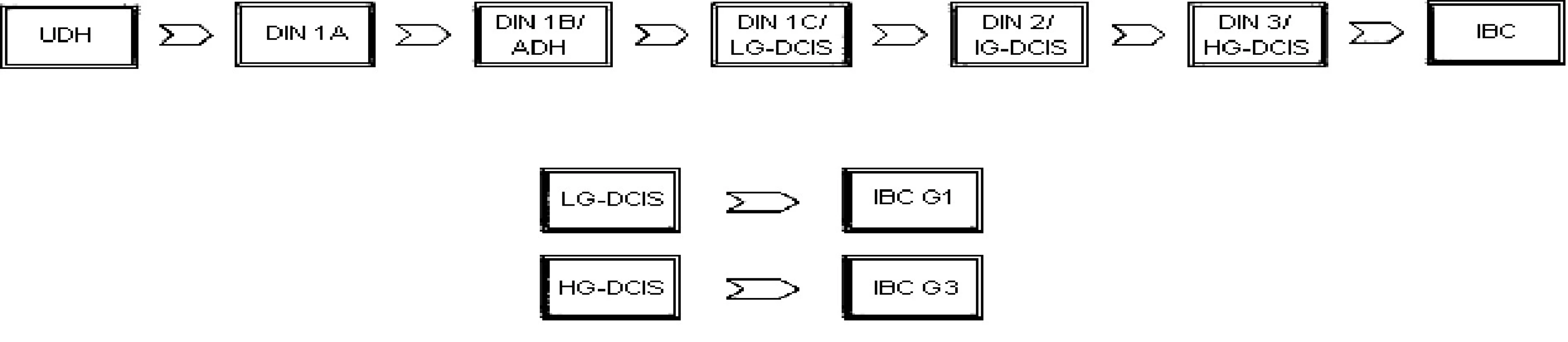
MULTIDISCIPLINÁRNÍ PŘÍSTUP K LÉČBĚ – VAN NUYS PROGNOSTIC INDEX – STÁLE ZLATÝM STANDARDEM
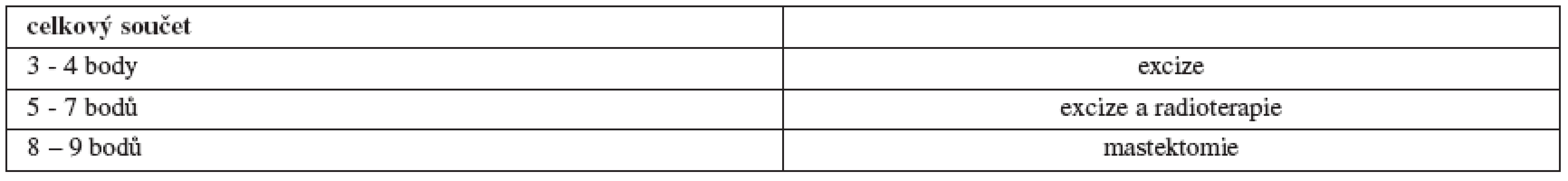
Spektrum možné léčby DCIS sahá od prosté excize doplněné eventuálně endokrinní léčbou tamoxifenem v případě estrogen-pozitivních tumorů, přes adjuvantní radioterapii (RT) u některých typů lézí až po mastektomii včetně vyšetření sentinelové uzliny. Tento přístup vychází z názoru, že DCIS představuje premaligní lézi, kterou je třeba energicky léčit, aby se předešlo recidivám, a nebo následnému přechodu do invazivních stadií. Důležitou pomůckou při rozhodování o rozsahu operace a o vhodnosti adjuvantní RT zůstává dodnes tzv. Van Nuys Prognostic Index (VNPI) (tab. 2 a 3) [52].
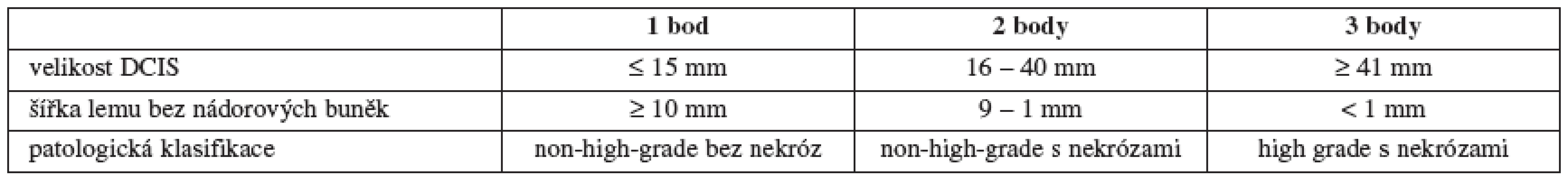
Jak je vidět v tabulce, je prvním faktorem, který se bere v potaz při rozhodování o způsobu léčby, velikost ložiska. Zaprvé jde o to, že s narůstající velikostí DCIS stoupá i riziko přítomnosti (mikro)invazivní složky a zároveň i možnost metastáz v regionálních uzlinách [45]. Druhým, neméně důležitým faktem je, že u rozsáhlých duktálních carcinoma in situ jen těžko budeme schopni provést prs záchovný výkon s uspokojivým plastickým výsledkem.
Dalším bodem ve VNPI je šíře lemu. Podrobně je toto kontroverzní téma rozebráno v odstavci o chirurgické léčbě.
A konečně jako třetí proměnnou musíme brát v úvahu histopatologickou klasifikaci nádoru. Standardem je dnes rozdělení podle WHO z roku 2003 [56]. Low-grade DCIS je typicky tvořen kulatými až oválnými monomorfními buňkami, které mohou vytvářet solidní, kribriformní nebo mikropapilární struktury. Nekrózy nejsou přítomny. Intermediate-grade DCIS se v zásadě podobá low-grade s tím rozdílem, že pozorujeme určitou variabilitu ve velikosti buněk a jader, nekrózy mohou, ale nemusí být přítomny. Pro high-grade je typické amorfní uspořádání atypických buněk s četnými mitózami, nekrózy opět mohou, ale nemusí být přítomny. Je tedy zřejmé, že základem pro grading DCIS je i v dnešní době stále jen histopatologický nález. Jiné markery doposud uplatnění v klinickém rozhodování nenašly.
CHIRURGICKÁ LÉČBA DUKTÁLNÍHO CARCINOMA IN SITU
Na počátku léčebného algoritmu stojí operace. Analogicky k terapii IBC je základem kompletní odstranění ložiska DCIS. Toho lze většinou dosáhnout prs záchovným výkonem – lumpektomií nebo segmentektomií. Základním předpokladem pro úspěšnou léčbu je dosažení R0 situace. Zde se ovšem dostáváme k první kontroverzi – jaký odstup mezi okrajem DCIS a resekční linií lze považovat za dostatečný? Narozdíl od invazivních karcinomů, které většinou bývají oproti zdravé tkáni ostře ohraničené, je u DCIS situace opačná. Pro patologa tak může být často problematické vyjádřit se ke kompletnosti odstraněné léze. Z tohoto důvodu se dnes všeobecně u DCIS požaduje širší lem zdravé tkáně než u nádorů invazivních.
Některé velké prospektivní randomizované studie [6, 15, 22] zabývající se přínosem adjuvantní radioterapie vyžadovaly ve svém protokolu pouze R0 situaci (tumor nedosahující k resekční linii, žádné údaje ohledně lemu), jiné se spokojily jen s makroskopickým posouzením okrajů resekátu [11] (tab. 4). Aktuální guidelines německé onkogynekologické společnosti (www.ago-online.de) stejně jako Europen Society of Breast Cancer Specialists (www.eusoma.org) udávají jako dostatečnou šířku 10 mm a doporučují zvážit reoperaci při užším lemu. U některých pacientek s rozsáhlým a nebo multicentrickým DCIS ovšem ani opakovanou reoperací nedosáhneme kompletního odstranění léze, a budeme tak muset indikovat mastektomii.
Mezi odborníky se ovšem objevují i hlasy zpochybňující nutnost kompletní excize DCIS. Hlavní argumenty srovnávají DCIS s lobulárním carcinoma in situ (LCIS), který není považován za pravý prekurzor rozvoje IBC nýbrž pouze za prediktor – jeho nález zvyšuje riziko rozvoje IBC ipsilaterálně i kontralaterálně – a podle současných názorů není tedy v naprosté většině případů nutné chirurgicky kompletně odstraňovat ložisko. I zde ovšem v posledních letech dochází ke změnám ve vnímání této léze. Prvním důvodem jsou epidemiologická pozorování. Dlouho se tak například věřilo, že v případě nálezu LCIS je riziko vzniku IBC srovnatelné pro oba prsy. Page et al. [38] ovšem prokázali, že toto riziko je pro postižený prs až třikrát vyšší než pro prs kontralaterální. To by znamenalo, že LCIS je jak prediktorem, tak i přímým prekurzorem. K dalšímu stírání dříve ostré hranice mezi lobulárními a duktálními in situ lézemi přispělo popsání pleomorfního carcinoma in situ (PLCIS) [29]. Tato jednotka připomíná na jedné straně svou morfologií LCIS, jednotlivé buňky ovšem vypadají jako buňky intermediate grade DCIS. Biologické chování se blíží spíše DCIS, jedná se o lokálně agresivní variantu. U PLCIS také častěji nacházíme mikrokalcifikace, vlastnost jinak typická pro DCIS [16].
Ke zřetelnému odlišení lobulárních a duktálních lézí se klasicky používá imunohistochemický průkaz E-kadherinu, proteinu exprimovanému na povrchu normálních epiteliálních buněk. Lobulární léze bývají typicky E-kadherin negativní. Mimo to nacházíme ještě další fenotypové rozdíly. Tak například buňky LCIS, narozdíl od HG-DCIS, jen zřídka exprimují na svém povrchu proteiny c-erbB2 (Her-2/neu) nebo p53. I tak ovšem tímto způsobem nebudeme vždy schopni jednoznačně odlišit LCIS od PLCIS a za některých okolností ani DCIS od PLCIS. Byly proto navrženy postupy molekulární klasifikace in situ změn, které pomocí genové analýzy metodou zjišťování gains / losses genů specifických pro karcinom prsu dokázaly spolehlivě rozdělit in situ změny na jednotlivé subtypy (DCIS, LCIS, PLCIS) [41].
Dalším často diskutovaným problémem chirurgické léčby je staging axilárních uzlin. Kompletní disekce a vyšetření uzlin na přítomnost metastáz již dnes nepatří do standardního managementu DCIS. S rozvojem konceptu sentinelové uzliny, zejména s ohledem na nízkou invazivitu DCIS, ovšem v posledních letech došlo ke změnách v indikaci tohoto výkonu a v některých klinických situacích je dnes vyšetření sentinelové uzliny již doporučováno. Jedná se zejména o velké DCIS přesahující 4-5 cm, hmatné tumory a DCIS s mikroinvazí. Zde bývá sentinelová uzlina pozitivní až v 5 % [61]. Fakt, že přítomnost mikrometastáz (<2mm) ani metastáz v axilárních uzlinách v případě DCIS nijak nezvyšuje riziko lokálních recidiv ani vzdálených metastáz [32], nás ovšem nutí k zamyšlení nad případnými klinickými konsekvencemi zjištění pozitivity axilárních uzlin.
Pro srovnání – v případě IBC je situace trochu odlišná. Pozitivita sentinelové uzliny je nezávislý prognostický faktor pro distant disease-free survival (interval bez známek vzniku vzdálených metastáz), a tedy je třeba tento nález zohlednit při indikaci adjuvantní terapie.
ADJUVANTNÍ RADIOTERAPIE DUKTÁLNÍHO CARCINOMA IN SITU
Další léčebnou modalitou je radioterapie (RT). V managementu DCIS slouží k zajištění optimální lokální kontroly po záchovných operacích – cílem je tedy snížení počtu lokálních recidiv, které mohou mít opět formu in situ a nebo mohou být invazivní. Otázkou správné indikace se zabývaly některé prospektivní randomizované studie [6, 11, 15, 22] (tab. 4). Srovnávaly výsledky dosažené pouhou excizí ložiska a excizí doplněnou adjuvantní RT. Jedna další retrospektivní studie si kladla podobný cíl, zde navíc nebyly výsledky ovlivněny žádnou hormonální adjuvantní terapií [17]. Všechny tyto výzkumy dospěly k podobným výsledkům, totiž že adjuvantní RT lze docílit signifikantního snížení incidence lokálních recidiv. Snížení relativního rizika se přitom pohybovalo mezi 47 % - 67 %. Nejvíce z adjuvantní RT profitovaly pacientky s nejvyšším rizikem recidivy. V tabulce 5 jsou shrnuty hlavní rizikové faktory pro lokální recidivu DCIS, tak jak vyplývají ze studie EORTC 10853 [6]. Naopak s jistotou kompletně odstraněné, malé low-grade léze, kterým odpovídá VNPI 3-4, budou zřejmě těmi, u kterých je adjuvantní RT přinejmenším kontroverzní, jak to naznačuje výše uvedená studie [17]. Přesně zodpovědět otázku, které podskupině pacientek s DCIS nepřinese po prs záchovné operaci adjuvantní RT žádný další benefit, se pokusily dvě menší studie. Jak je vidět z tabulky 6, výsledky byly přesně opačné [53, 63]. Do budoucna tedy stále zbývá úkol definovat ty pacientky s nízkým rizikem, u kterých adjuvantní RT není nutná. Zde by se mohly uplatnit nově definované biologické markery, které by při rozhodování nahradily nebo doplnily skórovací systém VNPI. Ve stadiu klinických studií jsou zatím možnosti parciálního ozáření prsu a brachyterapie [7].
![Přehled studií zabývajících se přínosem adjuvantní radiace po prs záchovné operaci pro DCIS [6, 11, 15, 22]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/6d1cc90b2082e493023e660b5666c963.png)
![Hlavní rizikové faktory pro recidivu DCIS [6]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/7a1138cf7ec8b8c427dcd62be6e96b7d.png)
![Přehled studií hledajících podskupinu pacientek s DCIS, u kterých adjuvantní RT nepřináší žádný benefit [53, 63]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/1e639e82c6950fc0f234e3878a1b7605.png)
ADJUVANTNÍ SYSTÉMOVÁ LÉČBA DUKTÁLNÍHO CARCINOMA IN SITU
Ještě méně je probádaná kapitola adjuvantní hormonální léčby. Z výše uvedených velkých prospektivních studií se jen dvě zabývají touto otázkou. V jedné z nich [22] se neprokázal signifikantní vliv tamoxifenu na incidenci ipsilaterální intraduktální recidivy, snížil se ovšem počet všech diagnostikovaných DCIS. Z toho lze usuzovat na určitý preventivní efekt. V další studii [15] sice adjuvantní podávání tamoxifenu u pacientek s pozitivní resekční linií (R1) snížilo incidenci ipsilaterální recidivy, ovšem i tak zůstalo riziko vyšší, než podařilo-li se operací dosáhnout negativních okrajů resekátu (R0). Tamoxifen by tedy měl být nabídnut zejména pacientkám s vysokým rizikem (pozitivní okraje resekátu, high-grade DCIS), v opačném případě zřejmě není efekt hormonální léčby tak příznivý, aby ospravedlnil možné nežádoucí účinky. Nezbytnou podmínkou adjuvantní hormonální léčby je samozřejmě imunohistochemický průkaz exprese estrogenových receptorů na povrchu nádorových buněk.
Stejně tak nevyjasněná zůstává role inhibitorů aromatázy, i když některá pozorování naznačují jejich účinnost i u DCIS [9]. Rovněž i možnosti neoadjuvantního nasazení tamoxifenu [23] a trastuzumabu u HER2 pozitivního duktálního carcinoma in situ [19] jsou intenzivně zkoumány.
SPECIÁLNÍ PŘÍPAD – DCIS S MIKROINVAZÍ
V některých případech patolog popíše invazi DCIS přes bazální membránu, přičemž hloubka invaze nepřesahuje 1mm. Zde potom mluvíme o DCIS s mikroinvazí. Dostupných dat, která by nám pomohla optimálně léčit pacientky s tímto onemocněním, není mnoho. Největší kontroverzí bude jistě indikace případné adjuvantní chemoterapie. Zde doporučují některé guidelines (www.ago-online.de) postupovat analogicky k IBC.
OBSERVACE – LÉČEBNÁ MOŽNOST?
Jaké jsou vyhlídky, pokud biopticky stanovíme diagnózu duktálního carcinoma in situ a pacientku dále jen sledujeme? V jedné studii takto postupovali u 28 žen. Jen u jedenácti z nich (39 %) se vyvinul invazivní karcinom prsu, z toho u čtyř až po více než deseti letech od diagnózy. IBC byl vždy lokalizován na ten kvadrant, kde byla předtím provedena biopsie. Z výše zmíněných jedenácti žen se u pěti objevily vzdálené metastázy. Tyto výsledky jsou ve shodě s dalšími pozorováními [8, 13, 37, 43] (tab. 7) – u 47-86 % pacientek s diagnostikovaným DCIS nedošlo ani po více než 20 letech k rozvoji invazivního karcinomu prsu [46].
![Přehled studií zabývajících se pravděpodobností progrese neléčeného DCIS [8, 13, 37, 43]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/44c9107ce18ef2e856f28311c451a01c.png)
MOLEKULÁRNÍ MARKERY – HUDBA BUDOUCNOSTI?
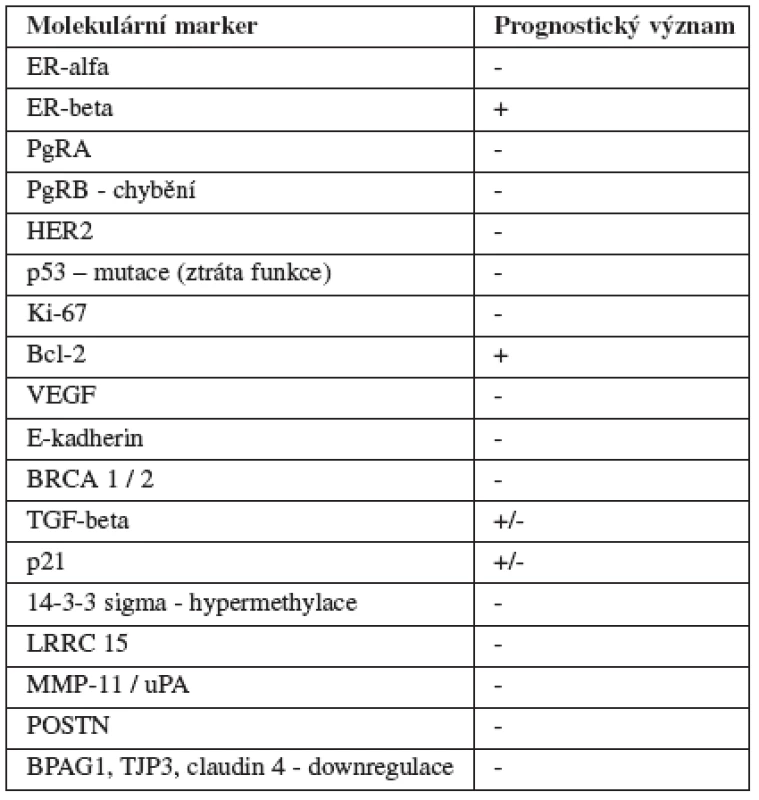
Z výše uvedených odstavců jasně vyplývá, že i přes intenzivní výzkum je v léčbě DCIS stále spousta otevřených témat. Uvědomíme-li si, že jisté procento preinvazivních změn za života pacientky nestačí progredovat do invazivního karcinomu prsu, je zřejmé, že ze strachu před tímto onemocněním bude část pacientek zbytečně vystavena neúměrně agresivní léčbě. Ideální by bylo, kdyby se nám v budoucnu podařilo identifikovat ty vysoce rizikové typy tumorů, u kterých musíme využít veškeré léčebné možnosti k zamezení vzniku recidiv, a naopak nízce rizikové tumory, kde se můžeme spokojit s observací. Na následujících stranách nabízíme čtenáři přehled možných prognostických a prediktivních faktorů, které by v budoucnu mohly nabýt na významu (tab. 8).
Estrogenové receptory
Míra exprese estrogenových receptorů (ER) na povrchu buněk karcinomu prsu našla uplatnění jako faktor prognostický i prediktivní. Estrogeny hrají důležitou roli v růstu a diferenciaci jak normálních epiteliálních buněk prsní žlázy, tak buněk zhoubných. Odlišit můžeme ER-alfa a beta. Obecně se dá říci, že zastoupení buněk exprimujících ER na svém povrchu stoupá s věkem. Maxima pak dosahuje u postmenopauzálních žen [51]. Intenzivní expozice estrogenům patří mezi hlavní rizikové faktory vzniku zhoubných nádorů prsu. Pozitivita ER na povrchu zdravých epitelií – a tedy zvýšená vnímavost buněk k tomuto hormonu – je spojena s přibližně trojnásobným rizikem vzniku karcinomu prsu [27]. U buněk hyperplazie bez atypií, u nichž byla zároveň prokázána overexprese Ki-67 (ER+/Ki-67+), je vyšší tendence progredovat [25]. V porovnání s ER-alfa má výše zmíněný ER-beta tendenci právě opačnou – v průběhu předpokládané lineární progrese ADH DCIS IBC se jeho zastoupení v tkáni snižuje. Poměr ER-alfa/ER-beta by podle jedné studie mohl dobře předpovídat progresi v invazivní karcinom [49].
Progesteronové receptory
V průběhu progrese preinvazivních stadií v IBC exprese progesteronových receptorů (PgR) klesá [2].Ve tkáni duktálního carcinoma in situ koreluje PgR pozitivita se současnou přítomností ER+ buněk. Mnohem méně často pak v tomto terénu pozorujeme přítomnost komedo nekróz [4].Důležitější než absolutní exprese se zdá být poměr izoforem – PgRA versus PgRB. Ve zdravé prsní tkáni je zastoupení obou forem rovnocenné. V průběhu progrese se ovšem poměr mění ve prospěch PgRA [30]. Zajímavé je rovněž, že u pacientek s mutací v genech BRCA chybí exprese PgRB úplně [31].
C-erbB-2 (Her-2/neu)
Gen C-erbB-2 se spolupodílí na regulaci buněčného dělení tím, že kóduje epidermal growth factor receptor číslo 2 (EGFR2). Tento protein patří do skupiny receptorů růstových faktorů, označovaných také jako tyrosinkinázy. Ačkoli v terénu časných prekurzorů (ADH) nebyly dosud prokázány zvýšené koncentrace produktů tohoto genu (overexprese proteinů [10]), amplifikace samotného genu HER2 metodou fluorescenční hybridizace in situ (FISH) byla u ADH pozorována. Míra amplifikace možná stoupá s progresí v karcinom [64]. V jednom experimentu byla amplifikace genu HER2 spojená s dvojnásobným rizikem rozvoje IBC [55]. U duktálního carcinoma in situ je overexprese HER2 spojena s vyšším gradem a s přítomností komedo nekróz, ovšem je i nezávislým prognostickým faktorem bez ohledu na grading DCIS [57]. Allred et al. [2] nacházejí overexpresi HER2 u DCIS častěji než u IBC (77 % u čistého komedo DCIS oproti 15 % u invazivního karcinomu). Jedním z možných vysvětlení, které autoři nabízejí, je, že HER2 je zodpovědný za iniciaci maligní transformace spíše než za následnou progresi nádoru a že v průběhu progrese dochází k jeho downregulaci.
p53
Tumorsupresorový gen TP53 kódující protein p53 hraje zásadní roli v regulaci buněčného cyklu. Jeho mutace, které v konečném důsledku vedou k poruše funkce proteinu (a tedy k nefunkční tumorsupresi) nacházíme prakticky ve všech typech lidských zhoubných nádorů. Již u ADH byla prokázána přítomnost mutovaného genu p53 [26] a frekvence jeho výskytu dále stoupá u DCIS, zejména u komedo-typu [36]. Klinický význam p53 zůstává zatím bohužel nejasný.
Ki-67
Ki-67 je protein, který hraje podstatnou roli v regulaci buněčného cyklu. Známá je jeho reakce s monoklonální protilátkou MIB-1. Jeho stanovení se diagnosticky využívá k určení proliferačního indexu (intenzity buněčného dělení). Ve spojení s některými dalšími zde uvedenými markery apoptózy a regulace buněčného cyklu může fungovat jako velmi významný prognostický faktor maligní transformace. Tak například nízká exprese Ki 67, pozitivita Bcl-2 (viz další odstavec) a negativita p53 (všechno tedy „příznivé“ znaky) jsou typické pro ADH a nebo pro dobře diferencovaný karcinom [59]. Jak bylo zmíněno již v odstavci o ER, u hyperplazie bez atypií, u nichž byla zároveň prokázána zvýšená exprese Ki-67 a ER pozitivita (ER+/Ki-67+), je vyšší tendence progredovat v IBC [25].
Bcl-2
Gen bcl-2 a jeho bílkovinný produkt patří do širší rodiny tzv. bcl-2 genů. Všechny se pozitivně nebo negativně účastní regulace programované buněčné smrti - apoptózy. Jak bylo zmíněno výše, patří konkrétně Bcl-2 spíše mezi „příznivé“ znaky. Pozitivitu zjišťujeme u benigních nálezů, ADH a low grade DCIS, naopak s narůstající agresivitou lézí klesá úroveň exprese bcl-2 [33].
Vascular endothelial growth factor
Vascular endothelial growth factor (VEGF) je angiogenní růstový faktor hrající podstatnou roli v tumorem indukované angiogenezi. Zvýšená neovaskularizace byla pozorována u všech preinvazivních lézí a její intenzita stoupá se závažností těchto lézí. Doposud se ovšem nepodařilo prokázat závislost mezi mírou exprese VEGF a vaskularizace [60]. Přesto někteří autoři navrhují VEGF jako marker agresivity duktálního carcinoma in situ [21]. Není bez zajímavosti, že blokování VEGF monoklonální protilátkou bevacizumab našlo již klinické uplatnění – používá se dnes např. v paliativní léčbě metastazujícího karcinomu prsu.
E-kadherin
E-kadherin, tumorsupresorový gen, bývá častěji než s duktálními lézemi spojován s lobulárním karcinomem. Funkce tohoto genu je totiž typicky narušena u lobulárních neoplazií (LN) a buňky LN tak na svém povrchu neexprimují příslušný bílkovinný produkt. Toho se v praxi využívá při diferenciální diagnostice mezi jednotlivými typy in situ lézí. Experimentů zabývajících se E-kadherinem u DCIS je minimum. Jedna taková studie prokázala vyšší expresi E-kadherinu u dobře diferencovaných DCIS v porovnání se špatně diferencovaným DCIS [20].
BRCA1 / BRCA2
Oba tyto geny patří mezi tumor supresory. Jejich mutace způsobují syndrom hereditárního karcinomu prsu (HBC) nebo syndrom hereditárního karcinomu prsu a vaječníků (HBOC). Prevalence mutací se u pacientek s diagnostikovaným DCIS pohybuje okolo 5 % [54]. K výskytu DCIS dochází u nosiček mutací také v podstatně nižším věku (přibližně o 10 let dříve) [24].
TGF-beta
Role TGF-beta v patogenezi karcinomu prsu je rozporuplná. Možným vysvětlením by byla duální funkce TGF-beta – mohl by sloužit i jako onkogen i jako tumor supresor. Ve shodě s tím jsou výsledky dalších experimentů, kde na jednu stranu nacházíme vyšší expresi TGF-beta u IBC v porovnání s DCIS [62], na straně druhé byl prokázán vztah mezi ztrátou exprese receptoru II TGF-beta a zvýšeným rizikem pro rozvoj IBC [18].
p21
P21 je další z genů regulujících buněčný cyklus. Výsledky studií vztahů tohoto genu a DCIS jsou opět kontroverzní. Pozitivita p21 byla totiž spojena jak s rizikem recidivy DCIS [40] (a představuje tedy „nepříznivý“ znak), tak zároveň v jiné studii koreluje se samými „příznivými“ biologickými vlastnostmi (low-grade, nepřítomnost komedo nekróz, ER pozitivita, p53 negativita) [35].
14-3-3 sigma
Gen 14-3-3 sigma je negativní regulátor buněčného cyklu. V posloupnosti lézí ADH – DCIS – IBC byla se stoupající četností prokázána hypermethylace genu, a tedy vymizení jeho exprese [58]. Údaje posuzující jeho roli ve smyslu rizikového faktoru pro rozvoj karcinomu prsu zatím chybí.
LRRC15
Tento gen kóduje transmembránový protein exprimovaný na migrujících buňkách. Zvýšená exprese byla prokázána na buňkách karcinomu prsu v porovnání se zdravou tkání [48]. In vitro bylo blokádou tohoto proteinu dosaženo snížení invazivity maligních buněk [42]. Průkaz tohoto genu může v budoucnu sloužit jako biologický marker progrese a zároveň si lze představit i léčebné využití, kde díky jeho transmembránové, a tedy dobře přístupné lokalizaci lze jeho funkci blokovat příslušnou protilátkou.
Proteázy MMP-11 a uPA
Podobně koreluje s invazivitou karcinomů prsu i průkaz matrixové metaloproteinázy 11 (MMP-11) nebo urokinázy (uPA) [39]. V případě uPA a jejího inhibitoru PAI-1 (plasminogen activator inhibitor) se jedná o dnes v podstatě jediný nový prognostický faktor, který našel klinické uplatnění. Jeho dalšímu rozvoji v praxi brání fakt, že stanovení je možné pouze na čerstvé resp. zmražené tkáni.
POSTN (periostin)
Periostin, gen exprimovaný buňkami karcinomu prsu, signifikantně zvyšuje míru invazivity a angiogeneze [50]. U pacientek s metastázami do skeletu byly prokázány zvýšené sérové hladiny periostinu [47] a dá se tedy předpokládat, že se periostin nějakým způsobem uplatňuje při tomto typu metastazování (např. usnadňuje adhezi nádorových buněk).
BPAG1, TJP3, claudin 4
Produkty těchto tří genů mají na starosti mezibuněčnou vazbu resp. vazbu mezi buňkou a bazální membránou. V terénu IBC dochází k jejich downregulaci [5]. Průkaz jejich snížené aktivity by mohl být markerem invazivního potenciálu buněk DCIS.
ZÁVĚR
V posledních letech jsme byli svědky dramatického vzestupu incidence DCIS, který je ve své podstatě iatrogenně vyvolaný (mamografický screening). Přitom se nám jen částečně daří zkvalitnit léčbu pacientek s touto chorobou. Na mnohé otázky týkající se adekvátní operační léčby nebo správné indikace adjuvantní radioterapie či hormonální léčby stále nemáme odpověď. Jedním z cílů současného výzkumu je stanovení takových prognostických a prediktivních faktorů, které ve své kombinaci budou schopny předpovědět další vývoj onemocnění. Jen tak budeme moci pro každou ženu individuálně upravit léčbu (tailored therapy). U pacientek s velmi nízkým rizikem budeme moci s klidným svědomím doporučit pouhou observaci, zatímco u těch s rizikem vysokým jistě využijeme všechny dnes známé léčebné modality, abychom předešli vzniku recidivy nebo dokonce progresi v invazivní karcinom. Z následně uvedeného výčtu různých biologických markerů lze tušit, jakým směrem se bude ubírat další výzkum duktálního carcinoma in situ.
MUDr. Jan Böhm
Abteilung für Gynäkologie und Geburtshilfe
Medinos Kliniken Sonneberg und Neuhaus gGmbH
Neustadter Str. 61
965 15 Sonneberg
SRN
Zdroje
1. Allred, DC., Mohsin, SK., Fuqua, SA. Histological and biological evolution of human premalignant breast disease. Endocr Relat Cancer, 2001, 8, 1, p. 47-61.
2. Allred, DC., Clark, GM., Molina, R., et al. Overexpression of HER-2/neu and its relationship with other prognostic factors change during the progression of in situ to invasive breast cancer. Hum Pathol, 1992, 23, 9, p. 974–979.
3. Ariga, N., Suzuki, T., Moriya, T., et al. Progesterone receptor A and B isoforms in the human breast and its disorders. Jpn J Cancer Res., 2001, 92, 3, p. 302–308.
4. Barnes, NL., Boland, GP., Davenport, A., et al. Relationship between hormone receptor status and tumour size, grade and comedo necrosis in ductal carcinoma in situ. Br J Surg, 2005, 92, 4, p. 429–434.
5. Bergstraesser, LM., Srinivasan, G., Jones, JC., et al. Expression of hemidesmosomes and component proteins is lost by invasive breast cancer cells. Am J Pathol., 1995, 147, 6, p. 1823-1839.
6. Bijker, N., Meijnen, P., Peterse, JL., et al. Breast-conserving treatment with or without radiotherapy in ductal carcinoma-in-situ: ten-year results of European Organisation for Research and Treatment of Cancer randomized phase III trial 10853—a study by the EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. J Clin Oncol, 2006, 24, 21, p. 3381-2387.
7. Boughey, JC., Gonzalez, RJ., Bonner, E., et al. Current treatment and clinical trial developments for ductal carcinoma in situ of the breast. Oncologist, 2007, 12, 11, p. 1276-1287.
8. Collins, LC., Tamimi, RM., Baer, HJ., et al. Outcome of patients with ductal carcinoma in situ untreated after diagnostic biopsy: results from the Nurses’ Health Study. Cancer, 2005, 103, 9, p. 1778-1784.
9. Dixon, JM., Faratian, D., White, S., et al. DCIS and aromatase inhibitors. J Steroid Biochem Mol Biol, 2007, 106, 1-5, p. 173-179.
10. Edorh, A., Leroux, A., N’sossani, B., et al. Detection by immunohistochemistry of c-erbB2 oncoprotein in breast carcinomas and benign mammary lesions. Cell Mol Biol (Noisy-le-grand), 1999, 45, 6, p. 831–840.
11. Emdin, SO., Granstrand, B., Ringberg, A., et al. SweDCIS: Radiotherapy after sector resection for ductal carcinoma in situ of the breast. Results of a randomised trial in a population offered mammography screening. Acta Oncol, 2006, 45, 5, p. 536-543.
12. Ernster, VL., Ballard-Barbash, R., Barlow, WE., et al. Detection of ductal carcinoma in situ in women undergoing screening mammography. J Natl Cancer Inst, 2002, 94, 20, p. 1546-1554.
13. Eusebi, V., Feudale, E., Foschini, MP., et al. Long-term follow-up of in situ carcinoma of the breast. Semin Diagn Pathol., 1994, 11, 3, p. 223-235.
14. Farabegoli, F., Champeme, MH., Bieche, I., et al. Genetic pathways in the evolution of breast ductal carcinoma in situ. J Pathol, 2002, 196, 3, p. 280-286.
15. Fisher, B., Land, S., Mamounas, E., et al. Prevention of invasive breast cancer in women with ductal carcinoma in situ: an update of the national surgical adjuvant breast and bowel project experience. Semin Oncol, 2001, 28, 4, p. 400-418.
16. Georgian-Smith, D., Lawton, TJ. Calcifications of lobular carcinoma in situ of the breast: radiologic-pathologic correlation. Am J Roentgenol, 2001, 176, 5, p. 1255-1259.
17. Gilleard, O., Goodman, A., Cooper, M., et al. The significance of the Van Nuys prognostic index in the management of ductal carcinoma in situ. World J Surg Oncol, 2008, 18, 6, p. 61.
18. Gobbi, H., Dupont, WD., Simpson, JF., et al. Transforming growth factor-beta and breast cancer risk in women with mammary epithelial hyperplasia. J Natl Cancer Inst, 1999, 91, 24, 2096–2101.
19. Gonzalez, RJ., Buzdar, AU., Fraser Symmans, W., et al. Novel clinical trial designs for treatment of ductal carcinoma in situ of the breast with trastuzumab (herceptin). Breast J, 2007, 13, 1, p. 72-75.
20. Gupta, SK., Douglas-Jones, AG., Jasani, B., et al. E-cadherin (E-cad) expression in duct carcinoma in situ (DCIS) of the breast. Virchows Arch, 1997, 430, 1, p. 23–28.
21. Hieken, TJ., Farolan, M., D’Alessandro, S., et al. Predicting the biologic behavior of ductal carcinoma in situ: an analysis of molecular markers. Surgery, 2001, 130, 4, p. 593–600.
22. Houghton, J., George, WD., Cuzick, J., et al. Radiotherapy and tamoxifen in women with completely excised ductal carcinoma in situ of the breast in the UK, Australia, and New Zealand: randomised controlled trial. Lancet, 2003, 362, 9378, p. 95-102.
23. Hwang, ES., Esserman, L. Neoadjuvant hormonal therapy for ductal carcinoma in situ: trial design and preliminary results. Ann Surg Oncol, 2004, 11, 1, příloha, p. 37S-43S.
24. Hwang, ES., McLennan, JL., Moore, DH., et al. Ductal carcinoma in situ in BRCA mutation carriers. J Clin Oncol, 2007, 25, 6, p. 642-647.
25. Iqbal, M., Davies, MP., Shoker, BS., et al. Subgroups of non-atypical hyperplasia of breast defined by proliferation of oestrogen receptor-positive cells. J Pathol, 2001, 193, 3, p. 333–338.
26. Keohavong, P., Gao, WM., Mady, HH., et al. Analysis of p53 mutations in cells taken from paraffin-embedded tissue sections of ductal carcinoma in situ and atypical ductal hyperplasia of the breast. Cancer Lett, 2004, 212, 1, p. 121–130.
27. Khan, SA., Rogers, MA., Khurana, KK., et al. Estrogen receptor expression in benign breast epithelium and breast cancer risk. J Natl Cancer Inst., 1998, 90, 1, p. 37-42.
28. Lakhani, SR., Collins, N., Stratton, MR., et al. Atypical ductal hyperplasia of the breast: clonal proliferation with loss of heterozygosity on chromosomes 16q and 17p. J Clin Pathol, 1995, 48, p. 611–615.
29. Middleton, LP., Palacios, DM., Bryant, BR., et al. Pleomorphic lobular carcinoma: morphology, immunohistochemistry, and molecular analysis. Am J Surg Pathol, 2000, 24, 12, p. 1650-1656.
30. Mote, PA., Bartow, S., Tran, N., et al. Loss of co-ordinate expression of progesterone receptors A and B is an early event in breast carcinogenesis. Breast Cancer Res Treat, 2002, 72, 2, p. 163–172.
31. Mote, PA., Leary, JA., Avery, KA., et al. Germ-line mutations in BRCA1 or BRCA2 in the normal breast are associated with altered expression of estrogen-responsive proteins and the predominance of progesterone receptor A. Genes Chromosomes Cancer, 2004, 39, 3, p. 236–248.
32. Murphy, CD., Jones, JL., Javid, SH., et al. Do sentinel node micrometastases predict recurrence risk in ductal carcinoma in situ and ductal carcinoma in situ with microinvasion? Am J Surg, 2008, 196, 4, p. 566-568.
33. Mustonen, M., Raunio, H., Pääkkö, P., et al. The extent of apoptosis is inversely associated with bcl-2 expression in premalignant and malignant breast lesions. Histopathology, 1997, 31, 4, p. 347-354.
34. O’Connell, P., Pekkel, V., Fuqua, SA., et al. Analysis of loss of heterozygosity in 399 premalignant breast lesions at 15 genetic loci. J Natl Cancer Inst, 1998, 90, 9, p. 697-703.
35. Oh, YL., Choi, JS., Song, SY., et al. Expression of p21Waf1, p27Kip1 and cyclin D1 proteins in breast ductal carcinoma in situ: Relation with clinicopathologic characteristics and with p53 expression and estrogen receptor status. Pathol Int, 2001, 51, 2, p. 94-99.
36. O’Malley, FP., Vnencak-Jones, CL., Dupont, WD., et al. p53 mutations are confined to the comedo type ductal carcinoma in situ of the breast. Immunohistochemical and sequencing data. Lab Invest, 1994, 71, 1, p. 67–72.
37. Page, DL., Dupont, WD., Rogers, LW., et al. Intraductal carcinoma of the breast: follow-up after biopsy only. Cancer, 1982, 49, 4, p. 751-758.
38. Page, DL., Schuyler, PA., Dupont, WD., et al. Atypical lobular hyperplasia as a unilateral predictor of breast cancer risk: a retrospective cohort study. Lancet, 2003, 361, 9352, p. 125-129.
39. Paik, S., Shak, S., Tang, G., et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med, 2004, 351, 27, p. 2817-2826.
40. Provenzano, E., Hopper, JL., Giles, GG., et al. Biological markers that predict clinical recurrence in ductal carcinoma in situ of the breast. Eur J Cancer, 2003, 39, 5, p. 622–630.
41. Raju, U., Lu, M., Sethi, S., et al. Molecular classification of breast carcinoma in situ. Curr Genomics, 2006, 7, 8, p. 523-532.
42. Reynolds, PA., Smolen, GA., Palmer, RE., et al. Identification of a DNA-binding site and transcriptional target for the EWS-WT1(+KTS) oncoprotein. Genes Dev, 2003, 17, 17, p. 2094-2107.
43. Rosen, PP., Braun, DW. Jr, Kinne, DE. The clinical significance of pre-invasive breast carcinoma. Cancer, 1980, 15, 46, p. 919-925.
44. Rosner, D., Bedwani, RN., Vana, J., et al. Noninvasive breast carcinoma: results of a national survey by the American College of Surgeons. Ann Surg, 1980, 192, 2, p. 139-147.
45. Sakr, R., Bezu, C., Raoust, I., et al. The sentinel lymph node procedure for patients with preoperative diagnosis of ductal carcinoma in situ: risk factors for unsuspected invasive disease and for metastatic sentinel lymph nodes. Int J Clin Pract, 2008, 62, 11, p. 1730-1735.
46. Sanders, ME., Schuyler, PA., Dupont, WD., et al. The natural history of low-grade ductal carcinoma in situ of the breast in women treated by biopsy only revealed over 30 years of long-term follow-up. Cancer, 2005, 103, 12, p. 2481-2484.
47. Sasaki, H., Yu, CY., Dai, M., et al. Elevated serum periostin levels in patients with bone metastases from breast but not lung cancer. Breast Cancer Res Treat, 2003, 77, 3, p. 245-252.
48. Satoh, K., Hata, M., Yokota, H. High lib mRNA expression in breast carcinomas. DNA Res, 2004, 11, 3, p. 199-203.
49. Shaaban, AM., Jarvis, C., Moore, F., et al. Prognostic significance of estrogen receptor Beta in epithelial hyperplasia of usual type with known outcome. Am J Surg Pathol, 2005, 29, 12, p. 1593–1599.
50. Shao, R., Bao, S., Bai, X., et al. Acquired expression of periostin by human breast cancers promotes tumor angiogenesis through up-regulation of vascular endothelial growth factor receptor 2 expression. Mol Cell Biol, 2004, 24, 9, p. 3992-4003.
51. Shoker, BS., Jarvis, C., Clarke, RB., et al. Estrogen receptor-positive proliferating cells in the normal and precancerous breast. Am J Pathol, 1999, 155, 6, p. 1811-1815.
52. Silverstein, MJ., Lagios, MD., Craig, PH., et al. A prognostic index for ductal carcinoma in situ of the breast. Cancer, 1996, 77, 11, p. 2267-2274.
53. Silverstein, MJ., Lagios, MD., Groshen, S., et al. The influence of margin width on local control of ductal carcinoma in situ of the breast. N Engl J Med, 1999, 340, 19, p. 1455-1461.
54. Smith, KL., Adank, M., Kauff, N., et al. BRCA mutations in women with ductal carcinoma in situ. Clin Cancer Res, 2007, 13, 14, p. 4306-4310.
55. Stark, A., Hulka, BS., Joens, S., et al. HER-2/neu amplification in benign breast disease and the risk of subsequent breast cancer. J Clin Oncol, 2000, 18, 2, p. 267–274.
56. Tavassoli, FA., Devilee, P., World Health Organization Classification of Tumours. Pathology & Genetics of Tumours of the Breast and Female Genital Organs, 1. ed. Lyon : IARC Press, 2003, p. 69-70.
57. Tsuda, H., Iwaya, K., Fukutomi, T., et al. p53 mutations and c-erbB-2 amplification in intraductal and invasive breast carcinomas of high histologic grade. Jpn J Cancer Res, 1993, 84, 4, p. 394–401.
58. Umbricht, CB., Evron, E., Gabrielson, E., et al. Hypermethylation of 14-3-3 sigma (stratifin) is an early event in breast cancer. Oncogene, 2001, 20, 26, p. 3348–3353.
59. Viacava, P., Naccarato, AG., Bevilacqua, G., et al. Different proliferative patterns characterize different preinvasive breast lesions. J Pathol, 1999, 188, 3, p. 245–251.
60. Viacava, P., Naccarato, AG., Bocci, G., et al. Angiogenesis and VEGF expression in pre-invasive lesions of the human breast. J Pathol, 2004, 204, 2, p. 140–146.
61. Vieira, CC., Mercado, CL., Cangiarella, JF., et al. Microinvasive ductal carcinoma in situ: Clinical presentation, imaging features, pathologic findings, and outcome [Epub ahead of print] Eur J Radiol, 2008 Nov 19.
62. Walker, RA., Dearing, SJ. Transforming growth factor beta 1 in ductal carcinoma in situ and invasive carcinomas of the breast. Eur J Cancer, 1992, 28, 2-3, p. 641–644.
63. Wong, JS., Kaelin, CM., Troyan, SL., et al. Prospective study of width excision alone for ductal carcinoma in situ of the breast. J Clin Oncol, 2006, 24, 7, p. 1031-1036.
64. Xu, R., Perle, MA., Inghirami, G., et al. Amplification of Her-2/neu gene in Her-2/neu-overexpressing and -nonexpressing breast carcinomas and their synchronous benign, premalignant, and metastatic lesions detected by FISH in archival material. Mod Pathol, 2002, 15, 2, p. 116–124.
65. Zagouri, F., Sergentanis, TN., Zografos, GC. Precursors and preinvasive lesions of the breast: the role of molecular prognostic markers in the diagnostic and therapeutic dilemma. World J Surg Oncol, 2007, 5, 57.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2009 Číslo 5
-
Všechny články tohoto čísla
- Využití transrektálního ultrazvukového vyšetření a magnetické rezonance ve stagingu časných stadií zhoubného nádoru děložního hrdla
- Význam intervenční ultrasonografie v léčbě pokročilých abdomino-pelvických nádorů
- Proteomika a biomarkery karcinomu děložního hrdla
- Současný pohled na duktální karcinom in situ
- Sledování hemokoagulačních změn v průběhu těhotenství žen s opakovaným potrácením v závislosti na podávání nízkomolekulárního heparinu
- Trendy vývoje operačních porodů
- Časné těhotenské ztráty a vrozené trombofilní stavy
- Riziko kouření pro vznik kardiovaskulárních nemocí začíná už před narozením
- Incidence vrozených vad u dětí z jednočetných a dvojčetných gravidit v České republice – aktuální data
- Karcinom děložního těla - raritní varianta vzdálené metastázy
- Akutní hysterektomie pro prolaps velkého submukózního myomu do pochvy
- Využití nehormonálních účinků kombinované hormonální kontracepce u pacientky s recidivujícím výskytem ovariálních cyst – kazuistika
- Osmdesáté narozeninyprofesora MUDr. Jaromíra Boudy, CSc.
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Současný pohled na duktální karcinom in situ
- Akutní hysterektomie pro prolaps velkého submukózního myomu do pochvy
- Karcinom děložního těla - raritní varianta vzdálené metastázy
- Časné těhotenské ztráty a vrozené trombofilní stavy
