Proteomika a biomarkery předčasného porodu: systematický přehled literatury
Proteomics and biomarkers for detection of preterm labor: a systematic review
Objective:
To review the published articles about identification of biomarkers of spontaneous preterm birth using a proteomic approach and to create a list of potential biomarkers.
Design:
Systematic review of literature.
Setting:
Department of Obstetrics and Gynecology, Medical Faculty Charles University Hradec Kralove.
Methods:
The following databases were accessed in search of relevant citation: MEDLINE, SCOPUS and PubMed. Totally 101 references were identified and relevant 37 abstracts were screened. As appropriated were pointed 16 studies. Finally, the data were extracted from five articles.
Conclusion:
The implementation of high-throughput technologies is necessary in the field of spontaneous preterm birth research. A compelling option is the use of proteomics in the area spontaneous preterm birth biomarkers identification in amniotic fluid, maternal serum/plasma, cervical-vaginal fluid and placental tissue. The data was extracted from published articles and a list of 72 proteins was created.
Key words:
spontaneous preterm birth, proteomics, biomarker.
Autoři:
I. Musilová
; M. Kacerovský; V. Tambor; J. Tošner
Působiště autorů:
Porodnická a gynekologická klinika FN Hradec Králové a Lékařské fakulty Hradec Králové, UK Praha, přednosta doc. MUDr. J. Tošner, CSc.
Vyšlo v časopise:
Ceska Gynekol 2011; 76(1): 37-45
Souhrn
Cíl studie:
Provést systematický přehled literatury zabývající se identifikací biomarkerů spontánního předčasného porodu proteomickým přístupem. Na podkladě výsledků těchto prací vytvořit seznam doposud identifikovaných potenciálních biomarkerů předčasného porodu.
Typ studie:
Systematický přehled literatury.
Název a sídlo pracoviště:
Lékařská fakulta Hradec Králové, Univerzita Karlova Praha. Porodnická a gynekologická klinika FN Hradec Králové.
Metodika:
Publikace byly vyhledány v databázích MEDLINE, SCOPUS a PubMed. Ze seznamu 101 citačních odkazů bylo vybráno 37 jako vhodných. Na podkladě zhodnocení jejich abstrakt byla provedena finální selekce 16 prací. Pouze z pěti prací bylo možné extrahovat data.
Závěr:
Problematika předčasného porodu je oblastí porodnictví, do níž je nezbytné implementovat poznatky získané moderními „-omics“ přístupy. Za využití nástrojů proteomiky byly identifikovány potenciální biomarkery spontánního předčasného porodu v mateřské krvi, plodové vodě, cervikovaginální tekutině a placentární tkáni. Zde byly identifikovány potenciální biomarkery spontánního předčasného porodu. Z dat extrahovaných z publikovaných prací byl vytvořen seznam čítající 72 proteinů, jež mohou vytvořit panel potenciálních biomarkerů spontánního předčasného porodu.
Klíčová slova:
spontánní předčasný porod, proteomika, biomarker.
ÚVOD
Spontánní předčasný porod (SPB), definovaný jako porod před dokončeným 37. gestačním týdnem či 259. dnem těhotenství, patří mezi závažné problémy a zároveň výzvy nejen pro současné porodnictví, ale i pro celosvětové zdravotnictví. Navzdory významným pokrokům moderní medicíny se každoročně předčasně narodí kolem 4,5 milionu dětí. Předčasný porod je příčinou 70–80 % perinatálních úmrtí jak ve vyspělých, tak v rozvojových zemích. Značnou měrou se také podílí na neonatální morbiditě [16]. Jen v USA se každoročně rodí předčasně kolem půl milionu novorozenců a náklady na lékařskou péči činí každoročně přibližně 26 miliard dolarů [37]. Ani přes různé preventivní strategie boje s předčasným porodem se incidenci SPB nedaří snížit a celosvětově se pohybuje kolem 10 %. Navíc výskyt SPB za posledních 25 let vykazuje, zejména ve vyspělých zemích, pozvolný nárůst [19, 30]. Tento trend se zatím nedaří zvrátit z několika důvodů – není plně objasněna patofyziologie předčasného porodu, nemáme k dispozici efektivní screeningový test a také nejsou dostupné účinné preventivní a léčebné intervence.
Včasná identifikace pacientek s vysokým rizikem předčasného porodu (sekundární prevence) je stěžejním momentem optimalizace prenatální péče. Byla studována řada metodik včasné predikce předčasného porodu – rizikové faktory, cervikometrie, biochemické markery (hCG, prolaktin, fetální fibronektin). Tyto metody se v praxi však ukázaly jako nedostatečně efektivní, dosahující jen nízké senzitivity s nízkou pozitivní prediktivní hodnotou a vysokou frekvencí falešně pozitivních výsledků [28]. Většina SPB bohužel tak stále zůstává nepředvídatelnou událostí.
PŘEDČASNÝ POROD
ETIOLOGIE A PATOFYZIOLOGIE
Spontánní předčasný porod je komplexní onemocnění s multifaktoriální etiologií a řadou patofyziologických mechanismů, které všechny vedou ke společnému finálnímu procesu – porodu.
Konečné mechanismy vedoucí k SPB
Děložní kontraktilita
Porod je obecně charakterizován koordinovanými a efektivními děložními stahy, které vedou k vypuzení plodu a následně i placenty. Efektivita děložních stahů je podmíněna zvýšenou mezibuněčnou komunikací skrze štěrbinová spojení (gap junctions) vznikající v myometriu těsně před porodem a mizící krátce po něm [14, 15]. Formace štěrbinových spojení a syntéza jejich stavebního proteinu connexinu 43 je součástí molekulárních a buněčných změn zodpovědných za nástup děložní činnosti. V regulaci formace štěrbinových spojení a syntézy connexinu 43 se uplatňují estrogeny, progesteron a prostaglandiny [10, 32]. Na podkladě studia změn myometria v průběhu gravidity na myším modelu se předpokládá fenotypová remodelace myometria v průběhu těhotenství. Na začátku těhotenství stoupá počet myocytů – tzv. proliferativní fenotyp, ve druhé polovině těhotenství myocyty hypertrofují a produkují větší množství extracelulární matrix, zejména kolagenu I a II – tzv. syntetický fenotyp. Na konci gravidity se objevuje tzv. kontraktilní fenotyp, charakterizovaný nízkou myometriální produkcí intersticiální matrix a vysokou syntézou složek bazální membrány, tj. lamininu a kolagenu IV. Předpokládá se, že přechod z proliferativního na syntetický fenotyp je regulován kaspázou 3 (enzym štěpící bílkoviny, který hraje důležitou roli v apoptóze, nekróze a zánětu). Posun ze syntetického na kontraktilní fenotyp je vyvolán poklesem hladiny progesteronu. Myometriální fenotyp však může být modifikovaný i jinými faktory, např. mechanicky při děložní distenzi [56].
Dilatace děložního hrdla
Funkce děložního hrdla v průběhu těhotenství je dána především vlastnostmi extracelulární matrix. Její nejdůležitější složkou je kolagen, který určuje pevnost pojiva [55]. Zrání děložního hrdla je podmíněno změnou vlastností a množství kolagenu v cervixu. V průběhu jeho zrání se snižuje obsah kolagenu, zvyšuje se jeho solubilita a také je zvýšena kolagenolytická aktivita. Četné práce dokládají podíl pohlavních hormonů na regulaci tohoto procesu. Intravenózní podání 17β-estradiolu indukuje proces zrání hrdla [43], estrogeny stimulují degradaci kolagenu in vitro [45], progesteron blokuje estrogeny indukovanou degradaci kolagenu in vitro [45], antagonisté progesteronových receptorů indukují zrání děložního hrdla v prvním trimestru těhotenství [24]. V procesu zrání cervixu se dále uplatňují i prostaglandiny. PGE2 stimuluje kolagenolýzu a syntézu proteoaminoglykanu PG-S1, který snižuje pevnost kolagenu.
Aktivace plodových obalů a deciduy
Aktivace deciduy a plodových obalů je komplex anatomických a biochemických pochodů, jehož výsledkem je uvolnění dolního pólu vaku blan od deciduy dolního děložního segmentu s následným porušením integrity plodových obalů. Studie zabývající se oblastí porušení plodových obalů definovaly tzv. místo pozměněné morfologie (ZAM – zone of altered morfology) [34, 36]. V ZAM bylo prokázáno snížené množství kolagenu typů I, III a V a zvýšená syntéza tenascinu, ke které typicky dochází při tkáňové remodelaci a procesu hojení. Popsané změny jsou výraznější v případě předčasného odtoku plodové vody (PPROM) [2, 35]. Tato morfologická a biochemická pozorování jsou ve shodě s biofyzikálními studiemi, které naznačují, že porušení plodových obalů je výsledkem akutního nebo chronického zatížení v místě snížení jejich pevnosti. Rozpuštění tzv. extracelulárního „cementu“ (fetálního fibronektinu) umožní po porodu odloučení plodových obalů od deciduy. Fetální fibronektin je prokazatelný v cervikovaginální tekutině u termínového i předčasného porodu [25, 30]. Přesný mechanismus aktivace plodových obalů a deciduy není zatím plně objasněn. Předpokládá se role matrix-metalloproteináz a apoptózy. Obecně je porušení plodových obalů spojeno se zvýšenou expresí genů pro-apoptotických a snížením exprese genů anti-apoptotických [13].
Patofyziologické cesty vedoucí k SPB
Intrauterinní infekce
Intrauterinní infekce je v současné době jediným patologickým procesem, u něhož byl jednoznačně prokázán kauzální vztah k SPB. Její nejtěžší forma, syndrom fetální zánětlivé odpovědi, se navíc podílí na genezi dětské mozkové obrny a bronchopulmonální dysplazie [17]. Výsledky mikrobiologických a histopatologických studií naznačují, že infekce je příčinou 25–40 % SPB [48]. Kultivačně prokázaná mikrobiální invaze plodové vody je přítomna v 32 % případů PPROM a u 51 % žen s dilatací děložního hrdla v II. trimestru [47]. Nejčastějšími mikroorganismy zodpovědnými za intrauterinní infekci jsou genitální mykoplazmata. Přítomnost mikroorganismů v plodové vodě (MIAC – microbial invasion of the amniotic cavity) stimuluje vznik lokální zánětlivé reakce spjaté s produkcí proinflamatorních cytokinů a mediátorů, které jsou schopny iniciovat porod. Jednoznačně prokázanou roli zde hrají IL-1 a TNF-α. Ty jsou schopny stimulovat produkci prostaglandinů v amniu, deciduální tkáni a v myometriu [46].
Děložní ischemie
Studie zabývající se histologickým vyšetřením placent pacientek s SPB a PPROM potvrdily, že cévní léze v mateřské či fetální cirkulaci jsou po zánětu druhým nejčastějším patologickým nálezem. Léze v mateřské cirkulaci představují histopatologické známky selhání fyziologické transformace spirálních arterií. V placentách bylo prokázáno snížení počtu arteriol v klcích, a také arteriální trombóza. Tyto nálezy byly dříve spojovány jen s preeklampsií a IUGR, dnes se ukazuje, že mají i svoji roli v patogenezi předčasného porodu, neboť experimentálně vyvolaná ischemie u primátů vedla k předčasnému porodu [9]. Je zajímavé, že vaskulární léze deciduálních cév jsou v porovnání s termínovou graviditou častější u SPB a PPROM [1]. Tím lze vysvětlit vyšší frekvenci SGA (small for gestational age) plodů u těchto porodnických patologií [57]. Na molekulární úrovni je mechanismus iniciace předčasného porodu spjat s rolí renin-angiotenzinového systému, který je přítomen také v plodových obalech. Děložní ischemie způsobuje zvýšení hladinu reninu a vzniklý angiotenzin přímo stimuluje aktivitu myometria a současně vede k uvolnění prostaglandinů [44]. Při těžké ischemii vedoucí k nekróze deciduy a následnému krvácení je spouštěcím mediátorem SPB trombin. Trombinové/antitrombinové komplexy jsou přítomny v plazmě a plodové vodě žen se SPB a PPROM [21]. Trombin stimuluje myometriální aktivitu [12] a produkci matrix metalloproteinázy-1 a aktivátorů plazminogenu s následnou degradací kolagenu typu III a fibronektinu [29, 49]. Tyto účinky trombinu vysvětlují vztah mezi výskytem retroplacentárních hematomů či krvácení v časném těhotenství a vyšším rizikem SPB [39].
Distenze dělohy
Dalším patologickým procesem vedoucím k SPB je děložní distenze. Z dosavadních studií vyplývá, že děložní distenze zvyšuje syntézu oxytocinového receptoru [40] a connexinu 43 [41] v myometriu. Současně bylo prokázáno, že tuto expresi je schopen blokovat progesteron [31]. Distenze myometria ovlivňuje i biochemické pochody v plodových obalech, ve kterých iniciuje zvýšení produkce kolagenázy, IL-8 a PGE2 [26, 33].
Stres
Stres aktivující mateřskou či fetální osu hypotalamus--hypofýza-nadledvina je důležitou příčinou předčasného porodu. Tento proces je zprostředkován placentárním CRH (corticotropin-releasing hormone). Psychický stres matky zvyšuje v její cirkulaci koncentrace kortizolu a adrenalinu, což vede k aktivaci placentární exprese CRH. Placentární CRH následně stimuluje fetální sekreci kortizolu a DHEA-S a placentární produkci estrogenů a prostaglandinů [20]. Chronická hypoxie plodu je také zásadním stresovým stavem, který je schopen předčasně aktivovat fetální osu hypotalamus-hypofýza-nadledvina a vést k rozvoji SPB.
Insuficience děložního hrdla
Je důsledkem kongenitální stigmatizace hrdla (hypoplazie) nebo chirurgického traumatu (konizace se ztrátou pojivové tkáně, traumatické porušení strukturální integrity hrdla po opakovaných dilatacích). Překvapivě je jen málo častou příčinou SPB. Klinické projevy cervikální insuficience jsou ve většině případů výsledkem předčasné cervikální remodelace způsobené jiným patologickým procesem. Jednou z příčin může být intrauterinní infekce, která byla prokázána u 50 % žen s klinickým obrazem akutní cervikální insuficience [47].
Imunologické mechanismy
U některých žen se SPB, u nichž nebyla prokazatelná infekce, bylo pozorováno zvýšení hladiny solubilního receptoru pro IL-2. Jeho elevace je považována za časnou známku rejekce transplantátu u pacientů po renální transplantaci. Rejekční reakce může být tudíž mechanismem uplatňujícím se v patogenezi předčasného porodu. Jiné studie svědčí i pro možnou roli alergické reakce typu I. Reakce na antigen ve svém důsledku může vést k degranulaci myometriálních mastocytů, jejichž produkty, jako histamin a prostaglandiny, jsou také schopny vyvolat děložní aktivitu [50].
BIOMARKERY A PŘEDČASNÝ POROD
Obecně je biomarker (marker nebo lépe a správněji ukazatel) veličina, kterou lze objektivně nejen změřit, ale i využít ke stanovení fyziologického děje, či naopak patologicky probíhajícího procesu. Biomarker může také sloužit k zjištění odpovědi na léčebnou intervenci. Z pohledu obecně biologického jde o molekulu (velká část má povahu proteinů), jejíž zastoupení, lépe ještě i kvantifikaci v cílovém zdroji (krev, plazma, plodová voda, cervikovaginální tekutina a jiné) lze stanovit nejčastěji využitím specifických monoklonálních protilátek (nejlépe za využití automatizovaných systémů, jako je např. ELISA, RIA a jiné). Je zřejmé, že dokonalý biomarker se 100% senzitivou a specificitou zatím bohužel neexistuje. V praxi použitelný ukazatel nicméně musí vykazovat alespoň tři základní předpoklady: dostatečnou citlivost, vysokou specificitu ke sledovanému onemocnění či patologickému procesu a velkou orgánovou/tkáňovou specifičnost. Optimální biomarker by navíc měl korelovat s rozsahem tkáňové či orgánové patologie a mít přijatelnou dynamiku v čase. Velmi důležitá je také možnost stanovení jeho cut off hodnoty. Nelze však opominout další, ne zcela nepodstatné vlastnosti důležité zejména pro kliniky, jako je snadná interpretace lékařem či ošetřujícím personálem, standardizace jeho stanovení a v neposlední řadě také cena. Bohužel většina používaných, event. potenciálních markerů výše uvedené podmínky nesplňuje. V případě předčasného porodu by optimální biomarker měl identifikovat s co největší senzitivitou a specificitou kohortu těhotných žen, jejichž těhotenství skončí předčasným porodem či pozdním potratem v II. trimestru těhotenství. Nelze očekávat, že tak komplexní patofyziologický proces, jakým předčasný porod bezesporu je, bude možné charakterizovat jedním unikátním proteinem. Spíše však půjde o panel sestavený z up - a down-regulovaných nebo posttranslačně modifikovaných proteinů, lišících se od normálního fyziologického stavu organismu [54].
NEJČASTĚJŠÍ PROTEOMICKÉ TECHNOLOGIE POUŽITÉ K IDENTIFIKACI BIOMARKERŮ SPB
Gelová dvourozměrná elektroforéza (2D-PAGE)
Nejstarší, avšak stále efektivní proteomickou technologií je dvojrozměrná polyakrylamidová elektroforéza (2D-PAGE), která rozděluje směs proteinů v gelové matrici nejprve na základě jejich izoelektrických bodů (pI) v první dimenzi a poté podle molekulových hmotností (MW) v druhém, kolmém směru. Tato kombinace umožňuje separaci s velmi vysokým rozlišením. Výsledkem je dvojrozměrná proteinová mapa, na které jsou proteiny detekovány za pomoci různých metod barvení. Identifikace proteinů separovaných na 2D-PAGE se provádí na hmotnostních spektrometrech. Vybrané proteinové skvrny („spoty“) jsou z gelu vyříznuty, proteolyticky štěpeny a výsledné peptidy jsou analyzovány hmotnostní spektrometrií (MS - mass spectrometry) s cílem identifikovat původní protein [54].
Proteinové profilování
MALDI–TOF-MS (matrix assisted laser desorption/ionization–time of flight–mass spectrometry)
Hmotnostní spektrometrie je založena na rozdělení nabitých částí podle jejich molekulových hmotností v elektrickém či magnetickém poli. K ionizaci vzorku se využívá laser. Je třeba zajistit efektivní a kontrolovaný přenos energie na vzorek, ale na druhou stranu i zabránit jeho tepelnému rozkladu. Pokud by byly molekuly vzorku ionizovány laserem přímo, docházelo by k jejich štěpení nežádoucím způsobem. Proto se využívá látky (matrice), jejímž prostřednictvím se ionizační energie laseru přenáší na molekulu vzorku, a tím brání jejich štěpení. Směs matrice a vzorku na vhodném nosiči (např. nerezové destičce) je zasažena pulsem laseru. Matrice energii pulsu absorbuje a její rozklad ionizuje molekuly vzorku. Ionty analyzované látky jsou urychleny silným elektrickým polem a vstupují do vakua trubice detektoru letu, kde se pohybují rychlostí danou jejich hmotností a nábojem. Zde je měřena doba letu částice, z níž se vypočte poměr molekulové hmotnosti a náboje částice (m/z) [54].
SELDI–TOF-MS (surface enhanced laser desorption/ionization – time of flight –mass spetrometry)
Spektra proteinů mohou někdy být příliš komplikovaná a není snadné v nich nalézt proteiny o velmi nízké koncentraci. Tyto obtíže se vyřešily implementací specifické prefrakcionace proteinů. Terčíky pro měření vzorků jsou pokryty specifickými chromatografickými sorbenty, které zachycují pouze cílové spektrum proteinů, přičemž vzorky v hmotnostním spektrometru jsou měřeny přímo z nich. Tato technologie je známa jako SELDI–TOF–MS. Univerzálnost této technologie spočívá v chemické interakci povrchu terčíku s analyzovaným materiálem. Tyto terčíky mohou být vyrobeny podle požadavku zákazníka, aby byly schopny vázat specifickou skupinu proteinu z analyzovaného vzorku. Následná analýza probíhá ve shodném principu s MALDI-TOF-MS [54].
„Shotgun“ proteomika
S rozvojem tandemové hmotnostní spektrometrie je spojen tzv. shotgun přístup. Tandemovou spektrometrii si lze představit jako dva spektrometry sériově spojené kolizní celou, ve které dochází k fragmentacím. Při shotgun technice je směs proteinů o různé komplexitě štěpena specifickou proteázou. Vzniklé peptidy jsou nejprve separovány a následně analyzovány tandemovým hmotnostním spektrometrem. Tyto dva systémy mohou být spojeny jak on-line, kdy kapilára z kapalinové chromatografie (LC) přímo ústí do ionizačního zdroje typu ESI (elektrosprej), nebo off-line pomocí sběrače frakcí. Tandemové uspořádání spektrometrů dovoluje nejprve změřit MS spektrum intaktních peptidů. V případě detekce peptidu splňujícího určité požadované parametry se tento peptidový prekurzor v hmotnostním spektrometru izoluje, v kolizní cele je podroben fragmentaci a vzniklé fragmenty poskytují MS/MS spektrum. Na základě dat získaných z MS a MS/MS spekter probíhá identifikace jednotlivých složek původní směsi proteinů. Hlavním cílem dřívějších proteomických studií byla především identifikace proteinů. Dnes se však stále více zaměřují na kvantitativní a komparativní analýzy, u kterých je potřeba určit a porovnat vzájemnou koncentraci proteinů v jednotlivých vzorcích [54].
METODIKA SYSTEMATICKÉHO PŘEHLEDU LITERATURY
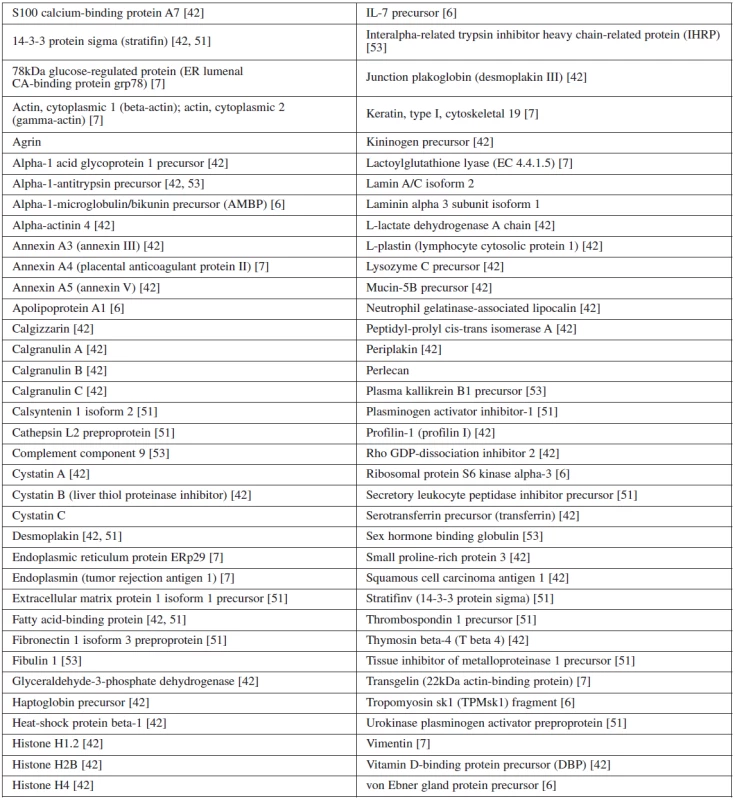
Systematický přehled literatury byl vytvořen třemi autory, kteří použili k vyhledání relevantních citací těchto databází: Scopus, Medline a PubMed. Při práci s databázemi byla v různých kombinacích použita tato klíčová slova: „preterm birth“, „preterm labor“, „preterm delivery“, „proteomic“, „proteomics“, „MALDI“, „SELDI“, „iTRAQ“ a „protein profiling“ za využití booleanských operátorů „AND“ a „OR“. Takto byl vytvořen seznam čítající 101 citačních odkazů, ze kterých bylo pouze 37 identifikováno jako vhodných a přiměřených tematice. Na podkladě vyhodnocení abstrakt těchto citací byla provedena finální selekce 16 vhodných prací. Ty byly získány ve fulltextové formě a pečlivě analyzovány [3–8, 11, 18, 22–23, 27, 38, 42, 51–53]. Pouze pět prací však obsahovalo data, jež bylo možné extrahovat a vytvořit z nich seznam potenciálních biomarkerů předčasného porodu [6–7, 42, 51, 53] získaných proteomickými technikami, viz tabulku 1. Všechny revidované práce byly v anglickém jazyce.
DISKUSE
Zdroje biomarkerů
Nebylo žádným překvapením, že ve vybraných pracích autoři používali k hledání potenciálních biomarkerů rozlišné tělní tekutiny i tkáně. Nejčastěji zastoupeným zdrojem (dvě práce) byla cervikovaginální tekutina.
Mateřská plazma/sérum
Zdroje možných proteinových markerů jsou velmi pestré, nejperspektivněji se jeví krev (plazma nebo sérum). Ta přichází do styku s většinou buněk těla a komunikuje i s buňkami patologicky postiženými. Z těchto buněk se v důsledku jejich odumírání, nespecifického či specifického uvolňování dostávají do cirkulující krve proteiny charakteristické pro daný patologický stav. Bohužel, vzhledem k velkému objemu krve je konečná koncentrace těchto diagnosticky zajímavých proteinů velmi nízká (řádově ng/mL). Navíc je lidská plazma velmi složitá směs proteinů a peptidů, milionů různých imunoglobulinových sekvencí a také proteinů pocházejících z bakterií, virů či jiných patogenů. Zásadním limitujícím aspektem použití mateřské plazmy/séra jako zdroje pro hledání nových biomarkerů je široký rozsah koncentrací proteinů v ní obsažených, odhadovaný na více než deset dekadických řádů, což v konečném důsledku vede k zastření diagnosticky zajímavých proteinů několika málo velmi vysoce zastoupenými proteiny (albumin, imunoglobuliny, transferin, antitrypsin a jiné), které dohromady tvoří až 95 % celkového množství proteinů zastoupených v plazmě [54].
Stella a kol. ve své práci použily vzorky sér 25 žen s následujícím rozložením: 5 netěhotných pacientek; 5 těhotných žen, které porodily předčasně; 5 pacientek s příznaky předčasného porodu, které porodily až v termínu porodu; 5 těhotných s příznaky dolores presagientes mezi 38. a 40. gestačním týdnem; 5 žen s pravidelnými kontrakcemi vedoucími k porodu mezi 38. a 40. týdnem těhotenství. Vzorky sér byly nejprve zbaveny vysoce zastoupených proteinů (albumin, imunoglobulin G, antitrypsin, IgA, transferin, haptoglobin a fibrinogen) a následně analyzovány třemi rozdílnými proteomickými technologiemi – SELDI-TOF-MS, MALDI-TOF-MS a 2D-PAGE. Jako potenciální biomarkery SPB byly autorkami identifikovány tyto proteiny: interalpha–related trypsin inhibitor heavy chain-related protein (IHRP), complement component 9, plasma kallikrein B1 precursor, alpha 1 antitrypsin precursor, jež byly up-regulovány, a také fibulin 1c, sex hormone binding globulin, které byly down-regulovány u pacientek s předčasným porodem [53].
Plodová voda
Plodová voda patří mezi velmi slibný zdroj biomarkerů, neboť reflektuje změny probíhající v kompartmentu mateřském, fetálním a fetomaternálním. Na druhou stranu je nutné respektovat fakt, že její odběr patří mezi invazivní výkony.
Bujold a kol. analyzovali plodovou vodu pacientek se SPB mezi 20. a 34. gestačním týdnem. Tuto kohortu rozdělili do tří skupin: pacientky, které porodily v termínu porodu bez přítomnosti intramniální infekce/zánětu (IAI); těhotné, které porodily předčasně (<37. gestační týden) bez přítomnosti IAI; ženy, které porodily předčasně (<37. gestační týden) se známkami přítomnosti IAI. Každá skupina zahrnovala 86 pacientek. Autoři použili tři rozdílné postupy k přípravě vzorků plodové vody (neupravený vzorek, vzorek zbavený nejvíce zastoupených proteinů a vzorek s přidaným redukčním agens ke zlepšení rozpustnosti). Jako analytické proteomické metody byly použity: 2D-PAGE, MALDI-TOF MS, SELDI-TOF MS, kapalinová chromatografie následovaná tandemovou hmotnostní spektrometrií (LC-MS/MS) a ESI-IT MS. V plodové vodě pacientek, které porodily v termínu bez přítomnosti IAI byly ve zvýšené míře syntetizovány tyto proteiny: von Ebner gland protein precursor, IL-7 precursor, apolipoprotein A1, tropomyosin sk1 fragment, ribosomal protein S6 kinase alpha 3 a alpha-1-microglobulin bikunin precursor. V plodové vodě pacientek s přítomností IAI, které porodily předčasně, byly up regulovány: fibrinopeptid B, transferin, major histocompatibility complex (MHC) class 1 chain–related A antigen fragment, transcription elongation factor A, sex-determining region Y (SRY) box 5 protein, DSCR2 a HP8. Pouze jeden protein, retinol binging protein, byl up-regulován v plodové vodě žen, které porodily předčasně bez přítomnosti IAI [6].
Cervikovaginální tekutina
Cervikovaginální tekutina (CVF) je komplexní směs sekretů z několika strukturálně a funkčně odlišných kompartmentů: pochvy, endocervixu, deciduy a amniochoria. Tato heterogenita může být na jednu stranu výhodou a CVF může sloužit jako zdroj cenných informací k monitorování mateřského a fetálního kompartmentu. V její neprospěch však hovoří právě její „komplexnost“, zdrojová heterogenita a také obtížná standardizace vzorku. Nezpochybnitelnou předností CVF je její velmi snadná dostupnost a minimální invazivita odběru (zejména ve srovnání s transabdominální amniocentézou). CVF jako potenciálního zdroje biomarkerů SPB porodu využil ve své práci Pereira a kol. Vzorky CVF byly odebrány pacientkám s fyziologicky probíhající graviditou mezi 16. a 37. týdnem, dále pacientkám s pravidelnou děložní aktivitou a progresí vaginálního nálezu mezi 16. a 37. týdnem gravidity, které však porodily v termínu porodu. Poslední skupinu tvořily pacientky se SPB mezi 16. a 37. týdnem gravidity. Vyloučeny byly pacientky se známkami klinické či histologické chorioamnionitidy či MIAC. Celkem bylo do studie zařazeno 18 pacientek (šest v každé skupině).
Vzorek CVF byl odebrán sterilní dakronovou štětičkou z oblasti zadní klenby poševní ve sterilních vaginálních zrcadlech před bimanuálním gynekologickým vyšetřením. Štětička byla v zadní klenbě ponechána po dobu 15 sekund. Analýza byla provedena pomocí 2D-PAGE a LC-MS/MS. V CVF bylo nalezeno celkem 205 unikátních proteinů. Srovnáním vzorků fyziologických těhotných se vzorky od pacientek se známkami předčasného porodu, které porodily v termínu, bylo nalezeno 21 proteinů se statisticky významným rozdílným zastoupením. Rozdíly se pohybovaly od 28násobného zvýšení do 18násobného snížení. Osm proteinů: S100 calcium-binding protein A7, mucin-5B precursor, calgizzarin, histone H2B, histone H1.2, L-lactate dehydrogenace A chain, rho GDP-dissociation inhibitor 2 a 14-3-3 protein sigma bylo 3krát a více up-regulováno u pacientek se známkami předčasného porodu a porodem v termínu. Pouze tři proteiny: desmoplakin, periplakin a junction plakoglobin byly v této skupině signifikantně down-regulovány oproti termínovým kontrolám. Celkem 30 proteinů s rozdílnou intenzitou zastoupení bylo nalezeno porovnáním vzorků pacientek se SPB a kontrolní skupinou. Sedm proteinů: α-1-antitrypsin precursor, calgranulin C, annexin A5, rho GDP-dissociation inhibitor 2, vitamin D binding protein precursor, α-1-acid glykoprotein precurosr a L-plastin bylo up-regulováno více než 3krát u pacientek se SPB. Šest proteinů bylo naopak více než 3krát down-regulováno: desmoplakin, peptidyl-prolyl cis-trans isomerie A, junction plakoglobin, heat shock protein β-1, periplakin a epidermal binding protein. Při srovnání vzorků pacientek se SPB s těmi se symptomy předčasného porodu, ale porodem v termínu bylo nalezeno 25 signifikantně dysregulovaných proteinů. Čtyři proteiny: α‑1-antitrypsin precursor, calgranulins C, alexin A5 a kinninogen byly u pacientek se SPB up-regulované více než 3krát. Osm proteinů: S100 calcium–binding protein A7, 14-3-3 protein sigma, histone H2B, peptidyl-prolyl cis-trans-isomerase A, L-lactate dehydrogenace A chain, histone H1.2, histone H4 a cystatin B bylo u těchto pacientek více než 3krát down-regulováno.
Neobvyklý přístup ve své recentní práci použil Shah a kol. Nejprve in vitro stanovili sekretom endocervikálních (End1) a vaginálních (Vk2) epiteliálních buněk. Secernované proteiny z obou buněčných linií byly identifikovány pomocí LC-MS/MS. Celkem bylo identifikováno ve třech replikátech 1211 proteinů. Pro všechny tři replikáty bylo společných 236 proteinů. Seznam těchto proteinů byl porovnán s již publikovanými studiemi zabývajícími se vztahem proteinů identifikovaných v lidské CVF, plodové vodě či tkáni děložní stěny k předčasnému porodu. Na podkladě těchto studií byl vytvořen seznam tvořený patnácti relevantními proteiny. Vzorky CVF byly získány od těhotných žen, které si odebraly vzorek samy dakronovou štětičkou v průběhu rutinní prenatální poradny mezi 24. a 28. týdnem gravidity. Z kohorty 2100 pacientek byly pak náhodně vybrány vzorky pěti žen, které porodily předčasně mezi 28. a 32. gestačním týdnem a kontrolní vzorky pěti žen, které porodily až po dokončeném 37. týdnu. Peptidy vybraných patnácti relevantních proteinů byly ve vzorcích CVF kvantifikovány pomocí LC-MRM/MS. U pacientek se SPB byly up-regulovány ve srovnání s kontrolními vzorky tyto proteiny: desmoplakin isoform 1, stratifin, thrombospondin 1 precursor, fatty acid binding protein 5, extracellular matrix protein 1 isoform 1 precursor, secretory leukocyte peptidase inhibitor precursor a plasminogen activator inhibitor 1 a down-regulovány tyto proteiny: fibronectin 1 isoform preprotein, urokinase plasminogen activator preprotein, cathepsin L2 preprotein, tissuer inhibitor of metalloproteinases 1 precursor a calsyntetin 1 isoform. Hladiny cystatin C precursor byly stejné v obou skupinách. Hladiny laminin alpha 3 subunit isoform 1 a lamin A/C isoform 2 byly pod detekčním limitem u obou skupin vzorků. Statisticky významně up-regulovány u pacientek s SPB byly pouze: desmoplakin isoform 1 (70krát), stratifin (42,4krát) a thrombospondin 1 precursor (5,1krát) [51].
Placenta/plodové obaly
Tkáňová analýza přináší trochu jiný pohled na problematiku biomarkerů předčasného porodu, neboť tkáň je konkrétním zdrojem ukazatelů, které jsou pak následně detekovány v tekutinách. Biomarkery identifikované tímto tkáňovým přístupem jsou pak v dalším kroku testovány ve výše zmíněných tělních tekutinách za využití protilátek (ELISA, Western blot) či jiných metod. Tento přístup zvolili Butt a kol. Použili vzorky placent 4 pacientek se SPB mezi 25. a 32. gestačním týdnem a od 3 pacientek s porodem v termínu. K separaci proteinů a analýze byla využita 2D-PAGE následována analýzou hmotnostním spektrometrem. Poté byly porovnány proteomické mapy placentárních vzorků SPB pacientek s mapami vzorků pacientek s termínovým porodem. Autoři nalezli celkem 56 rozdílně zastoupených proteinů, přičemž jedenáct z nich byly unikátní proteiny přítomné či nepřítomné ve vzorcích placent SPB pacientek. Zbývajících 45 proteinů bylo detekováno v obou skupinách, ale byly signifikantně dysregulované. Jedenáct unikátních proteinů bylo zařazeno do různých funkčních tříd (kategorií). Většinu z identifikovaných proteinů bylo možné zařadit do skupiny strukturálních a cytoskeletálních komponent. Další zastoupenou skupinou byly proteiny endoplazmatického retikula s enzymatickou funkcí či proteiny fungující jako chaperony. Do této skupiny patřily proteiny podílející se na enzymatické či posttranslační úpravě jiných proteinů jako ERp29, endoplasmin/tumor rejection antigen, 78kDa glukose regulated protein a lactoylglutathione lyase [7]. Poslední třídu tvořily proteiny s antikoagulačními vlastnostmi. Hlavní roli v této skupině zaujímá annexin IV (běžněji je znám pod označením placentární antikoagulační faktor II), který se podílí na inhibici zevní a vnitřní koagulační kaskády. Alterace annexinu IV u SPB svědčí o porušení placentárních antikoagulačních mechanismů.
ZÁVĚR
Problematika předčasného porodu je oblast porodnictví, do které je nezbytné implementovat nové poznatky získané moderními „-mics“ přístupy. Jedna z možností aplikace proteomiky do současného porodnictví je oblast identifikace biomarkerů spontánního předčasného porodu. Této problematice se věnovalo v recentním písemnictví šestnáct vědeckých článků. Analyzovány byly jak tělní tekutiny (krev, plodová voda, cervikovaginální tekutina), tak placentární tkáň. Z pěti publikovaných prací bylo možno extrahovat data a vytvořit seznam 72 proteinů. Tyto proteiny mohou být po provedení validačních a verifikačních analýz použity k vytvoření panelu potenciálních biomarkerů SPB.
Vznik této práce byl podpořen grantem MŠMT ME 10025.
MUDr. Ivana Musilová
Porodnická a gynekologická klinika
FN a LF Hradec Králové
Sokolská 581
500 05 Hradec Králové
Zdroje
1. Arias, F., Rodriquez, L., Rayne, SC., Kraus, FT. Maternal placental vasculopathy and infection: two distinct subgroups among patients with preterm labor and preterm ruptured membranes. Am J Obstet Gynecol, 1993, 168, p. 585-591.
2. Bell, SC., Pringle, JH., Taylor, DJ., Malak, TM. Alternatively spliced tenascin-C mRNA isoforms in human fetal membranes. Mol Hum Reprod, 1999, 5, p. 1066-1076.
3. Buhimschi, CS., Rosenberg, VA., Dulay, AT., et al. Multidimensional system biology: genetic markers and proteomic biomarkers of adverse pregnancy outcome in preterm birth. Am J Perinatol, 2008, 25, p. 175-187.
4. Buhimschi, CS., Weiner, CP., Buhimschi, IA. Proteomics, part II: the emerging role of proteomics over genomics in spontaneous preterm labor/birth. Obstet Gynecol Surv, 2006, 61, p. 543-553.
5. Buhimschi, IA., Buhimschi, CS. Proteomics of the amniotic fluid in assessment of the placenta. Relevance for preterm birth. Placenta, 2008, 29 Suppl. A, S95-101.
6. Bujold, E., Romero, R., Kusanovic, JP., et al. Proteomic profiling of amniotic fluid in preterm labor using two-dimensional liquid separation and mass spectrometry. J Matern Fetal Neonatal Med, 2008, 21, p. 697-713.
7. Butt, RH., Lee, MW., Pirshahid, SA., et al. An initial proteomic analysis of human preterm labor: placental membranes. J Proteome Res, 2006, 5, p. 3161-3172.
8. Cobo, T., Palacio, M., Navarro-Sastre, A., et al. Predictive value of combined amniotic fluid proteomic biomarkers and interleukin-6 in preterm labor with intact membranes. Am J Obstet Gynecol, 2009, 200, p. 499 e491-496.
9. Combs, CA., Katz, MA., Kitzmiller, JL., Brescia, RJ. Experimental preeclampsia produced by chronic constriction of the lower aorta: validation with longitudinal blood pressure measurements in conscious rhesus monkeys. Am J Obstet Gynecol, 1993, 169, p. 215-223.
10. Cook, JL., Zaragoza, DB., Sung, DH., Olson, DM. Expression of myometrial activation and stimulation genes in a mouse model of preterm labor: myometrial activation, stimulation, and preterm labor. Endocrinology, 2000, 141, p. 1718-1728.
11. Dasari, S., Pereira, L., Reddy, AP., Michaels, JE., et al. Comprehensive proteomic analysis of human cervical-vaginal fluid. J Proteome Res, 2007, 6, p. 1258-1268.
12. Elovitz, MA., Saunders, T., Ascher-Landsberg, J., Phillippe, M. Effects of thrombin on myometrial contractions in vitro and in vivo. Am J Obstet Gynecol, 2000, 183, p. 799-804.
13. Fortunato, SJ., Menon, R., Lombardi, SJ. Support for an infection-induced apoptotic pathway in human fetal membranes. Am J Obstet Gynecol, 2001, 184, p. 1392-1397; discussion p. 1397-1398.
14. Garfield, RE., Daniel, EE., Dukes, M., Fitzgerald, JD. Changes of gap junctions in myometrium of guinea pig at parturition and abortion. Can J Physiol Pharmacol, 1982, 60, p. 335-341.
15. Garfield, RE., Hayashi, RH. Appearance of gap junctions in the myometrium of women during labor. Am J Obstet Gynecol, 1981, 140, p. 254-260.
16. Goldenberg, RL., Goepfert, AR., Ramsey, PS. Biochemical markers for the prediction of preterm birth. Am J Obstet Gynecol, 2005, 192, p. S36-S46.
17. Goncalves, LF., Chaiworapongsa, T., Romero, R. Intrauterine infection and prematurity. Ment Retard Dev Disabil Res Rev, 2002, 8, p. 3-13.
18. Gravett, MG., Thomas, A., Schneider, KA., et al. Proteomic analysis of cervical-vaginal fluid: identification of novel biomarkers for detection of intra-amniotic infection. J Proteome Res, 2007, 6, p. 89-96.
19. Hill, WC. A guest editorial: where are we now in screening patients for preterm delivery? Obstet Gynecol Surv, 2002, 57, p. 133-135.
20. Hobel, CJ., Dunkel-Schetter, C., Roesch, SC., et al. Maternal plasma corticotropin-releasing hormone associated with stress at 20 weeks’ gestation in pregnancies ending in preterm delivery. Am J Obstet Gynecol, 1999, 180, p. S257-S263.
21. Chaiworapongsa, T., Espinoza, J., Yoshimatsu, J., et al. Activation of coagulation system in preterm labor and preterm premature rupture of membranes. J Matern Fetal Neonatal Med, 2002, 11, p. 368-373.
22. Cho, CK., Shan, SJ., Winsor, EJ., Diamandis, EP. Proteomics analysis of human amniotic fluid. Mol Cell Proteomics, 2007, 6, p. 1406-1415.
23. Choolani, M., Narasimhan, K., Kolla, V., Hahn, S. Proteomic technologies for prenatal diagnostics: advances and challenges ahead. Expert Rev Proteomics, 2009, 6, p. 87-101.
24. Chwalisz, K., Fahrenholz, F., Hackenberg, M., et al. The progesterone antagonist onapristone increases the effectiveness of oxytocin to produce delivery without changing the myometrial oxytocin receptor concentrations. Am J Obstet Gynecol, 1991, 165, p. 1760-1770.
25. Iams, JD., Casal, D., McGregor, JA., et al. Fetal fibronectin improves the accuracy of diagnosis of preterm labor. Am J Obstet Gynecol, 1995, 173, p. 141-145.
26. Kanayama, N., Fukamizu, H. Mechanical stretching increases prostaglandin E2 in cultured human amnion cells. Gynecol Obstet Invest, 1989, 28, p. 123-126.
27. Klein, LL., Jonscher, KR., Heerwagen, MJ., et al. Shotgun proteomic analysis of vaginal fluid from women in late pregnancy. Reprod Sci, 2008, 15, p. 263-273.
28. Leitich, H. Controversies in diagnosis of preterm labour. BJOG, 2005, 112, Suppl. 1, p. 61-63.
29. Lockwood, CJ., Krikun, G., Aigner, S., Schatz, F. Effects of thrombin on steroid-modulated cultured endometrial stromal cell fibrinolytic potential. J Clin Endocrinol Metab, 1996, 81, p. 107-112.
30. Lockwood, CJ., Senyei, AE., Dische, MR., et al. Fetal fibronectin in cervical and vaginal secretions as a predictor of preterm delivery. N Engl J Med, 1991, 325, p. 669-674.
31. Lye, SJ., Mitchell, J., Nashman, N., Oldenhof, A., et al. Role of mechanical signals in the onset of term and preterm labor. Front Horm Res, 2001, 27, p. 165-178.
32. Lye, SJ., Nicholson, BJ., Mascarenhas, M., et al. Increased expression of connexin-43 in the rat myometrium during labor is associated with an increase in the plasma estrogen:progesterone ratio. Endocrinology, 1993, 132, p. 2380-2386.
33. Maehara, K., Kanayama, N., Maradny, EE., et al. Mechanical stretching induces interleukin-8 gene expression in fetal membranes: a possible role for the initiation of human parturition. Eur J Obstet Gynecol Reprod Biol, 1996, 70, p. 191-196.
34. Malak, TM., Bell, SC. Structural characteristics of term human fetal membranes: a novel zone of extreme morphological alteration within the rupture site. Br J Obstet Gynaecol, 1994, 101, p. 375-386.
35. Malak, TM., Mulholland, G., Bell, SC. Morphometric characteristics of the decidua, cytotrophoblast, and connective tissue of the prelabor ruptured fetal membranes. Ann N Y Acad Sci, 1994, 734, p. 430-432.
36. McLaren, J., Malak, TM., Bell, SC. Structural characteristics of term human fetal membranes prior to labour: identification of an area of altered morphology overlying the cervix. Hum Reprod, 1999, 14, p. 237-241.
37. Menon, R. Spontaneous preterm birth, a clinical dilemma: etiologic, pathophysiologic and genetic heterogeneities and racial disparity. Acta Obstet Gynecol Scand, 2008, 87, p. 590-600.
38. Michaels, JE., Dasari, S., Pereira, L., et al. Comprehensive proteomic analysis of the human amniotic fluid proteome: gestational age-dependent changes. J Proteome Res, 2007, 6, p. 1277-1285.
39. Nagy, S., Bush, M., Stone, J., et al. Clinical significance of subchorionic and retroplacental hematomas detected in the first trimester of pregnancy. Obstet Gynecol, 2003, 102, p. 94-100.
40. Ou, CW., Chen, ZQ., Qi, S., Lye, SJ. Increased expression of the rat myometrial oxytocin receptor messenger ribonucleic acid during labor requires both mechanical and hormonal signals. Biol Reprod, 1998, 59, p. 1055-1061.
41. Ou, CW., Orsino, A., Lye, SJ. Expression of connexin-43 and connexin-26 in the rat myometrium during pregnancy and labor is differentially regulated by mechanical and hormonal signals. Endocrinology, 1997, 138, p. 5398-5407.
42. Pereira, L., Reddy, AP., Jacob, T., et al. Identification of novel protein biomarkers of preterm birth in human cervical-vaginal fluid. J Proteome Res, 2007, 6, p. 1269-1276.
43. Pinto, RM., Rabow, W., Vtta, RA. Uterine Cervix Ripening in term pregnancy due to the action of estradiol-17-beta. A histological and histochemical study. Am J Obstet Gynecol, 1965, 92, p. 319-324.
44. Poisner, AM. The human placental renin-angiotensin system. Front Neuroendocrinol, 1998, 19, p. 232-252.
45. Rajabi, MR., Dodge, GR., Solomon, S., Poole, AR. Immunochemical and immunohistochemical evidence of estrogen-mediated collagenolysis as a mechanism of cervical dilatation in the guinea pig at parturition. Endocrinology, 1991, 128, p. 371-378.
46. Romero, R., Durum, S., Dinarello, CA., et al. Interleukin-1 stimulates prostaglandin biosynthesis by human amnion. Prostaglandins, 1989, 37, p. 13-22.
47. Romero, R., Gonzalez, R., Sepulveda, W., et al. Infection and labor. VIII. Microbial invasion of the amniotic cavity in patients with suspected cervical incompetence: prevalence and clinical significance. Am J Obstet Gynecol, 1992, 167, p. 1086-1091.
48. Romero, R., Salafia, CM., Athanassiadis, AP., et al. The relationship between acute inflammatory lesions of the preterm placenta and amniotic fluid microbiology. Am J Obstet Gynecol, 1992, 166, p. 1382-1388.
49. Rosen, T., Schatz, F., Kuczynski, E., et al. Thrombin-enhanced matrix metalloproteinase-1 expression: a mechanism linking placental abruption with premature rupture of the membranes. J Matern Fetal Neonatal Med, 2002, 11, p. 11-17.
50. Rudolph, MI., Reinicke, K., Cruz, MA., et al. Distribution of mast cells and the effect of their mediators on contractility in human myometrium. Br J Obstet Gynaecol, 1993, 100, p. 1125-1130.
51. Shah, SJ., Yu, KH., Sangar, V., et al. Identification and quantification of preterm birth biomarkers in human cervicovaginal fluid by liquid chromatography/tandem mass spectrometry. J Proteome Res, 2009, 8, p. 2407-2417.
52. Shankar, R., Cullinane, F., Brennecke, SP., Moses, EK. Applications of proteomic methodologies to human pregnancy research: a growing gestation approaching delivery? Proteomics, 2004, 4, p. 1909-1917.
53. Stella, CL., Bennett, MR., Devarajan, P., et al. Preterm labor biomarker discovery in serum using 3 proteomic profiling methodologies. Am J Obstet Gynecol, 2009, 201, p. 387 e381-313.
54. Tambor, V., Fucikova, A., Lenco, J., et al. Application of proteomics in biomarker discovery: a primer for the clinician. Physiol Res, 2010, 59, p. 471-497.
55. Uldbjerg, N., Ekman, G., Malmstrom, A., et al. Ripening of the human uterine cervix related to changes in collagen, glycosaminoglycans, and collagenolytic activity. Am J Obstet Gynecol, 1983, 147, p. 662-666.
56. Wen, SW., Smith, G., Yang, Q., Walker, M. Epidemiology of preterm birth and neonatal outcome. Semin Fetal Neonatal Med, 2004, 9, p. 429-435.
57. Williams, MC., O’Brien, WF., Nelson, RN., Spellacy, WN. Histologic chorioamnionitis is associated with fetal growth restriction in term and preterm infants. Am J Obstet Gynecol, 2000, 183, p. 1094-1099.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2011 Číslo 1
-
Všechny články tohoto čísla
- Prognóza úrovně perinatální péče v České republice do nejbližší budoucnosti II. Z pohledu Světové zdravotnické organizace
- Prognóza vývoje perinatální medícíny v České republice do nejbližší budoucnosti III. Z pohledu současného rozvoje medicíny
- Analýza perinatologických výsledkov Slovenskej republiky v rokoch 2007–2009
- Perinatologické výstupy Žilinského kraja Slovenskej republiky za 10ročné obdobie (2000–2009)
- Česká perinatologie v budoucnosti
- Proteomika a biomarkery předčasného porodu: systematický přehled literatury
- Prognóza úrovně perinatální péče v České republice do nejbližší budoucnosti I. Z pohledu vývoje ukazatelů v ČR
- Vrozená imunita v patogenezi intraamniální infekce u těhotenství komplikovaného předčasným odtokem plodové vody
- Stanovení reziduálního cytogenetického rizika v prenatální diagnostice při nahrazení tradičního karyotypování cílenými molekulárními testy určenými k rychlé detekci aneuploidií – retrospektivní studie
- Vede užívání psychotropních látek k rizikovému sexuálnímu chování?
- Poruchy ženské sexuální touhy – prevalence, klasifikace a možnosti terapie
- Poruchy ženské sexuální touhy - prevalence, klasifikace a možnosti terapie
- Efektivita léčby recidivující stresové inkontinence moči pomocí transobturatorní pásky po selhání kolposuspenze podle Burche
- Fatální průběh neonatální infekce citrobakterem a jeho právní posouzení
- Úhrada podání humánního imunoglobulinu anti-D v souvislosti s prováděním prevence RhD aloimunizace u RhD negativních žen
- Prevence tvorby adhezí a jejich léčba
- Stanovisko ESHG k DTC (direct-to-consumer) genetickému testování pro zdravotní účely
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Vede užívání psychotropních látek k rizikovému sexuálnímu chování?
- Fatální průběh neonatální infekce citrobakterem a jeho právní posouzení
- Prevence tvorby adhezí a jejich léčba
- Poruchy ženské sexuální touhy – prevalence, klasifikace a možnosti terapie
