Zachování fertility u žen s karcinomem prsu před gonadotoxickou léčbou
Fertility preserving methods in women with breast cancer before gonadotoxic therapy
Objective:
To present current options and own experiences with ovarian stimulation in young women with breast cancer before gonadotoxic therapy.
Design:
Review article with own experiencies.
Methods:
Literary search, analysis of own experiences with complex therapy in women with breast cancer planning pregnancy, definitions of stimulating protocols, using methods of assisted reproduction.
Setting:
Department of Obstetrics and Gynecology, Faculty of Medicine, Masaryk University and University Hospital Brno.
Results:
Embryo and oocyte cryopreservation are important methods of fertility preservation requiring controlled ovarian stimulation before the start of chemotherapy. Current studies demonstrante effectivenes of this special stimulating protocol and did not find negative side effects such a progression of the breast cancer. Since January 2016 to June 2016 we performed controlled ovarian stimulation and oocyte retrieval in three patients with breast cancer before chemotherapy. We used short stimulation protocol with recombinant FSH, GnRH agonists and letrozole and retrieved 13, 12 and 9 oocytes. We cryopreserved 8 and 6 embryos, one woman prefered freezing of 12 oocytes. During the stimulation estradiol level did not exceed 1,6 nmol/l.
Conclusion:
Neither the normal nor the cancerous cells in the breast react to the gonadotropins FSH, LH, nor to hCG. Conversely, there is a cellular proliferation and an increase in cancer cell lines with oestrogen receptors with exposure to oestrogen, and it is dose – dependent. The special stimulation protocol with FSH, GnRH agonists and letrozole is effective in gain of efficient amount of gamets with minimal increase of estradiole level. Current study reviews did not find higher risk of progression of breast cancer in association with ovarian stimulation. It is important to respect the recomendation of oncology committee and to effectively suppress the estradiol level.
Keywords:
breast cancer, cryopreservation, chemotherapy, letrozole, oncofertility, ovarian stimulation
Autoři:
N. Halászová; I. Crha
; Martin Huser
; Vít Weinberger
; J. Žáková; M. Ješeta; E. Lousová; E. Filipinská; P. Ventruba
Působiště autorů:
Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA
Vyšlo v časopise:
Ceska Gynekol 2017; 82(4): 287-292
Souhrn
Cíl studie:
Prezentovat současné možnosti ovariální stimulace u žen s karcinomem prsu před gonadotoxickou léčbou.
Typ studie:
Literární přehled s vlastním pozorováním.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika Lékařské fakulty Masarykovy Univerzity a FN Brno.
Metodika:
Literární rešerše, rozbor vlastních zkušeností s komplexní léčbou karcinomu prsu u mladých žen plánujících graviditu, definice stimulačních protokolů a využití metod asistované reprodukce.
Výsledky:
Důležitou součástí zachování fertility žen před chemoterapií je kontrolovaná ovariální stimulace. Dostupné studie prokázaly efektivitu tohoto postupu bez negativního vlivu na progresi karcinomu prsu. V období od ledna do června 2016 jsme na našem pracovišti provedli ovariální stimulaci a odběr oocytů u tří pacientek s karcinomem prsu před zahájením chemoterapie. Byl použit krátký protokol s agonisty GnRH, recFSH a letrozolem.
Bylo získáno 13, 12 a 9 oocytů, zamraženo bylo dvanáct oocytů, osm a šest embryí. V průběhu stimulace hladina estradiolu nepřevýšila 1,6 nmol/l.
Závěr:
Zdravé ani nádorové buňky v prsu nereagují na gonadotropiny FSH, LH ani na hCG. K buněčné proliferaci dochází u řady buněk s estrogenními receptory po expozici estrogenu v závislosti na dávce. Stimulační protokol s GnRH agonisty a letrozolem je efektivní pro zisk dostatečného počtu gamet a s minimálním zvýšením estradiolu. Literární rešerše neprokázala zvýšení rizika ve smyslu progrese karcinomu prsu v souvislosti s ovariální stimulací. Je nutné respektovat doporučení onkologické komise neprodlužovat čas do zahájení chemoterapie a účinně blokovat vzestup estrogenů při stimulaci.
Klíčová slova:
chemoterapie, karcinom prsu, kryoprezervace, letrozol, onkofertilita, ovariální stimulace
ÚVOD
Karcinom prsu je nejčastějším zhoubným nádorem u žen. Incidence onemocnění stále narůstá. Naopak mortalita od poloviny 90. let stagnuje, až mírně klesá. V roce 2014 dosáhl počet nově diagnostikovaných zhoubných nádorů prsu u žen v České republice počtu 7008. To představuje více než 130 nádorů na 100 000 žen. V roce 2014 zemřelo na karcinom prsu 581 žen, což je téměř 36 úmrtí na 100 000 žen. Při stále rostoucí incidenci karcinomu prsu a stagnující či mírně klesající mortalitě na něj je nevyhnutelným důsledkem zvyšování prevalence, tedy počtu žijících žen, u kterých byl v minulosti diagnostikován a léčen karcinom prsu. Nejvíce zhoubných nádorů prsu je diagnostikovaných ve věkové kategorii 60–69 let, ale více než 37 % žen je v reprodukčním věku [6]. Současný společenský trend odkládání mateřství do vyššího věku zvyšuje pravděpodobnost poruchy plodnosti již v době nutné léčby karcinomu. K jednotlivým modalitám léčby patří chirurgie, radioterapie, systémová léčba chemoterapií, hormonální léčba a cílená biologická léčba [10, 18].
Asi 80 % karcinomů prsů exprimuje estrogenní receptory, tyto ženy musí podstoupit léčbu tamoxifenem nebo inhibitory aromatázy trvající až 10 let. Vzhledem k tomu, že těhotenství je v době léčby tamoxifenem kontraindikováno, tento nucený odklad způsobí pokles ovariální zásoby ovlivněný jednak věkem, jednak gonadotoxickou chemoterapií, a to i přes simultánní snahu o protekci ovarií během chemoterapie pomocí GnRH analog [12]. To vše zvyšuje riziko vzniku předčasného ovariálního selhání (POF) se všemi důsledky, jako jsou sterilita a předčasná menopauza s rozvojem neurovegetativního klimakterického syndromu. Dochází k výraznému snížení kvality života, pacientky jsou ohroženy předčasně vznikem osteopenie, osteoporózy a rozvojem kardiovaskulárních chorob.
Riziko POF po léčbě chemoterapií se pohybuje v rozmezí od 10 do 95 % a koreluje s věkem pacientky, typem a kumulativní dávkou chemoterapie. Mezi nejvíce gonadotoxická chemoterapeutika patří alkylační činidla a v léčbě karcinomu prsu se jedná o cyklofosfamid [8]. Chemoterapeutika vykazující střední gonadotoxicitu jsou karboplatina, adriamycin a taxany. Nízce gonadotoxické preparáty jsou vinorelbin, kapecitabin a 5-fluorouracil. Kombinace chemoterapeutik cyklofosfamid, doxorubicin (adriamycin) a fluorouracil (CAF) je výrazně gonadotoxická, u pacientek ve věku vyšším než 40 let vyvolá POF u 80 % z nich. Naopak u pacientek ve věku nižším než 30 let je při stejném chemoterapeutickém režimu riziko POF jen 20 % [8]. Chemoterapie působí toxicky na ovariální tkáň několika mechanismy. Jedná se o přímou apoptózu primordiálních folikulů, zvýšenou aktivaci primordiálních folikulů následovanou jejich deplecí, poškození stromatu vaječníku a angiotoxický účinek chemoterapie. Tím dojde nepřímo ke ztrátě primordiálních folikulů.
Důležitou součástí komplexní péče o tyto ženy plánující těhotenství je nabídnout a zajistit zachování fertility. Mezi postupy zachovávající fertilitu při současné indikaci gonadotoxické chemoterapie u pacientek ve fertilním věku patří, mimo simultánní aplikaci GnRH analog k chemoterapii, hlavně kryokonzervace embryí, kryokonzervace oocytů v metafázi II [1] a kryokonzervace ovariální tkáně, která je zatím na experimentální úrovni [5, 15, 18]. Cílem práce je stručně prezentovat přehled současných možností a našich vlastních zkušeností s ovariální stimulací žen s karcinomem prsu po operaci a před podáním chemoterapie.
VLASTNÍ POZOROVÁNÍ
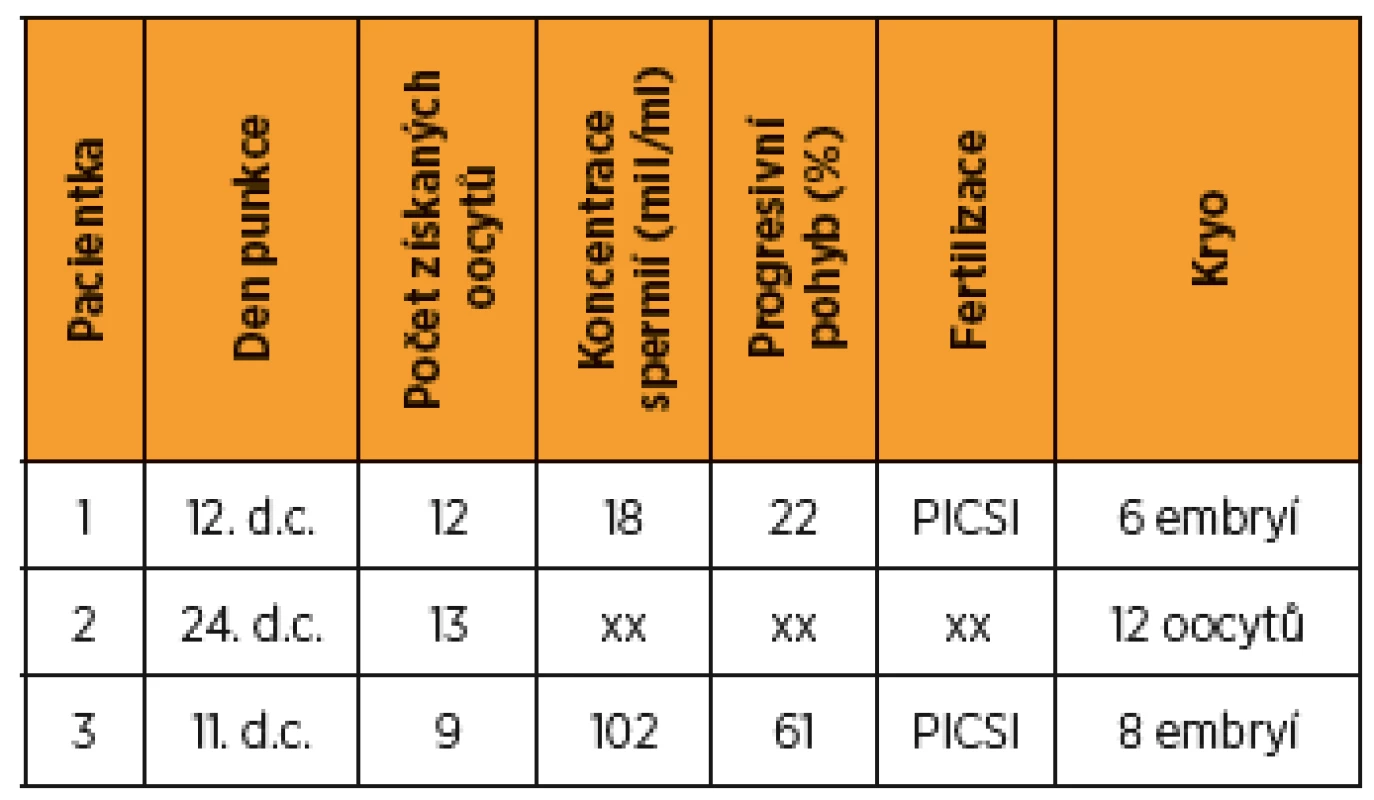
V období od ledna do června 2016 jsme na našem pracovišti provedli ovariální stimulaci a odběr oocytů u tří pacientek s karcinomem prsu před zahájením chemoterapie. Byl použit krátký protokol s agonisty GnRH, recFSH a letrozolem. Tímto protokolem bylo získáno 13, 12 a 9 oocytů, zamraženo 12 oocytů, 8 a 6 embryí. V průběhu stimulace hladina estradiolu nepřevýšila 1,6 nmol/l.
Pacientka 1
Věk 28 let. Z anamnézy: otec měl rakovinu tlustého střeva v 50 letech, léčena se štítnou žlázou asi pět let, bez operací, alergií. Menarche od 12 let, cyklus pravidelný 28/5 dnů, nuligravida, uživatelka kombinované hormonální antikoncepce od 20 do 23 let.
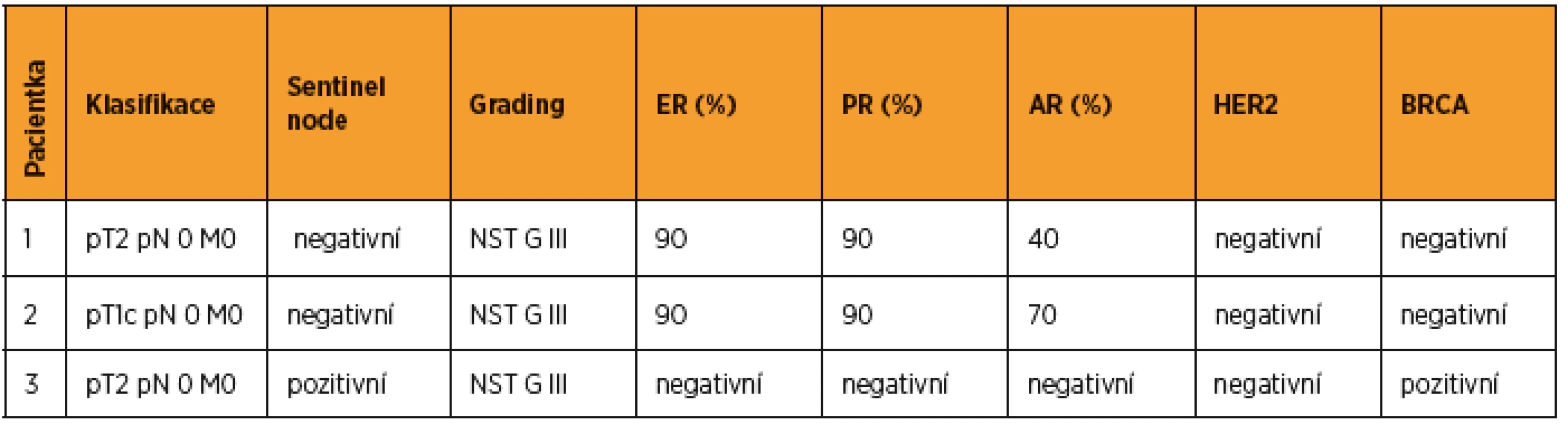
Pro rezistenci v pravém prsu bylo u pacientky provedeno UZ vyšetření a biopsie. Klasifikace a popis nádoru obsahuje tabulka 1, provedená stagingová vyšetření byla bez průkazu metastáz. V mamární komisi byl indikován výkon „skinsparing“ mastectomia l. dx. s inzercí expanderu a biopsií sentinelové uzliny v pravé axile. Operační výkon proběhl bez komplikací, sentinelová uzlina bez metastatického postižení. Na základě uvedených výsledků byla indikována systémová léčba hormonoterapie a adjuvantní chemoterapie v režimu ACT, adjuvantní radioterapie nebyla indikována.
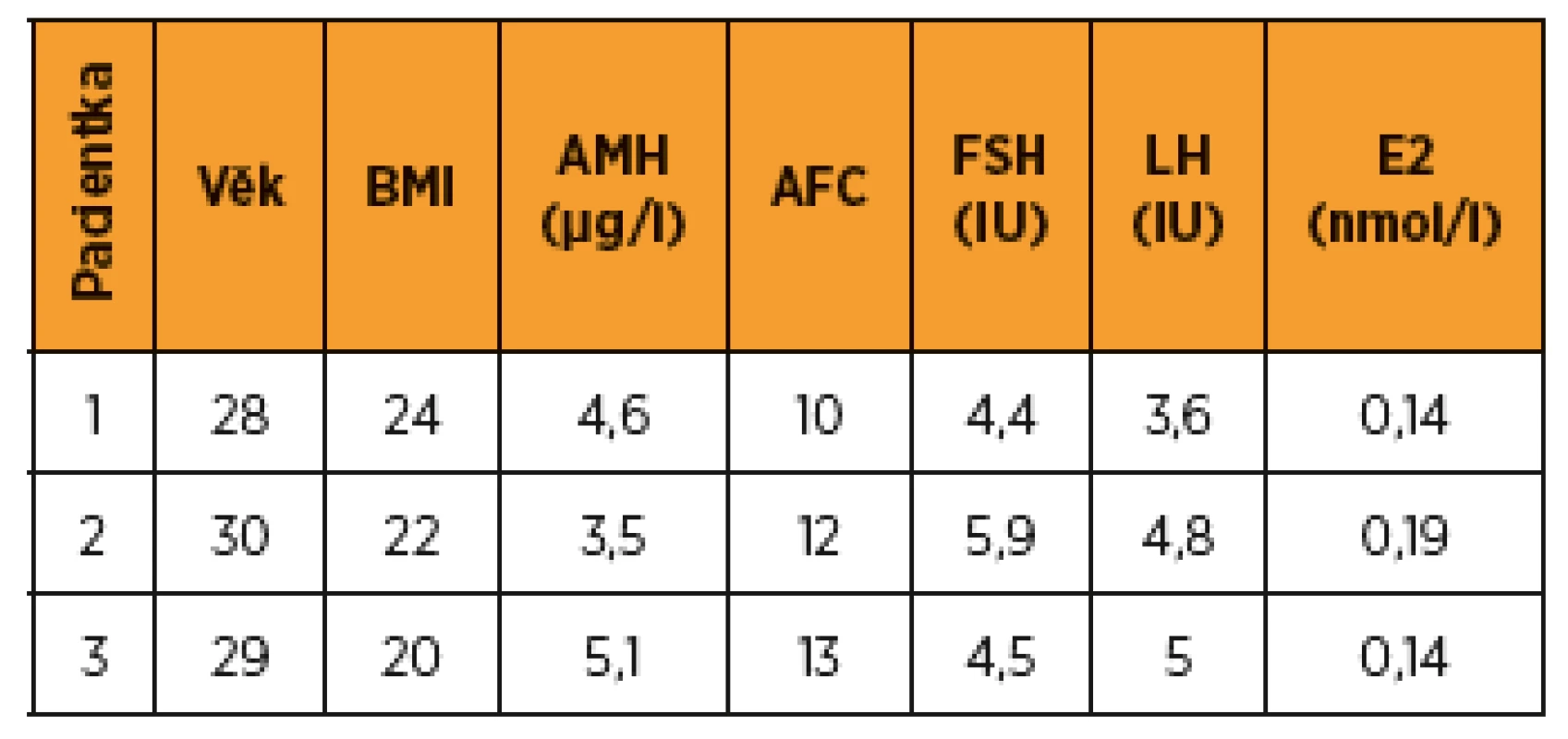
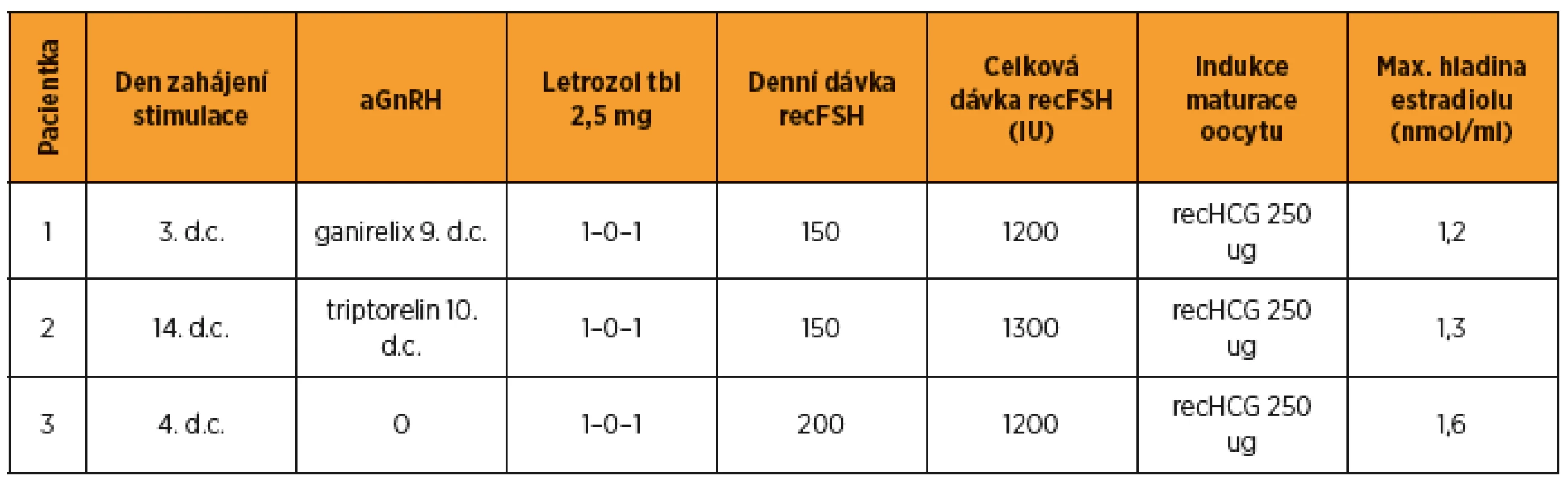
V rámci zachování fertility byla pacientce nabídnuta možnost cyklu IVF a kryokonzervace embryí. Parametry ovariální funkce ukazuje tabulka 2. Stimulace byla zahájena 2. den cyklu, rozpis medikace a embryologické výkony viz tab. 3, 4. Po odběru oocytů a kryokonzervaci oocytů embryí byla do týdne zahájena plánovaná chemoterapie – 4 série v režimu ACT v kombinaci s tamoxifenem a blokáda triptoreline 3 mg/28 dnů. Chemoterapie byla ukončena po 4 sériích, hormonální blokace letrozolem 2,5 mg/den byla plánována ještě na dobu dvou let celkem. Schematické znázornění časového sledu a trvání terapeutických modalit jsou v grafu 1).

Pacientka 2
Věk 30 let. Z anamnézy: babička měla karcinom prsu asi ve 40 letech, pacientka nebývala vážněji nemocná, bez operací, alergií a pravidelné medikace. Menarche od 13 let, cyklus nepravidelný 30–35/5 dnů, nuligravida, na korekci cyklu brala gestageny, kombinovanou hormonální antikoncepci neužívala.
Pro rezistenci v levém prsu bylo provedeno UZ vyšetření a biopsie. Klasifikace a popis nádoru obsahuje tabulka 1, provedená stagingová vyšetření byla bez průkazu metastáz. V mamární komisi byl indikován výkon „skinsparing“ mastectomia l. sin. s inzercí expanderu a biopsií sentinelové uzliny v levé axile. Operace proběhla bez komplikací, sentinelová uzlina byla bez metastatického postižení. V mamární komisi byla dále indikována systémová hormonální léčba a adjuvantní gonadotoxická chemoterapie v režimu ACT, adjuvantní radioterapie nebyla indikována. V rámci zachování fertility byla pacientce vzhledem k absenci dlouhodobého partnera nabídnuta kryokonzervace oocytů, které předchází kontrolovaná ovariální stimulace. Parametry ovariální funkce viz v tab. 2.
Stimulace byla vzhledem k časové tísni u dané pacientky zahájena až 14. den cyklu, rozpis medikace a embryologické výkony viz v tab. 3 a 4.
Po odběru a kryokonzervaci oocytů byla do týdne zahájena plánovaná chemoterapie – 4 série v režimu ACT v kombinaci s tamoxifenem a blokáda triptorelinem 3 mg/28 dnů. Chemoterapie po plánovaných 4 sériích, hormonální léčba letrozolem 2,5 mg/den ještě plánována na dobu dvou let celkem. Schematické znázornění časového sledu a trvání terapeutických modalit viz graf 1.
Pacientka 3
Věk 30 let. Z anamnézy: babička měla karcinom prsu asi ve 45 letech, teta ve 40 letech. Pacientka byla sledována pro hyperbilirubinémii a intoleranci laktózy, bez operací, alergií, pravidelné medikace. Menarche od 15 let, cyklus nepravidelný 30–34/5 dnů, nuligravida, cyklus korigován dlouhodobě gestageny.
Pro rezistenci v levém prsu bylo provedeno UZ vyšetření a biopsie. Klasifikace a popis nádoru viz v tab. 1, stagingová vyšetření bez průkazu metastáz. Podle indikace onkologické komise byla provedena lumpectomia l. sin s biopsií sentinelové uzliny. S uvedenými výsledky byla indikována gonadotoxická chemoterapie. V rámci zachování fertility byla pacientce nabídnuta možnost cyklu IVF s kryokonzervací embryí. Parametry ovariální funkce viz v tab. 2. Stimulace byla zahájena druhý den cyklu, rozpis medikace, embryologické výkony obsahují tab. 3 a 4.
Po odběru a kryokonzervaci embryí byla zahájena plánovaná chemoterapie a další dispenzarizace v odesílajícím onkologickém centru v Bratislavě. Schematické znázornění časového sledu a trvání terapeutických modalit viz v grafu 1.
DISKUSE
V uvedených případech po podrobném vysvětlení jednotlivých metod se ženy rozhodly pro ovariální stimulaci a dlouhodobou kryokonzervaci embryí nebo oocytů a blokádu ovarií v průběhu chemoterapie depotním přípravkem triptorelinem. Při tomto postupu je třeba vzít v úvahu a respektovat specifické podmínky, jako jsou časová tíseň a možná rizika stimulace ovarií při karcinomu prsu či následně v těhotenství.
ČASOVÁNÍ OVARIÁLNÍ STIMULACE
Ženy s karcinomem prsu mají obvykle 6–8týdenní interval mezi operací a zahájením adjuvantní chemoterapie. Toto období je možné využít pro zachování fertility některým z výše uvedených postupů. Důležitým faktorem je dobrá mezioborová spolupráce a informovanost mezi onkology a centrem reprodukční ochrany, aby tento poměrně krátký a pro pacientku velmi náročný časový interval byl optimálně využit a nedošlo ke zbytečné prodlevě s pokračováním onkologické léčby [7]. U dvou žen byla stimulace zahájena standardně 3. a 4. den cyklu, u pacientky 2 vzhledem k okolnostem byla stimulace zahájena nestandardně až 14. den cyklu po aplikaci triptorelinu 3 mg 10. den cyklu. Ovariální odpověď byla i v tomto případě adekvátní. Při dávce 1300 IU recFSH bylo získáno 13 oocytů, jen jeden byl při hodnocení nízké kvality a bylo zamraženo 12 oocytů (tab. 4). Tento výsledek odpovídá literárním údajům o možnosti ovariální stimulace v luteální fázi nebo provedení dvou bezprostředně po sobě následujících cyklů [3, 14].
RIZIKA OVARIÁLNÍ STIMULACE
Vlastní podávání gonadotropinů (FSH, LH, hCG) neovlivňuje růst epiteliálních buněk mléčné žlázy včetně buněk nádorově změněných [4, 13]. Estrogeny však patří k významným faktorům růstu karcinomu prsu, proto je nutné volit ovariální stimulaci, která vzestup estradiolu minimalizuje. Při standardní ovariální stimulaci se hladiny estradiolu zvyšují úměrně počtu rostoucích folikulů, proto byly hledány a vypracovány bezpečnější postupy. Odběr oocytu v nestimulovaném cyklu má minimální úspěšnost – předpokladem je ovulační cyklus, kdy se získá maximálně jeden oocyt, a na opakování vzhledem k nutnosti zahájit chemoterapii není čas. Dává se proto přednost stimulovaným cyklům, ve kterých se zvýšenému působení estradiolu předchází podáváním tamoxifenu nebo inhibitorů aromatázy.
Tamoxifen patří k selektivním modulátorům estrogenových receptorů (SERM), má prokazatelný antiestrogenový účinek na mléčnou žlázu jako kompetitivní antagonista estrogenů na úrovni receptorů. Patří k lékům první linie hormonální léčby karcinomu prsu s pozitivními estrogenovými receptory. Ve stimulačním protokolu se podává od druhého dne cyklu s FSH v dávce 20–60 mg/den až do poklesu estradiolu pod 1 nmol/l. Studie neprokázaly nepříznivý vliv tamoxifenu na kvalitu oocytu a embryí [12].
Inhibitory aromatázy blokují enzym, který katalyzuje konverzi androstendionu a testosteronu na estron a estradiol. Enzym aromatázy je přítomen nejen v ovariu, ale v mnoha dalších tkáních, včetně tuku a mléčné žlázy. Třetí generace inhibitorů aromatázy anastrozol a letrozol se selektivně vážou na aktivní místa enzymu a účinně blokují jeho funkci. Využívají se k léčbě karcinomu prsu s pozitivními estrogenovými receptory, mohou být také použity ke stimulaci ovulace [11]. Kombinovaný protokol ovariální stimulace s využitím inhibitorů aromatázy snižuje spotřebu gonadotropinů a má signifikantně nižší hladiny estradiolu než standardní cyklus IVF, použití letrozolu blokovalo vzestup estradiolu účinněji než anastrozol. V současné době je tak nejčastěji využívaným stimulačním protokolem u žen s karcinomem prsu tento postup: od druhého dne cyklu letrozol 5 mg/den, od třetího dne FSH 150–300 IU/den, při velikosti největšího folikulu 14 mm přidání GnRH antagonistů, indukce maturace oocytů aplikací hCG nebo GnRH analoga při dvou folikulech ≥ 18 mm, za 36 hodin po indukci maturace odběr oocytů, vysazení letrozolu po poklesu estradiolu pod 0,5 nmol/l. Prospektivní kontrolované studie žen s karcinomem prsu stimulovaných protokolem s FSH a letrozolem neprokázaly zhoršení dlouhodobých výsledků léčby karcinomu [2, 12].
RIZIKA TĚHOTENSTVÍ U ŽEN PO ÚSPĚŠNÉ LÉČBĚ KARCINOMU PRSU
Těhotenství je spojeno se zvýšenou zátěží celého organismu včetně výrazného vlivu ovariálních steroidů na mléčnou žlázu. Řada studií pečlivě sledovala zdravotní stav žen a narozených dětí – zvýšení rizika recidivy karcinomu prsu nebo vrozených vad dětí nebylo prokázáno [9]. Velmi důležité je správné časování těhotenství – záleží především na průběhu onkologické léčby a stanovisku onkologa [10, 17]. Obecně platí vyčkat s těhotenstvím minimálně dva roky od ukončení léčby, protože v tomto intervalu je riziko recidivy nejvyšší. Při léčbě tamoxifenem se doporučuje vyčkat minimálně pět let. U žen s vysokým rizikem recidivy nebo s mutací genu BRCA 1, 2 po provedeném kompletním profylaktickém výkonu na ženských orgánech je možným řešením surogátní mateřství [16].
ZÁVĚR
Kryokonzervace embryí a vitrifikace oocytů jsou metodami zachování plodnosti u mladých žen s karcinomem prsu, které ještě nemají zahájenou či ukončenou reprodukci. Obě metody vyžadují stimulaci ovarií. Je však nutné respektovat doporučení onkologické komise, neprodlužovat čas do zahájení chemoterapie a účinně blokovat vzestup estrogenů při stimulaci. Zdravé ani nádorové buňky v prsu nereagují na gonadotropiny FSH, LH a hCG. K buněčné proliferaci dochází u řady buněk s estrogenními receptory po expozici estrogenu v závislosti na dávce. Stimulační protokol s GnRH agonisty a letrozolem je efektivní pro zisk dostatečného počtu gamet s minimálním zvýšením hladiny estradiolu. Literární rešerše neprokázala zvýšení rizika ve smyslu progrese karcinomu prsu v souvislosti s ovariální stimulací daným protokolem.
Práce vznikla za podpory MH CZ – DRO (FNBr, 65269705) a projektu LF MU pro juniorského výzkumníka M. Ješetu.
MUDr. Nikoleta Halászová
Gynekologicko-porodnická klinika
LF MU a FN Brno
Obilní trh 11
602 00 Brno
e-mail: nikoleta.halaszova@gmail.com
Zdroje
1. Argyle, CE., Harper, JC., Davies, MC. Oocyte cryopreservation: where are we now? Hum Reprod Update, 2016, 22(4), p. 440–449.
2 Azim, AA., Costantini-Ferrando, M., Oktay, K. Safety of fertility preservation by ovarian stimulation with letrozole and gonadotropins in patients with breast cancer: a prospective controlled study. J Clin Oncol, 2008, 26, p. 2630–2635.
3. Boots, CE., Meister, M., Cooper, AR., et al. Ovarian stimulation in the luteal phase: systematic review and meta-analysis. J Assist Reprod Genet, 2016, 33, 8, p. 971–980.
4. Cooley, A. Effect of infertility and pregnancy-related hormones on breast cell proliferation in vitro. Human Reprod, 2012, 27, p. 146–152.
5. Donnez, J., Dolmans, MM. Ovarian cortex transplantation: 60 reported live births brings the success and worldwide expansion of the technique towards routine clinical practice. J Assist Reprod Genet, 2015, 32, 8, p. 1167–1170.
6. ÚZIS (Národní onkologický registr ČR). Novotvary 2014 ČR. Praha: ÚZIS Zdravotnická statistika, 2014.
7. Huser, M. Onkofertilita – nová oblast reprodukční medicíny. 1. ed. Praha: Mladá fronta, 2014, 109 s.
8 Huser, M., Smardova, L., Janku, P., et al. Fertility status of Hodgkin lymphoma patients treated with chemotherapy and adjuvant gonadotropin-releasing hormone analogues. J Assist Reprod Genet, 2015, 32, 8, p. 1187–1193.
9. Kroman, N., Jensen, MB., Wohlfahrt, J., et al. Pregnancy after treatment of breast cancer-a population-based study on behalf of Danish Breast Cancer Cooperative Group. Acta Oncol, 2008, 47, 4, p. 545–549.
10. Minář, L., Weinberger, V., Jandáková, E. Histopatologická klasifikace karcinomu prsu a její vztah k využitelným modalitám systémové léčby. Prakt Gyn, 2012, 16, 1, s. 36–41.
11. Minář, L., Hvizdová, M., Weinberger, V., Jandáková, E. Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit. Čes Gynek, 2012, 77, 2, s. 132–138.
12. Oktay, K. Further evidence on the safety and success of ovarian stimulation with letrozole and tamoxifen in breast cancer patients undergoing in vitro fertilization to cryopreserve their embryos for fertility preservation. J Clin Oncol, 2005, 23, p. 3858–3859.
13. Sergentanis, TN., Diamantaras, AA., Perlepe, C., et al. IVF and breast cancer: a systematic review and meta-analysis. Hum Reprod Update, 2014, 20, 1, p. 106–123.
14. Turan, V., Bedoschi, G., Moy, F., Oktay, K. Safety and feasibility of performing two consecutive ovarian stimulation cycles with the use of letrozole-gonadotropin protocol for fertility preservation in breast cancer patients. Fertil Steril, 2013, 100, 6, p. 1681–1685.
15. Van derVen, H., Liebenthron, J., Beckmann, M., et al. Ninety-five orthotopic transplantations in 74 women of ovarian tissue after cytotoxic treatment in a fertility preservation network: tissue activity, pregnancy and delivery rates. Hum Reprod, 2016, 31, 9, p. 2031–2041.
16. Ventruba, P., Žáková, J., Trávník P., et al. Aktuální otázky asistované reprodukce v České republice. Čes Gynek, 2013, 78, 4, s. 392–398.
17. Weinberger, V., Minář, L., Brančíková, D. Moderní chirurgická a biologická léčba karcinomu prsu. Čes Gynek, 2012, 77, 6, s. 513–520.
18. Weinberger, V., Zikán, M. Karcinom prsu – specifika gynekologické péče a poradenství. Klin Onkol, 2016, 29, (Suppl. 3), s. 7–15.
19. Zikán, M. Gynekologická prevence a gynekologické aspekty péče u nosiček mutací genů BRCA1 a BRCA2. Klin Onkol, 2016, 29, (Suppl. 1), s. 22–30.
Štítky
Dětská gynekologie Dětská onkologie Gynekologie a porodnictví Onkologie Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2017 Číslo 4
-
Všechny články tohoto čísla
- Editorial
- Laparoskopická a robotická sakropexe: retrospektivní studie zkušeností z learning curve a následného follow-up
- Rekonstrukce defektu zadního a středního kompartmentu pomocí kotveného implantátu Prolift Posterior: kohortová studie s pětiletým follow-up
- Řešení sestupu tří kompartmentů pomocí syntetického implantátu a sakrospinózní fixace: kohortová prospektivní studie s délkou follow-up pěti let
- Zachování fertility u žen s karcinomem prsu před gonadotoxickou léčbou
- Současné trendy v psychosociální a etické problematice dárcovství gamet
- Případ peritoneální tuberkulózy: diagnostika pomocí PET/CT a laparoskopie
- Katameniální pneumotorax – kazuistiky a literální přehled
- Exstirpace suburetrální pásky z důvodu chronických bolestí
- Rozsáhlý hematom – časná komplikace po antiinkontinentní operaci transobturátorovým přístupem
- Tuboovariální absces ve 39. týdnu gravidity (kazuistika)
- Informovanost rodiček v oblasti primární a sekundární prevence poruch pánevního dna po porodu
- Seriál o EET
- XXVI. konference Sekce gynekologické endoskopie ČGPS ČLS JEP 2017 se zahraniční účastí
-
Workshop
Základy robotické operativy v gynekologii 2017
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Katameniální pneumotorax – kazuistiky a literální přehled
- Rozsáhlý hematom – časná komplikace po antiinkontinentní operaci transobturátorovým přístupem
- Exstirpace suburetrální pásky z důvodu chronických bolestí
- Laparoskopická a robotická sakropexe: retrospektivní studie zkušeností z learning curve a následného follow-up
