Parciálna mola hydatidóza s nejednoznačným histopatologickým obrazom – význam genetickej diagnostiky
Partial hydatidiform moles with unclear histopathological profile – importance of genetic diagnostics
Objective: The aim of the study was the genetic characterization of a set of cases with an unclear morphological profile of the placental tissue suspected of a partial hydatidiform mole. Patients and methods: This work presents the results of a genetic analysis of a group of 10 patients with various clinical manifestations of reproductive loss, where a partial hydatidiform mole was suspected on the basis of a histopathological examination. The composition of the genome of the products of conception was determined by short tandem repeats (STR) genotyping using a commercial kit “Devyser Compact v3 (Devyser) “. Results and conclusions: Out of 10 analyzed cases, five had diandric monogynic triploid genome, characteristic for a partial mole. Aneuploidies of chromosomes 13, 18, 21, X and Y were excluded in four cases and Patau‘s syndrome was diagnosed in one case. In the case of an unclear histopathological profile, consultative DNA analysis (ideally STR genotyping) can significantly help the pathologist in the differential diagnosis of a partial mole. The histopathological profile of a partial hydatidiform mole may be in some cases incomplete and unclear, especially in the early weeks of gestation, which can lead to false negativity of the examination. On the other hand, other pathologies, for example aneuploides or digynic triploidy, may produce a histopathological profile similar to a partial mole, which leads to false positivity. Accurate diagnosis of a partial hydatidiform mole using molecular genetic methods contributes to the determination of adequate dispensary care for patients.
Keywords:
Alleles – hydatidiform mole – microsatellite repeats – genotyping techniques
Autoři:
Gergely L. 1; Petrovič R. 1; Feketová Z. 1; Klimová D. 1; Danihel Ľ. 2; Mosná K. 2; Mrázová H. 2; Korbeľ M. 3; Repiská V. 1; Priščáková P. 1
Působiště autorů:
Ústav lekárskej bio lógie, genetiky a klinickej genetiky, LF UK a UN Bratislava, Slovenská republika
1; Ústav patologickej anatómie, LF UK a UN Bratislava, Slovenská republika
2; I. gynekologicko-pôrodnícka klinika LF UK a UN Bratislava, Slovenská republika
3
Vyšlo v časopise:
Ceska Gynekol 2021; 86(6): 381-386
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccg2021381
Souhrn
Cieľ: Cieľom práce bola genetická charakterizácia súboru prípadov suspektných z parciálnej moly hydatidózy na základe nejednoznačného morfologického obrazu placentárneho tkaniva. Súbor a metodika: Práca predkladá výsledky genetickej analýzy súboru 10 pacientok s rôznymi klinickými prejavmi reprodukčných strát, u ktorých bola na základe histopatologického vyšetrenia suponovaná parciálna mola hydatidóza. Kompozícia genómu produktu koncepcie bola určená genotypizáciou krátkych tandemových opakovaní (STR – short tandem repeats) použitím komerčnej súpravy „Devyser Compact v3“ (Devyser). Výsledky a závery: Z 10 vyšetrených prípadov bol v piatich zistený diandrický monogynický triploidný genóm charakteristický pre parciálnu molu. V štyroch prípadoch boli vylúčené aneuploidie chromozómov 13, 18, 21, X a Y, v jednom prípade bol diagnostikovaný Patauov syndróm. Pri nejednoznačnom histopatologickom obraze môže patológom v diferenciálnej diagnostike parciálnej moly významne pomôcť konzultačná DNA analýza (ideálne STR genotypizácia). Histopatologický obraz parciálnej moly hydatidózy môže byť v skorých štádiách gravidity v niektorých prípadoch neúplný a nejednoznačný, čo môže viesť k falošne negatívnemu výsledku vyšetrenia. Na druhej strane, mnohé iné patológie, napr. aneuploidie alebo digynická triploidia, môžu mať histopatologický obraz podobný parciálnej mole, čo naopak vedie k falošnej pozitivite vyšetrenia. Presná diagnostika parciálnej moly hydatidózy použitím molekulárnych genetických metód prispeje k stanoveniu adekvátnej dispenzárnej starostlivosti.
Klíčová slova:
mola hydatidóza – mikrosatelity – alely – genotypizačné techniky
Úvod
Parciálna mola hydatidóza (PMH – partial hydatidiform mole) je jednou z foriem gestačnej trofoblastovej choroby (GTD – gestational trophoblastic disease), skupiny chorôb charakterizovaných rôznym stupňom proliferácie buniek trofoblastu [1,2].
Androgénny pôvod molárnej tehotnosti prvý raz opísali Kajii a Ohama v roku 1977 [3]. Molárne tehotnosti sú abnormálnymi produktami koncepcie. PPribližne 99 % prípadov PMH vzniká v dôsledku dispermickej fertilizácie (dispermická/heterozygotná PMH) a zvyšok (približne 1 %) prípadov v dôsledku duplikácie genómu spermie po oplodnení (monospermická/homozygotná PMH), čo znamená, že genóm PMH je najčastejšie diandrický monogynický triploidný. Gonozómový komplement je najčastejšie XXY [4].
Typickou histopatologickou charakteristikou PMH je prítomnosť dvoch rôznych populácií choriových klkov. Jedna časť klkov je bez hydropickej degenerácie a hyperplázie trofoblastu, kým druhá časť je edematózne presiaknutá, s rôzne výraznou proliferáciou buniek trofoblastu na povrchu klkov, ktorá je väčšinou fokálna. Ďalšími charakteristickými znakmi sú zvlnený povrch klkov, invaginácie a trofoblastové inklúzie v stróme klkov. Plod pri PMH môže, ale aj nemusí mať rôzne kongenitálne malformácie. Z imunohistochemického hľadiska je PMH charakterizovaná pozitivitou p57 vo vilóznom cytotrofoblaste a stromálnych bunkách klkov, čo napomáha jej diferenciácii od kompletnej moly hydatidózy (KMH). Typická je tiež výrazná expresia génu pre placentárnu alkalickú fosfatázu (PLAP) v bunkách syncytiotrofoblastu a intermediárneho trofoblastu [2].
Histopatologický obraz PMH, môže v niektorých prípadoch imitovať regresívne zmenený „missed abortion“ (zadržaný potrat) alebo niektoré iné abnormálne výtvory počatia [5].
Napriek vyššie uvedeným definovaným charakteristikám môže byť histopatologický obraz PMH neúplný a nejednoznačný (hlavne v skorých týždňoch gestácie), čo môže viesť k falošnej negativite histologického vyšetrenia. Na druhej strane, nonmolárne, hydropicky zmenené potraty (ďalej len hydropický potrat) a potraty inej príčiny (napr. aneuploidie a digynická triploidia) môžu mať histopatologický obraz podobný PMH, čo môže naopak viesť k falošnej pozitivite vyšetrenia. V prípade nejednoznačného histopatologického obrazu, cennú pomoc v diferenciálnej diagnostike poskytnú metódy genetickej analýzy, z ktorých najspoľahlivejšou je genotypizácia krátkych tandemových opakovaní (STR – short tandem repeats) [6].
STR sú tandemovo usporiadané opakovania krátkych sekvencií, ktoré sú tvorené jedným až šiestimi bázovými pármi (bp). V ľudskom genóme sa nachádzajú tisíce STR lokusov. V konkrétnom STR sa dookola opakuje rovnako dlhá sekvencia, variabilný je však počet opakovaní. Jednotlivé alely jedného STR lokusu majú rôznu dĺžku, väčšinou medzi 50 a 300 bp.
Využitím multiplexnej polymerázovej reťazovej reakcie (PCR – polymerase chain reaction) s fluorescenčne značenými primermi, špecifickými pre konkrétne STR lokusy, je možné súčasne detegovať STR alely viacerých lokusov. Následne sú PCR produkty analyzované kapilárnou elektroforézou v genetickom analyzátore, ktorý rozlišuje amplifikované fragmenty na základe ich dĺžky a fluorescencie [7].
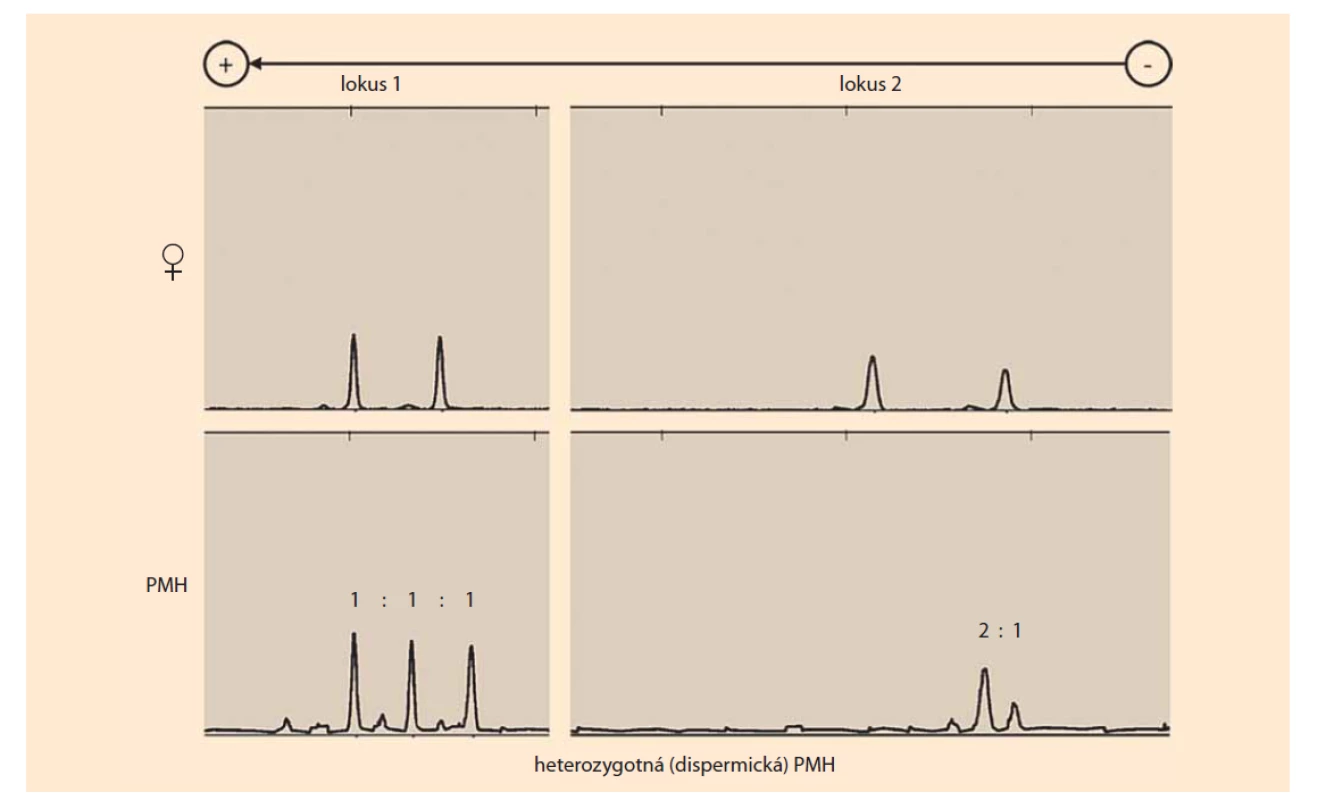
Porovnaním kompozície STR alel suspektnej PMH (DNA izolovaná z choriových klkov) a matky (DNA izolovaná z decidui alebo periférnej krvi) je možné jednoznačne určiť zloženie genómu a podiel maternálnych a paternálnych alel. Genóm PMH sa označuje ako diandrický monogynický triploidný, teda obsahuje dve alely od otca a jednu od matky pre každý STR lokus (obr. 1) [8].
Fig. 1. Results of the short tandem repeats genotyping (multiplex polymerase chain reaction with fluorescently labeled
primers) of heterozygous (dispermic) PMH based on a comparison of maternal (♀) and chorionic villus (PMH) genotypes
(alleles). PMH has one maternal allele and two non-maternal (paternal) alleles in the two analyzed loci. Locus 1 contains two
different alleles of paternal origin, indicating the heterozygosity of PMH. Locus 2 contains two identical alleles of paternal origin
and one allele of maternal origin (source: Institute of Medical Biology, Genetics and Clinical Genetics, Faculty of Medicine,
Comenius University in Bratislava).
Hoci je PMH benígnou formou GTCH, môže sa z nej vyvinúť perzistujúca gestačná trofoblastová neoplázia (PGTN) – nehistologická nozologická jednotka, s agresívnym klinickým správaním, vyžadujúca chemoterapiu (u žien, ktoré si želajú zachovať fertilitu). Presné riziko vzniku GTN po evakuácii PMH nie je známe, no odhaduje sa približne medzi 0,5 a 5 %. V literatúre sú opísané aj prípady vzniku gestačného choriokarcinómu po PMH. Pre skoré zachytenie prechodu do PGTN po evakuácii PMH, je dôležitá dispenzarizácia pacientky s pravidelným sledovaním hladín ľudského choriového gonadotropínu (hCG) [9–11].
Precízna genetická diagnostika (STR genotypizácia) suspektnej PMH v prípade nejednoznačného histopatologického obrazu môže napomôcť diferenciácii PMH, hydropických potratov a potratov inej príčiny. Dispenzarizácia by bola indikovaná iba pacientkam s PMH, čím by sa eliminovala zbytočná traumatizácia ostatných pacientok. Genotypizácia môže pomôcť objasniť aj iné príčiny potratu.
Cieľom práce bola genetická analýza suspektných PMH s nejednoznačným histopatologickým obrazom, pochádzajúcich zo slovenskej populácie.
Materiál a metódy
V období od 1. 1. 2020 do 31. 8. 2020 bolo v Ústave lekárskej biológie, genetiky a klinickej genetiky (ÚLBGaKG) vyšetrených 10 vzoriek biologického materiálu z Ústavu patologickej anatómie LF UK a UN Bratislava, kde sa patológ nevedel jednoznačne vyjadriť, či sa jedná/nejedná o parciálnu molu. Od septembra 2020 sa na ÚLBGaKG optimalizovala a zaviedla molekulárna diagnostika gestačnej trofoblastovej choroby založená na kombinovaní viacerých komerčných súprav pre STR genotypizáciu v závislosti od klinicko-patologických charakteristík prípadov.
DNA bola izolovaná z mikrodisekcií formalínom fixovaného a parafínom zaliateho (FFPE) tkaniva choriových klkov (DNA suspektnej PMH) a decidui (DNA matky) pomocou „QIAamp DNA FFPE Tissue Kit“ (QIAGEN). V prípade ak bola DNA izolovaná z FFPE tkaniva nadmerne fragmentovaná, DNA bola izolovaná zo zmrazeného tkaniva placenty (ak bolo dostupné) alebo z periférnej krvi matky (ak mikrodisekcia FFPE decidui nebola možná) pomocou „DNeasy Blood & Tissue Kit“ (QIAGEN).
STR lokusy boli amplifikované komerčnou súpravou „Devyser Compact v3“ (Devyser). Pomocou spomínanej komerčnej súpravy sa amplifikuje päť vysoko polymorfných STR lokusov na chromozómoch 13 a 18, šesť na chromozóme 21, tri na chromozóme X, dva pseudoautozomálne, vysoko polymorfné lokusy, tri lokusy na determináciu pohlavia a ďalšie dva lokusy na určenie pomeru autozómov a chromozómu X.
PCR produkty boli následne analyzované genetickým analyzátorom „ABI PRISM 3130xl“. Elektroforetogramy boli vyhodnotené pomocou „GeneMapper™ Software v4.0“. V prvom rade bol zistený počet chromozómov 13, 18, 21 a kompozícia pohlavných chromozómov. V prípade triploidie sa pôvod chromozómových sád určil porovnaním STR alel choriových klkov a decidui. Dispermická a monospermická PMH boli rozlíšené na základe počtu rôznych nonmaternálnych (paternálnych) alel.
Výsledky
Genetickými metódami bolo vyšetrených 10 histopatologických materiálov s nejednoznačným morfologickým obrazom placentárneho tkaniva suspektným z parciálnej moly. Genetické vyšetrenie v piatich prípadoch potvrdilo PMH a v piatich prípadoch PMH vylúčilo.
Všetky PMH boli dispermické (5/5), v štyroch prípadoch s karyotypom 69, XXY (4/5) a v jednom prípade s karyotypom 69, XYY (1/5). Priemerný vek pacientok s PMH bol 27,4 rokov (interval 24–32) a priemerný gestačný vek približne 10–11 týždňov (interval 8–13 týždňov). Najčastejším sonografickým obrazom pri PMH bol „missed abortion“ (4/5) a v jednom prípade sa vyskytla anembryomola (1/5). Mola hydatidóza bola sonograficky suponovaná v dvoch prípadoch (2/5) (tab. 1).
U pacientok, kde bola PMH geneticky vylúčená, sa vyskytovali karyotypy 46, XX (3/5), 46, XY (1/5) a 47, XY + 13 (trizómia chromozómu 13 – Patauov syndróm) (1/5). Priemerný vek pacientok bol 33,8 rokov (interval 29–41 rokov) a priemerný gestačný vek bol deväť týždňov (interval 7–11 týždňov). Ultrasonografický obraz bol opisovaný v troch prípadoch ako „missed abortion“ a po jednom ako abortus incompletus a anembryomola. Mola hydatidóza bola suponovaná ultrasonografickým vyšetrením v jednom prípade (1/5) (tab. 1).
#763725
Diskusia
Suspektné PMH s nejednoznačným histopatologickým obrazom predstavujú klinicky aj geneticky heterogénnu skupinu. Z 10 konzultovaných prípadov bola polovica genetickým vyšetrením vyhodnotená ako reálne PMH. Druhá polovica boli hydropické potraty a potraty z inej príčiny, histopatologicky pripomínajúce PMH. Úspešnosť sonografického rozlíšenia falošne pozitívnych a skutočných PMH bola nízka (tab. 1). Progres vo vývoji ultrasonografických techník viedol k posunu diagnostiky moly hydatidózy do I. trimestra gravidity. Tým sa zvýšil podiel skorých foriem PMH s neúplne vyvinutým histopatologickým obrazom, čo predstavuje diagnostickú dilemu [12,13]. Podľa dát z Centra pre trofoblastovú chorobu Slovenskej republiky v rokoch 1988–2002 bolo ultrasonograficky (v zhode s histopatologickou diagnózou) správne diagnostikovaných iba 43 % prípadov PMH oproti 77 % prípadov kompletnej moly [14].
V minulosti sa v diferenciálnej diagnostike parciálnej moly používali aj iné genetické laboratórne metódy. Počet chromozómových sád (ploidia) sa zisťoval prietokovou cytometriou, metódou fluorescenčnej in situ hybridizácie (FISH – fluorescence in situ hybridization) alebo karyotypizáciou [15,16]. Genetický nález diploidie diagnózu PMH vylúči. Triploidia môže byť následkom prítomnosti nadpočetnej chromozómovej sady pôvodom nielen od otca (diandrická monogynická triploidia – typická pre PMH), ale aj od matky (digynická monoandrická triploidia) [17]. Dôležitým rozdielom medzi diandrickou a digynickou triploidiou je, že digynická triploidia nie je asociovaná s rizikom vzniku PGTN, kým diandrická áno. Diferenciálna diagnostika medzi diandrickou a digynickou triploidiou v klinickej praxi znamená, že pacientky s digynickou triploidiou nemusia byť stresované neindikovanou dispenzarizáciou a sériovým meraním hCG a niekoľkomesačným odkladom následnej tehotnosti [18]. Pre diferenciáciu digynickej a diandrickej triploidie sú potrebné molekulárno genetické analýzy, a to konkrétne analýzy hypervariabilných oblastí DNA, pomocou ktorých je možné na základe rôznej dĺžky jednotlivých alel identifikovať pôvod nadpočetnej chromozómovej sady. Najprv sa používala VNTR analýza (Variable Number of Tandem Repeats) pomocou RFLP (Restriction Fragment Lenght Polymorphism) techniky v kombinácii s „Southern Blot-om“. Neskôr sa VNTR analyzovali pomocou PCR v kombinácii s agarózovou gélovou elektroforézou [19]. Podľa našich skúseností, nevýhodou VNTR analýz je relatívne obmedzený počet možných vyšetrených lokusov, z čoho vyplýva riziko menšieho (prípadne nulového) počtu informatívnych lokusov. Ďalšou nevýhodou je nemožnosť vyšetrenia metódou QF-PCR (v dôsledku veľkého rozdielu dĺžky amplikónu medzi jednotnými alelami), z čoho vyplýva značne limitovaná spoľahlivosť kvantifikácie prítomnosti jednotlivých alel. V dôsledku toho je diagnostika znemožnená už aj pri malej kontaminácii vzorky chorionových klkov deciduou. Takisto nie je možné diferencovať homozygotnú PMH, prípadne dispermickú PMH, ktorá vo vyšetrených lokusoch obsahuje 2krát tú istú paternálnu alelu.
Vyššie uvedené metódy, prípadne ich kombinácia, vo svojom čase znamenali pokrok v laboratórnej diferenciálnej diagnostike PMH. Po zavedení STR genotypizácie (najprv klasická PCR kombinovaná s polyakrylamidovou gélovou elektroforézou, neskôr QF-PCR kombinovaná s genetickým analyzátorom) sa stala zlatým štandardom v molekulárnej diagnostike GTCH [20,21].
Genotypizácia súčasne môže objasniť aj iné príčiny potratu. Podstatným prínosom STR genotypizácie zameranej na chromozómy 13, 18, 21, X a Y je možnosť zachytenia klinicky najrelevantnejších aneuploidií. Toto zistenie jednak objasní príčinu potratu, v niektorých prípadoch môže upozorniť na možnú prítomnosť balansovanej translokácie u niektorého rodiča, a tým potrebu genetickej konzultácie a vyšetrenia karyotypu rodičov [22,23]. V našom súbore 10 suspektných PMH, bola v jednom prípade zachytená trizómia 13. chromozómu (Patauov syndróm).
K adekvátnej starostlivosti o pacientky s GTCH, vzhľadom na jej nízku incidenciu, je dôležitá centralizácia. Nezriedka je potrebná úzka spolupráca expertov na GTCH z oblasti gynekológie a pôrodníctva, histopatológie, molekulárnej genetiky, prípadne onkológie, ktorí sa špeciálne zameriavajú na túto skupinu ochorení. Jedna z výhod centralizácie zdravotnej starostlivosti o pacientky s GTCH je aj rýchly prístup k molekulárno-genetickým vyšetreniam, ktoré významne prispievajú k stanoveniu adekvátneho manažmentu – personalizovanej medicíne [10].
Záver
K správnej diagnóze, nielen pri suspícii na PMH a nejednoznačnom histopatologickom obraze, ale aj pri diskrepancii medzi klinickým/ultrasonografickým a histopatologickým nálezom, prispeje genetická analýza – ideálne STR genotypizácia. Nadhodnotením histologickej diagnózy by bola časť žien zbytočne psychicky traumatizovaná dispenzárnymi kontrolami a oddialením plánovania ďalšej gravidity o niekoľko mesiacov. Podhodnotením histologickej diagnózy by časť žien nebola dispenzarizovaná a mohla by byť vystavená riziku oneskoreného rozpoznania postmolárnej PGTN. Genetická diagnostika pri takýchto patológiách sa preto stáva čoraz aktuálnejšou a významnejšou.
Doručené/Submitted: 25. 8. 2021
Prijaté/Accepted: 13. 11. 2021
Mgr. Petra Priščáková, PhD.
Ústav lekárskej biológie, genetiky
a klinickej genetiky
LF UK a UN Bratislava,Sasinkova 4
811 08 Bratislava
Slovenská republika
petra.priscakova@fmed.uniba.sk
Publikačné etika: Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do biomedicínskych časopisov.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt záujmov: Autori deklarujú, že v súvislosti s predmetom štúdie/ práce nemajú žiadny konflikt záujmov.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Dedikace: Práca bola podporená grantom VEGA 1/ 0559/ 22.
Dedication: The work was supported by the VEGA 1/ 0559/ 22.
Poďakovanie: Autori ďakujú Ing. Márii Fischerovej, MU Dr. Andrei Janegovej, PhD., MU Dr. Pavlovi Janegovi, PhD. a doc. MU Dr. Mikulášovi Redechovi, PhD. za hodnotnú pomoc,
ktorá napomohla vzniku publikácie.
Acknowledgment: The authors thank Ing. Maria Fischerova, Andrei Janegova, MD, PhD, Pavel Janeg, MD, PhD and Assoc. Prof. Mikuláš Redech, MD, PhD for the valuable help
that helped to create the publication.
Zdroje
1. WHO. Classification of tumours editorial board. Female genital tumours. Vol. 4, 5th ed. Lyon: IARC 2020.
2. Čierna Z, Palkovič M, Danihel Ľ ml et al. Expresia markeru p57 v diferenciálnej diagnostike kompletnej a parciálnej moly – korelácia s DNA analýzou. Česk-slov Patol 2012; 48 (4): 218–221.
3. Kajii T, Ohama K. Androgenetic origin of hydatidiform mole. Nature 1977; 268 (5621): 633–634. doi: 10.1038/268633a0.
4. Banet N, DeScipio C, Murphy KM et al. Characteristics of hydatidiform moles: analysis of a prospective series with p57 immunohistochemistry and molecular genotyping. Mod Pathol 2014; 27 (2): 238–254. doi: 10.1038/modpathol. 2013.143.
5. Shih IM, Ronnett BM, Mazur M et al. Gestational trophoblastic tumors and related tumorlike lesions. In: Kurman RJ, Ellenson LH, Ronnett BM (eds). Blaustein‘s pathology of the female genital tract. 6th ed. New York: Springer 2011.
6. Ronnett BM. Hydatidiform moles: ancillary techniques to refine diagnosis. Arch Pathol Lab Med 2018; 142 (12): 1485–1502. doi: 10.5858/ arpa.2018-0226-RA.
7. Pastoráková A, Petrovič R. Molekulárne metódy aktuálne používané v klinickej genetike. Bratislava: Lekárska fakulta, UK v Bratislave 2016 : 27.
8. Zheng X, Hui P, Chang B et al. STR DNA genotyping of hydatidiform moles in South China. Int J Clin Exp Pathol 2014; 7 (8): 4704–4719.
9. Ngan HY, Seckl MJ, Berkowitz RS et al. Update on the diagnosis and management of gestational trophoblastic disease. Int J Gynecol Obstet 2018; 143 (Suppl 2): 79–85. doi: 10.1002/ijgo.12615.
10. Korbeľ M, Šufliarsky J, Danihel Ľ et al. Výsledky liečby gestačnej trofoblastovej neoplázie v Slovenskej republike v rokoch 1993 až 2012. Ceska Gynekol 2016; 81 (1): 6–13.
11. Seckl MJ, Fisher RA, Salerno G et al. Choriocarcinoma and partial hydatidiform moles. Lancet 2000; 356 (9223): 36–39. doi: 10.1016/S0140-6736 (00) 02432-6.
12. Ross JA, Unipan A, Clarke J et al. Ultrasound diagnosis of molar pregnancy. Ultrasound 2018; 26 (3): 153–159. doi: 10.1177/1742271X17748 514.
13. Zheng XZ, Qin XY, Wang P et al. Clinical application of STR genotyping diagnosis for hydatidiform mole and nonmolar gestation. Zhonghua Bing Li Xue Za Zhi 2018; 47 (8): 609–615. doi: 10.3760/cma.j.issn.0529-5807. 2018.08.008.
14. Korbeľ M, Černá M, Krausová M et al. Mola hydatidosa – zmeny v ultrazvukovej diagnostike za posledných 15 rokov. Slov Gynek Pôrod 2003; 10 (2): 66–69.
15. Kipp BR, Ketterling RP, Oberg TN et al. Comparison of fluorescence in situ hybridization, p57 immunostaining, flow cytometry, and digital image analysis for diagnosing molar and nonmolar products of conception. Am J Clin Pathol 2010; 133 (2): 196–204. doi: 10.1309/AJCPV7BRDUCX0WAQ.
16. Lai CY, Chan KY, Khoo US et al. Analysis of gestational trophoblastic disease by genotyping and chromosome in situ hybridization. Mod Pathol 2004; 17 (1): 40–48. doi: 10.1038/modpathol.3800010.
17. Zaragoza MV, Surti U, Redline RW et al. Parental origin and phenotype of triploidy in spontaneous abortions: predominance of diandry and association with the partial hydatidiform mole. Am J Hum Genet 2000; 66 (6): 1807–1820. doi: 10.1086/302951.
18. Massalska D, Bijok J, Kucińska-Chahwan A et al. Triploid pregnancy-clinical implications. Clin Genet 2021; 100 (4): 368–375. doi: 10.1111/cge.14003.
19. Repiská V, Vojtassák J, Korbeľ M et al. DNA analýza gestačnej trofoblastovej choroby. Ceska Gynekol 2003; 68 (6): 442–448.
20. Ou CY, Chen MH, Niu MG. The polymorphism of nine STR loci on the genetic original identification of complete hydatidiform mole. Yi Chuan 2004; 26 (5): 607–611.
21. Fisher RA, Maher GJ. Genetics of gestational trophoblastic disease. Best Pract Res Clin Obstet Gynaecol 2021; 74 : 29–41. doi: 10.1016/j.bpobgyn.2021.01.004.
22. Colgan TJ, Chang MC, Nanji S et al. DNA genotyping of suspected partial hydatidiform moles detects clinically significant aneuploidy. Int J Gynecol Pathol 2017; 36 (3): 217–221. doi: 10.1097/PGP.0000000000000322.
23. Noriega MA, Siddik AB. Trisomy 13. In: StatPearls. Treasure Island: StatPearls Publishing 2020.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2021 Číslo 6
-
Všechny články tohoto čísla
- Srovnání využití dinoprostonu, misoprostolu a amniotomie při indukci vaginálního porodu
- Rekonstrukce prsou u pacientek s BRCA mutací a karcinomem prsu – náš přístup
- Parciálna mola hydatidóza s nejednoznačným histopatologickým obrazom – význam genetickej diagnostiky
- Robotická stagingová lymfadenektomie v těhotenství – kazuistika
- Cervikální tuberkulóza u postmenopauzální ženy
- Autoimunitní anti-N-methyl-D-aspartát receptorová encefalitida – paraneoplastický projev ovariálního teratomu
- Parazitární leiomyomy – kazuistika a rešerše článků
- Kontinuální monitorace glykemie – nový a rozšiřující se prvek v péči o pacientky s diabetes mellitus v době těhotenství
- Covid-19 jako rizikový faktor intrauterinního úmrtí plodu
- Endokanabinoidy
- Úloha mikrobiomu v těhotenství
- Zemřel profesor prim. em. MR Dr. Rudolf Slunský, DrSc.
- Poděkování recenzentům
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Úloha mikrobiomu v těhotenství
- Srovnání využití dinoprostonu, misoprostolu a amniotomie při indukci vaginálního porodu
- Rekonstrukce prsou u pacientek s BRCA mutací a karcinomem prsu – náš přístup
- Covid-19 jako rizikový faktor intrauterinního úmrtí plodu
