Estetrol – svěží vítr na poklidné hladině kontraceptiv z pohledu farmakologa
Autoři:
Jiří Slíva
Působiště autorů:
Ústav farmakologie, 3. LF UK, Praha
Vyšlo v časopise:
Ceska Gynekol 2022; 87(5): 372-376
Kategorie:
Lékový profil
doi:
https://doi.org/10.48095/cccg2022372
Úvod
Na poli moderních kontraceptiv nebylo po zavedení estradiol valerátu a posléze estradiolu v kombinaci s progestiny příliš nového. Aktuálně horkou novinkou je kombinace dnes již osvědčeného drospirenonu a nového estetrolu. Estetrol je estrogen, který je přirozeně produkován pouze játry lidského plodu během těhotenství a do mateřského oběhu se dostává placentou.
Estetrol mezi estrogeny
Estrogeny jsou primárně tvořeny zrajícími folikuly uvnitř ovarií, žlutým tělískem či placentou jako odpověď na impulzy z hypothalamo-hypofyzární osy. Určité malé procento estrogenů je však tvořeno i v jiných tkáních, jako jsou játra, nadledviny, mléčná žláza či tuková tkáň. Větší úlohu tato místa sekundární tvorby zaujímají především u žen po vyhasnutí přirozené činnosti ovarií.
V krvi se estrogeny vyskytují převážně ve vazbě na globulin vázající pohlavní hormony (SHBG – sex hormone-binding globuline). Při kontaktu s cílovou buňkou díky své lipofilitě pronikají skrze plazmatickou membránu až do buněčného jádra, kde se vážou na své receptory. Estrogenové receptory jsou za nepřítomnosti odpovídajícího ligandu zcela inaktivní. Teprve vazba ligandu vyvolá konformační změnu a vazbu na cílové struktury DNA, tzv. estrogen-responzivní elementy (EREs).
V ženském těle se přirozeně tvoří estron (E1), estradiol (E2) a estriol (E3), přičemž nejsilnější účinek z těchto tří estrogenů vykazuje estradiol (E2). Zatímco estradiol (E2) je nejčastěji se vyskytujícím estrogenem v těle negravidní ženy, vyšší koncentrace estronu jsou zjišťovány během menopauzy a estriolu naopak během těhotenství. Všem je společný jejich prapůvod z mužských pohlavních hormonů.
Estetrol (E4) je lidský přirozený estrogen, který byl objeven v roce 1965 v moči těhotných žen [1,2]. Jde o polární estrogenní metabolit tvořený výlučně plodem v průběhu vývoje intra utero a do mateřského oběhu se dostává přes placentu. Jelikož působí jako přirozený selektivní modulátor estrogenních receptorů, logicky byl v posledních letech zvažován stran možného využití v rámci kontracepce, hormonální substituční terapie u žen v postmenopauze nebo postmenopauzální osteoporózy či adjuvantní léčby karcinomu prsu.
Farmakokinetické vlastnosti estetrolu
Plazmatické hladiny estetrolu se díky přestupu skrz placentu u těhotných žen postupně zvyšují a ke konci gestace dosahují nejvyšších koncentrací (≥ 1 ng/ml) [3]. Plazmatické hladiny estetrolu plodu v okamžiku porodu jsou přitom téměř 20krát vyšší než plazmatické hladiny matky [4]. Estetrol je tak považován i za určitý ukazatel zralosti plodu. Jeho hladina v krvi matky okamžikem porodu rapidně klesá až pod detekovatelnou mez [5]. Pro zajímavost uveďme, že tvorba esterolu nebyla pozorována u běžně užívaných laboratorních zvířat (myš, potkan, králík).
Estetrol má vysokou perorální biologickou dostupnost (90 %). Po svém vstřebání vykazuje pouze nízkou vazbu na proteiny plazmy (téměř 50 %), přičemž se vůbec neváže na SHBG [6]. Většina přirozených androgenů a estrogenů, ale též mnohé syntetické pohlavní steroidy se na SHBG vážou s vysokou afinitou, přičemž tyto interakce určují jejich distribuci v lidském těle. To je důležité, neboť se předpokládá, že přístup k cílovým tkáním získají pouze ty látky, které nejsou vázány na bílkoviny. Mimo jiné ke zvýšení plazmatických koncentrací SHBG dochází po podání exogenních estrogenů i během těhotenství v důsledku fyziologického nárůstu tvorby endogenních estrogenů. Takové zvýšení SHBG pak může mít výrazný dopad na plazmatickou distribuci a tkáňovou dostupnost endogenních i exogenních ligand SHBG. Například perorální podávání ethinylestradiolu (EE) jako antikoncepčního prostředku zvýší plazmatické hladiny SHBG 5–10krát. Tím se nejen sníží hladiny „volného“ testosteronu, ale také se sníží „volné“ hladiny současně užívaných progestinů, které se s vysokou afinitou vážou na lidský SHBG. Při vývoji jakéhokoli nového estrogenního léčiva je proto důležité vyhodnotit jeho účinky na hladiny SHBG v plazmě a určit, zda vazba na SHBG ovlivní jeho přístup k cílovým tkáním.
Fig. 1. Chemical structure of estrogens.
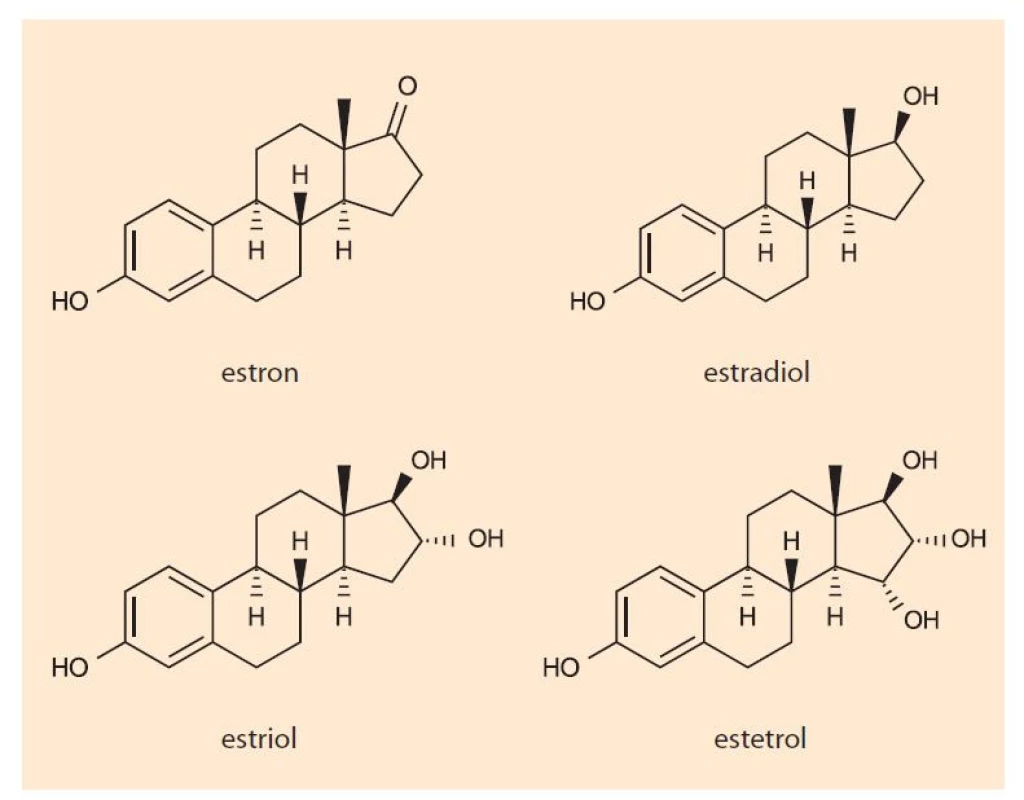
Esterol je syntetizován během těhotenství z E2 a E3 dvěma fetálními jaterními enzymy prostřednictvím hydroxylace. Na rozdíl od E2 nevykazuje E4 klinicky relevantní inhibiční nebo indukující interakce s jaterními enzymy cytochromu P450 nebo s jinými systémy, z čehož plyne nižší riziko potenciálních lékových interakcí [4,6]. Degradován je pak přímou glukuronidací D-kruhu a sulfatací s exkrecí především ledvinami s průměrným biologickým poločasem 28–32 hod, což je asi 2krát déle než estradiol [3]. Pokud se tak užití aktivní tablety opozdí o méně než 24 hod, není antikoncepční ochrana narušena.
Farmakodynamické vlastnosti esterolu
Již v 70. a 80. letech minulého století bylo zjištěno, že E4 má slabší estrogenní aktivitu než E2 či E3, pročež je třeba jeho užívání v miligramových dávkách. Estetrol má nízkou až střední afinitu k lidským estrogenovým receptorům a (ERa) i b (ERb), s vyšší afinitou k ERa. Estrogenové receptory jsou za nepřítomnosti odpovídajícího ligandu zcela inaktivní ve vazbě s tzv. heat-shock proteiny (HSP). Teprve vazba ligandu způsobí konformační změnu vyvolávající dimerizaci a vazbu na cílové struktury DNA, tzv. EREs. Zatímco ERb se nachází převážně v kostech, v epitelu krevních kapilár, prostatě a vyšších centrech centrální nervové soustavy, ERa najdeme zejména v prsní a děložní tkáni.
Estetrol aktivuje nukleární receptory ERa, avšak je antagonistou membránově vázaných receptorů ERa, čímž se odlišuje od ostatních estrogenů působících pouze agonisticky. Na základě svého farmakologického profilu je tak některými autory označován za první přírodní estrogen se selektivním účinkem ve tkáních (NEST – natural estrogen with selective action in tissues) [7].
Estetrol díky své agonistické nebo antagonistické aktivitě na ER vykazuje různé účinky na různé tkáně [7]:
• mléčné žlázy – nižší riziko možného rozvoje nádorového bujení;
• žilní tromboembolizmus (VTE) – možné nižší riziko tromboembolizmu;
• játra – nižší tvorba SHBG, neovlivňuje enzymy cytochromu P450;
• centrální nervový systém – neuroprotektivní účinky, inhibice uvolňování luteinizačního hormononu (LH) a folikulostimulačního hormonu (FSH);
• skelet – prevence demineralizace, zvýšení denzity kosti;
• pohlavní orgány – inhibice ovulace, růst dělohy a proliferace endometria.
Aspekty klinického využití E4 a jeho kombinace s drospirenonem
Potlačení ovulace
Vliv E4 na ovulaci byl hodnocen v několika klinických studiích. Coelingh Bennink et al již před 15 lety studovali jeho efekt u pravidelně cyklujících potkaních samic ve srovnání s EE [8].
Schopnost potlačit produkci LH a FSH byla studována u žen v časném postmenopauzálním období. E4 prokázal výrazný centrální inhibiční a na dávce závislý účinek na LH a FSH u žen po menopauze. Po jednorázovém podání byla pozorována jasná na dávce závislá inhibice hladin LH a hluboká inhibice hladin FSH během 48 hod po 100 mg E4 (trvající přes 7 dní) [9].
Pilotní klinická studie fáze II zaměřená na zjištění optimálních dávek hodnotila účinnost různých dávek E4 v kombinaci s levonorgestrelem (LNG) nebo drospirenonem (DRSP) v potlačení hypofýzo-ovariální osy a ovulace u zdravých premenopauzálních žen. E4 v kombinaci s DRSP (5 nebo 10 mg E4 + 3 mg DRSP) nebo LNG (5, 10 nebo 20 mg E4 + 0,15 mg LNG) ve 24/4denním režimu byla porovnána s EE 20 µg + 3 mg DRSP, všechny podávané ve třech po sobě jdoucích cyklech. Ve všech léčebných skupinách nedošlo k ovulacím během léčebných cyklů, což ukazuje účinnost všech kombinací E4. Tloušťka endometria byla také snížena podobně během léčby ve všech léčebných skupinách. K první ovulaci po léčbě došlo přibližně 17 dní po posledním dni léčby ve skupinách E4/DRSP a 21 dnů po poslední aktivní léčbě ve skupinách E4/LNG a EE/DRSP [10].
Další studie fáze II měla za cíl zhodnotit známky krvácení a kontrolu cyklu při užívání kombinované perorální kontracepce v režimu 24/4 dnů. Porovnávaly se skupiny s různým složením E4/DRSP, E4/LNG a E2V/dienogest (DNG). Četnost neplánovaného krvácení/špinění byla nižší ve skupinách E4/DRSP ve srovnání s jinými léčebnými skupinami. Kombinace 15 mg E4/DRSP se zde ukázala jako nejúčinnější, pokud jde o typ krvácení a kontrolu cyklu. Ženy zde zmiňovaly celkovou spokojenost s užíváním, což může být umocněno i lepší kontrolou své tělesné hmotnosti [11,12].
Po těchto studiích zaměřených na zjištění dávky byly provedeny klinické studie fáze III s použitím kombinace E4 15 mg/DRSP 3 mg. První studie byla provedená v Severní Americe [13]. Ve druhé studii provedené u 1 553 žen z Evropy a Ruska ve věku 18–50 let bylo hlášeno málo těhotenství s hodnotou Pearl indexu 0,47 ve skupině ve věku 18–35 let a 0,41 v celé skupině. Plánované krvácení se vyskytlo u 91,9–94,4 % žen/cyklus. Plánované dny krvácení a/nebo špinění zůstaly stabilní po celou dobu studie s mediánem trvání 4–5 dnů. Neplánované epizody krvácení a/nebo špinění se objevily u 19,2 % žen v cyklu dva a snížily se na 12,8 % žen v cyklu 11. Celkově byla tato metoda kombinované kontracepce posouzena jako vysoce účinná při prevenci nechtěných těhotenství s uspokojivou kontrolou krvácení [14].
Ovlivnění hemostázy
V in vitro studii na endoteliálních buňkách lidské pupečníkové žíly byly studovány účinky E4 na fibrinolytický systém. Exprese inhibitoru aktivátoru plazminogenu-1 (PAI-1), aktivátoru plazminogenu typu urokinázy (u-PA) a aktivátoru tkáňového plazminogenu (t-PA) byly zvýšeny v závislosti na dávce, ačkoli E4 byl méně účinný než ekvimolární množství E2. Kromě toho byla působením E4 zvýšena migrační kapacita endoteliálních buněk. E4 tedy může regulovat fibrinolytický systém v endoteliálních buňkách s potenciálními důsledky pro lokální kontrolu srážení krve a pro vaskulární remodelaci [15]. V experimentu u myší významně omezoval adhezi trombocytů, prodlužoval dobu krvácení a působil protektivně proti arteriálnímu i žilnímu embolizmu [16].
Na klinické úrovni byl daný vliv hodnocen v dávkách 5 nebo 10 mg ve fixní kombinaci s DRSP 3 mg, a to ve srovnání s kombinací EE 20 μg/DRSP 3 mg. Při 3měsíčním sledování obě kombinace E4 snížily hladinu D-dimeru bez vlivu na antitrombin, aktivitu proteinu S nebo aktivovanou rezistenci proteinu C; kombinace 5 mg E4/DRSP také snížila protrombinový fragment 1 + 2 [17]. Tyto výsledky jsou podpořeny recentním pozorováním, kde 6měsíční podávání E4 15 mg/DRSP 3 mg způsobilo podobné nebo menší změny v prokoagulačních, antikoagulačních a fibrinolytických parametrech, a to ve výrazně menší míře než u kombinace EE/DRSP [18].
Žádné případy VTE nebyly pozorovány ani v americko-kanadské studii fáze III u 1 864 uživatelek, z nichž 23 % mělo BMI > 30 kg/m2, což je rizikový faktor pro VTE [19], ani ve studii evropsko-ruské, kde byl v souboru 1 553 žen hlášen jediný případ VTE [20]. Zjištění těchto dvou studií tedy naznačují, že E4/DRSP má nižší dopad na koagulační a fibrinolytický systém ve srovnání s EE/LNG nebo EE/DRSP, a je tedy i méně pravděpodobné, že způsobí VTE, což je však třeba ověřit ve větších poregistračních studiích.
Rozdíl v koagulačních parametrech a fibrinolytických systémech pozorovaný u EE/DRSP a E4/DRSP také naznačuje, že vliv kombinované kontracepce na parametry hemostázy je zprostředkován především konkrétním typem zvoleného estrogenu [18].
V kontextu užívané kontracepce je nezřídka skloňována rovněž otázka rezistence na aktivovaný protein C (APC), jež je považována za důležitý faktor v etiologii VTE. Nízký vliv E4 na APC a další parametry hemostázy je v souladu s uvedeným předpokladem, že riziko je řízeno přítomností EE a že výběr estrogenní složky v tomto ohledu moduluje účinky kombinovaného kontraceptiva. Relativní riziko VTE, které lze získat z modelu pro E2V/DNG nebo E2/nomegestrol, je velmi blízké upravenému relativnímu riziku pozorovanému v epidemiologických studiích, což umocňuje pravděpodobnost, že kombinace E4/DRSP by měla být spojena s nižším nebo podobným rizikem VTE ve srovnání s referenční kombinací EE/LNG [21].
Vliv na kardiovaskulární systém
Studie u žen po menopauze léčených různými dávkami E4 (2, 10, 20 nebo 40 mg) po dobu 28 dnů ukázala jeho příznivý vliv na snížení lipoproteinu o nízké hustotě (LDL – low-density lipoprotein), jenž byl doprovázen zvýšením lipoproteinu o vysoké hustotě (HDL – high-density lipoprotein) a žádnými nebo minimálními změnami v hladině triglycerolů; všechny účinky byly závislé na dávce [22].
Mawet et al provedli studii zaměřenou na zjištění optimální dávky u zdravých normálně ovulujících žen ve věku 18–35 let. Aplikovali šest různých terapií u šesti skupin žen ve třech po sobě jdoucích cyklech v režimu 24/4 dnů: 5 nebo 10 mg E4 s 3 mg DRSP; 5, 10 nebo 20 mg E4 s 0,15 mg LNG; 0,02 mg EE s 3 mg DRSP jako komparátorem. Kombinovaná kontraceptiva obsahující E4 navodila méně negativní účinky na lipoproteiny a triacylglyceroly ve srovnání se skupinou EE/DRSP [23]. Tato pozorování následně potvrzuje též Klipping et al při kombinaci 15 mg E4 a 3 mg DRSP – zjištěný nárůst triacylglycerolemie (+24 %) byl výrazně menší ve srovnání s EE/LNG (+ 28 %) a EE/DRSP (+65,5 %) [24].
Ovlivnění činnosti jater
Ve výše zmíněné studii Mawet et al vykazují plazmatické hladiny SHBG mírné zvýšení závislé na dávce s E4/DRSP. Tento nárůst je však podstatně menší než u EE/DRSP [23]. Analogicky též Klipping et al zjišťují podobnou variaci SHBG: E4 15 mg/DRSP 3 mg způsobilo zvýšení o 87,15 % v cyklu šest, což bylo stále výrazně méně než u EE/LNG a EE/DRSP [24]. Další studie potvrdily malý vliv kombinace E4/DRSP na produkci SHBG [17,18]. Nicméně byly studovány i další jaterní proteiny, přičemž změny angiotenzinogenu vykazovaly podobný profil jako SHBG. C-reaktivní protein, globulin vázající kortizol, globulin vázající tyroxin a ceruloplasmin vykazovaly mírné změny s E4/DRSP, což potvrzuje pouze omezený estrogenní účinek E4 na játra v kombinaci s antiandrogenními progestiny [7]. Výhodou E4 je, že se navzájem neovlivňuje s jaterními enzymy cytochromu P450, tudíž má nižší riziko interakcí s ostatní medikací [4,6].
Vliv na skelet a mléčnou žlázu
Dostupné informace v tomto směru jsou dosud stále omezené. Klinická studie Mawet et al nezjistila žádnou nerovnováhu mezi kostní resorpcí a novotvorbou kosti po léčbě E4/DRSP ani EE/DRSP. To naznačuje pozitivní vliv E4/DRSP na kostní obrat u mladých postadolescentních žen podobně jako jiná kombinovaná perorální kontraceptiva [23]. Samotný E4 působí na skelet protektivně [25,26].
Podobně je velmi málo známo o účincích kombinací E4/DRSP na mléčnou žlázu. Nedávno publikovaná klinická studie ukazuje, že E4 v kombinaci s progesteronem, nebo DRSP, nebo bez nich nepodporuje ani rozvoj karcinomu prsu, ani metastatické šíření u tří různých modelů karcinomu prsu, pokud je použit v terapeutické dávce pro hormonální substituční terapii nebo jako kontraceptivum [27].
Závěr
Farmakologické vlastnosti E4 z něj činí užitečnou molekulu pro terapeutické využití jako kontraceptivum. Dosud realizované klinické studie fáze II a III poskytly slibné výsledky s použitím kombinace estetrolu 15 mg a drospirenonu 3 mg, která vykazovala dobrý antikoncepční účinek a kontrolu cyklu, která se vyznačuje předvídatelným pravidelným krvácením a minimálním neplánovaným krvácením spolu s dobrým bezpečnostním profilem. Tato kombinace v dosud realizovaných klinických studiích byla spojena s vysokou mírou spokojenosti uživatelek a s minimálními změnami tělesné hmotnosti. Vliv na endokrinní a metabolické parametry byl minimální a bylo zjištěno, že tato fixní kombinace má jen velmi omezený dopad na činnost jater a metabolizmus lipidů a sacharidů. Navíc její účinek na některé hemostatické parametry byl nižší než u aktivních komparátorů obsahujících ethinylestradiol (EE) 20 µg/DRSP 3 mg a EE 30 µg/levonorgestrel 150 µg, což predikuje vyšší bezpečnost kombinace E4 + DRSP z hlediska tromboembolie. Jistě bez zajímavosti není, že E4 má jen nevýznamné endokrinní disruptivní účinky na životní prostředí ve srovnání s ostatními klinicky využívanými estrogeny, které se dostávají v nemalém množství do našeho životního prostředí. Je proto označován jako „environmental friendly estrogen“.
doc. MU Dr. Jiří Slíva, Ph.D.
Ústav farmakologie
3. LF UK
Ruská 2411/ 87
100 00 Praha 10
Zdroje
1. Hagen A, Barr M, Diczfalusy E. Metabolism of 17b-oestradiol-4-14C in early infancy. Acta Endocrinol (Copenh) 1965; 49 : 207–220.
2. Zucconi G, Lisboa BP, Simonitsch E et al. Isolation of 15-alpha-hydroxy-oestriol from pregnancy urine and from the urine of newborn infants. Acta Endocrinol (Copenh) 1967; 56 (3): 413–423. doi: 10.1530/acta.0.0560413.
3. Schwers J, Eriksson G, Diczfalusy E. Metabolism of oestrone and oestradiol in the human foeto-placental unit at midpregnancy. Acta Endocrinol (Copenh) 1965; 49 : 65–82. doi: 10.1530/acta.0.0490065.
4. Coelingh Bennink F, Holinka CF, Visser M et al. Maternal and fetal estetrol levels during pregnancy. Climacteric 2008; 11 (Suppl 1): 69–72. doi: 10.1080/13697130802056321.
5. Tulchinsky D, Frigoletto FD Jr, Ryan KJ et al. Plasma estetrol as an index of fetal well-being. J Clin Endocrinol Metab 1975; 40 (4): 560–567. doi: 10.1210/jcem-40-4-560.
6. Hammond GL, Hogeveen KN, Visser M et al. Estetrol does not bind sex hormone binding globulin or increase its production by human HepG2 cells. Climacteric 2008; 11 (Suppl 1): 41–46. doi: 10.1080/13697130701851814.
7. Fruzzetti F, Fidecicchi T, Montt Guevara MM et al. Estetrol: a new choice for contraception. J Clin Med 2021; 10 (23): 5625. doi: 10.3390/jcm 10235625.
8. Coelingh Bennink HJ, Skouby S, Bouchard P et al. Ovulation inhibition by estetrol in an in vivo model. Contraception 2008; 77 (3): 186–190. doi: 10.1016/j.contraception.2007.11.014.
9. Visser M, Holinka CF, Coelingh Bennink HJ. First human exposure to exogenous single-dose oral estetrol in early postmenopausal women. Climacteric 2008; 11 (Suppl 1): 31–40. doi: 10.1080/13697130802056511.
10. Duijkers IJ, Klipping C, Zimmerman Y et al. Inhibition of ovulation by administration of estetrol in combination with drospirenone or levonorgestrel: results of a phase II dose-finding pilot study. Eur J Contracept Reprod Health Care 2015; 20 (6): 476–489. doi: 10.3109/13625187. 2015.1074675.
11. Apter D, Zimmerman Y, Beekman L e tal. Bleeding pattern and cycle control with estetrol-containing combined oral contraceptives: Results from a phase II, randomised, dose-finding study (FIESTA). Contraception 2016; 94 (4): 366–373. doi: 10.1016/j.contraception.2016.04.015.
12. Apter D, Zimmerman Y, Beekman L et al. Estetrol combined with drospirenone: an oral contraceptive with high acceptability, user satisfaction, well-being and favourable body weight control. Eur J Contracept Reprod Health Care 2017; 22 (4): 260–267. doi: 10.1080/13625187. 2017.1336532.
13. Creinin MD, Westhoff CL, Bouchard C et al. Estetrol-drospirenone combination oral contraceptive: North American phase 3 efficacy and safety results. Contraception 2021; 104 (3): 222–228. doi: 10.1016/j.contraception.2021.05. 002.
14. Gemzell-Danielsson K, Apter D, Zatik J et al. Estetrol-Drospirenone combination oral contraceptive: a clinical study of contraceptive efficacy, bleeding pattern, and safety in Europe and Russia. BJOG 2022; 129 (1): 63–71. doi: 10.1111/1471-0528.16840.
15. Montt-Guevara MM, Palla G, Spina S et al. Regulatory effects of estetrol on the endothelial plasminogen pathway and endothelial cell migration. Maturitas 2017; 99 : 1–9. doi: 10.1016/j.maturitas.2017.02.005.
16. Valéra MC, Noirrit-Esclassan E, Dupuis M et al. Effect of estetrol, a selective nuclear estrogen receptor modulator, in mouse models of arterial and venous thrombosis. Mol Cell Endocrinol 2018; 477 : 132–139. doi: 10.1016/ j.mce.2018.06.010.
17. Kluft C, Zimmerman Y, Mawet M et al. Reduced hemostatic effects with drospirenone-based oral contraceptives containing estetrol vs. ethinyl estradiol. Contraception 2017; 95 (2): 140–147. doi: 10.1016/j.contraception.2016.08.018.
18. Douxfils J, Klipping C, Duijkers I et al. Evaluation of the effect of a new oral contraceptive containing estetrol and drospirenone on hemostasis parameters. Contraception 2020; 102 (6): 396–402. doi: 10.1016/j.contraception.2020.08.015.
19. Creinin MD, Westhoff CL, Bouchard C et al. Estetrol-Drospirenone combination oral contraceptive: North American phase 3 efficacy and safety results. Contraception 2021; 104 (3): 222–228. doi: 10.1016/j.contraception.2021.05.002.
20. Gemzell-Danielsson K, Apter D, Zatik J et al. Estetrol-Drospirenone combination oral contraceptive: a clinical study of contraceptive efficacy, bleeding pattern and safety in Europe and Russia. BJOG 2022; 129 (1): 63–71. doi: 10.1111/1471-0528.16840.
21. Gemzell-Danielsson K, Cagnacci A, Chabbert-Buffet N et al. A novel estetrol-containing combined oral contraceptive: European expert panel review. Eur J Contracept Reprod Health Care. 2022 : 1–11.
22. Coelingh Bennink HJ, Verhoeven C, Zimmerman Y et al. Pharmacokinetics of the fetal estrogen estetrol in a multiple-rising-dose study in postmenopausal women. Climacteric 2017; 20 (3): 285–289. doi: 10.1080/13697137.2017. 1291608.
23. Mawet M, Maillard C, Klipping C et al. Unique effects on hepatic function, lipid metabolism, bone and growth endocrine parameters of estetrol in combined oral contraceptives. Eur J Contracept Reprod Health Care 2015; 20 (6): 463–475. doi: 10.3109/13625187.2015.1068934.
24. Klipping C, Duijkers I, Mawet M et al. Endocrine and metabolic effects of an oral contraceptive containing estetrol and drospirenone. Contraception 2021; 103 (4): 213–221. doi: 10.1016/j.contraception.2021.01.001.
25. Coelingh Bennink HJ, Heegaard AM, Visser M et al. Oral bioavailability and bone-sparing effects of estetrol in an osteoporosis model. Climacteric 2008; 11 (Suppl 1): 2–14. doi: 10.1080/13697130701798692.
26. Coelingh Bennink HJ, Verhoeven C, Zimmerman Y et al. Pharmacodynamic effects of the fetal estrogen estetrol in postmenopausal women: results from a multiple-rising-dose study. Menopause 2017; 24 (6): 677–685. doi: 10.1097/GME.000000000000823.
27. Gallez A, Blacher S, Maquoi E et al. Estetrol combined to progestogen for menopause or contraception indication is neutral on breast cancer. Cancers (Basel) 2021; 13 (10) : 2486. doi: 10.3390/ cancers13102486.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2022 Číslo 5
-
Všechny články tohoto čísla
- Změna trendu operační léčby a stagingu lymfatických uzlin u karcinomu endometria – výsledky Onkogynekologického centra Gynekologicko-porodnické kliniky FN Brno a LF MU v letech 2012–2021
- Vliv manuální lymfodrenáže na lymfedém horní končetiny po operaci pro karcinom prsu
- Psoriáza vulvy
- Metastatické postižení inguinálních uzlin jako první příznak endometroidního karcinomu vejcovodu
- Idiopatická granulomatózna mastitída
- Trojčetná gravidita – etiologie a časná diagnostika
- Včasné zahájení embryotransferů po transplantaci dělohy v zájmu zkrácení podávání imunosupresivní léčby
- Distální vaginální ageneze a diferenciální diagnostika dalších příčin hematokolpos
- Zachování fertility u onkologických pacientek
- Současné znalosti o fertilitu šetřící léčbě pacientek s karcinomem děložního hrdla
- Vzpomínka na MUDr. Alexandra Bartáka
- Estetrol – svěží vítr na poklidné hladině kontraceptiv z pohledu farmakologa
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Idiopatická granulomatózna mastitída
- Distální vaginální ageneze a diferenciální diagnostika dalších příčin hematokolpos
- Vliv manuální lymfodrenáže na lymfedém horní končetiny po operaci pro karcinom prsu
- Estetrol – svěží vítr na poklidné hladině kontraceptiv z pohledu farmakologa
