Endokanabinoidy
Endocannabinoids
Objective: Overview of current knowledge in the field of the endocannabinoid system with emphasis on the relationships between endocannabinoids and exocannabinoids. The endocannabinoid system consists of cannabinoid receptors 1 and 2, ligands of these receptors, especially two „classical“ endocannabinoids N-arachidonoylethanolamine (anandamide) and 2-arachidonoyl-glycerol. Transport systems that ensure the entry of endocannabinoids into cells, where they are degraded by fatty acid amide hydrolase or monoacylglycerol lipase. The endocannabinoid system is a signaling pathway for the regulation of a number of physiological or pathological conditions. So far, it is one of the less explored ways of regulation, as evidenced by the recent explosive increase in the number of published works. Dysregulation of endocannabinoid systems is a possible cause of many diseases. It can occur both in the genetic polymorphism of its individual components, but also in therapy with certain drugs or natural substances, typically cannabinoids. Due to the wide overlap of the regulation of physiological functions by the endocannabinoid system, a considerable number of drugs are being developed, the aim of which is to correct the dysregulation of the endocannabinoid system. Conclusion: The endocannabinoid system is one of the most important regulatory systems with a very broad intervention in physiological and pathological conditions. The resulting specific regulations intersect the interplay of many enzymes involved in the production and degradation of endocannabinoids, transport systems involved in the entry of endocannabinoids into cells, cannabinoid receptors and exogenous cannabinoids, or natural substances acting at various sites in the endocannabinoid system. Knowledge in this area can contribute to improving health care and increasing the safety of its provision.
Keywords:
Cannabinoids – Endocannabinoids – anandamide – 2-arachidoyl glycerol – cannabinoid receptor – fatty acid binding proteins – fatty acid amide hydrolases – lipase for monoacylglycerols
Authors:
Suchopár J. 1; Laštůvka Z. 2; Mašková S. 2; Alblová M. 2; Pařízek A. 2
Authors‘ workplace:
DrugAgency, a. s., Praha
1; Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
2
Published in:
Ceska Gynekol 2021; 86(6): 414-420
Category:
Review Article
doi:
https://doi.org/10.48095/cccg2021414
Overview
Cíl: Přehled aktuálních poznatků o endokanabinoidním systému člověka. Endokanabinoidní systém je tvořen kanabinoidními receptory 1 a 2, ligandy těchto receptorů, zejména dvěma „klasickými“ endokanabinoidy N-arachidonoylethanolaminem (anandamid) a 2-arachidonoyl-glycerolem a transportními systémy. Transportní systémy zajišťují vstup endokanabinoidů do buněk, kde dochází k jejich odbourávání cestou hydrolázy amidů mastných kyselin nebo lipázy pro monoacyl-glyceroly. Endokanabinoidní systém reguluje řadu fyziologických nebo patologických stavů. O aktuálním zájmu o studium těchto regulací svědčí v poslední době explozivní nárůst počtu publikovaných prací. Porucha regulace endokanabinoidního systému je možnou příčinou řady onemocnění. Může k ní docházet jednak při genetickém polymorfizmu jejích jednotlivých komponent, ale také při terapii některými léky nebo přírodními látkami, typicky kanabinoidy. Kvůli širokému překryvu regulací fyziologických funkcí endokanabinoidním systémem je vyvíjeno značné množství léků, jejichž cílem je úprava dysregulace endokanabinoidního systému. Závěr: Endokanabinoidní systém patří v organizmu člověka mezi nejvýznamnější regulační systémy s velmi širokým zásahem do fyziologických a patologických stavů. Výsledné konkrétní regulace jsou průsečíkem souhry mnoha enzymů, které se účastní tvorby a odbourávání endokanabinoidů, transportních systémů, které se účastní vstupu endokanabinoidů do buněk, kanabinoidních receptorů a exogenních kanabinoidů, resp. přírodních látek působících na různých místech endokanabinoidního systému. Znalosti v této oblasti mohou přispět ke zlepšení zdravotní péče a ke zvýšení bezpečnosti jejího poskytování.
Klíčová slova:
endokanabinoidy – anandamid – 2-arachidoyl-glycerol – kanabinoidní receptor – proteiny vázající mastné kyseliny – hydrolázy amidů mastných kyselin – lipáza pro monoacyl-glyceroly – kanabinoidy
Úvod
Příběh studia endokanabinoidů je mladý, neboť začíná ve druhé polovině 80. let minulého století [1] objevem kanabinoidních receptorů. Ten předznamenal zpočátku pozvolný a následně prudký rozvoj poznatků týkajících se „kanabinoidní regulace“ řady fyziologických funkcí [2]. Kanabinoidní regulace je (spolu) odpovědná nejen za stav psychických funkcí (nálada, paměť), ale i percepci bolesti, aktivitu imunitního systému, regulaci krevního tlaku, chuti k jídlu, ale také za aktivitu dělohy a placenty [3], s čímž souvisí důležitá role endokanabinoidů v těhotenství a při porodu [4].
Již v roce 1990 byl klonován kanabinoidní receptor 1 (CB1 – cannabinoid receptor 1) exprimovaný převážně v mozkové tkáni [5], o 3 roky později byl popsán kanabinoidní receptor 2 (CB2 – cannabinoid receptor 2) exprimovaný nejen v centrální nervové soustavě (CNS – central nervous system), ale také v mnoha periferních tkáních [6]. Oba uvedené kanabinoidní receptory patří do skupiny membránových receptorů spřažených s G-proteinem [7].
Kanabinoidní receptory tak představovaly, vedle opioidních receptorů, skupinu receptorů, jejichž endogenní ligandy nebyly po jistou dobu známy. To se změnilo v roce 1992, kdy Devane et al publikovali svůj objev lipofilních látek odvozených od kyseliny arachidonové, se silnou vazbou na kanabinoidní receptory [8]. Dlužno doplnit, že tento objev má významnou českou stopu v Lumíru Ondřejovi Hanušovi, jehož schopnosti v oblasti analytické chemie k objevu významně přispěly. První z těchto látek byla nazvána anandamid (podle sanskrtského ananda, tj. blaženost nebo dokonalé štěstí). Anandamid (AEA) je chemicky arachidonyl-ethanolamid. Mezi další významné endokanabinoidy patří 2-arachidonoglycerol (2-AG), chemicky 2-arachidonoyl-glycerol, 2-AG ether (2-AGE) nebo O-arachidonoylethanolamin (OAE) [9]. Objev endokanabinoidů významně akceleroval výzkumné aktivity v oblasti endokanabinoidního systému, zejména farmakodynamické aspekty a vztahy a regulace s dalšími signálními drahami, druhá část výzkumu se pak zaměřila na nové potenciální léky.
Endokanabinoidy působí jako retrográdní posel na presynaptických kababinoidních receptorech, jejichž aktivace následně vede k regulaci uvolňování neurotrasmiterů (GABA, glutamátu, dopaminu nebo acetylcholinu), a to cestou ovlivnění vápníkových nebo draslíkových kanálů či glutamátových receptorů nebo širokého spektra různých proteinových kináz [1].
Endokanabinoidy se tvoří enzymaticky z lipidů obsažených v membránách buněk, v případě AEA cestou fosfolipázy D hydrolyzující N-acetyl-fosfatidyl-ethanolamin (NAPE-PLD – N-acetylphosphatidylethanolamine-hydrolysing phospholipase). Degradace endokanabinoidů probíhá intracelulárně, proto jsou endokanabinoidy aktivně transportovány do buněk a zde pak enzymaticky štěpeny na kyselinu arachidonovou a ethanolamin nebo glycerol.
Existuje řada možností, jak endokanabinoidní systém ovlivnit, a dosáhnout tak změny regulací. V řadě farmaceutických společností se týmy odborníků snaží získat principiálně nové léky, jejichž mechanizmus účinku by vycházel z působení na endokanabinoidní systém a jejichž klinické uplatnění by mohlo být významné v řadě medicínských oborů. Vznik poruchy regulace endokanabinoidního systému je poměrně snadný, a to nejen jako důsledek onemocnění, ale také jako důsledek užívání přírodních látek nebo některých léků. Pro vývoj nových léků a také pro poznání složitosti endokanabinoidního systému je nejdůležitější osud endokanabinoidů v organizmu.
Osud endokanabionoidů v organizmu
Pro pochopení regulace endokanabinoidního systému a mechanizmů působení nově vyvíjených léků je zásadně významný osud jednotlivých endokanabinoidů v organizmu. Ten je z hlediska vzniku (syntézy) a transportu endokanabinoidů do buňky (uptake) u všech stejný, avšak z hlediska metabolizmu jsou mezi dvěma hlavními endokanabinoidy – AEA a 2-AG – zásadní rozdíly.
Syntéza endokanabinoidů je v případě AEA zajišťována NAPE-PLD [10] a v případě 2-AG pak diacylglycerol lipázou (DAGL-a – diacylglycerol lipase a, DAGL-b – diacylglycerol lipase b) [11].
Transport endokanabinoidů do buněk zajišťují transportní systémy nazývané proteiny vázající mastné kyseliny (FABP 5 a FABP 7 – fatty acid-binding protein) a z menší části také další transportní systémy, např. proteiny tepelného šoku (HSP – heat shock proteins) [12]. To je klinicky významné, protože řada léků nebo jejich metabolitů či přírodních látek tento transport inhibuje. Například metabolit paracetamolu označovaný jako AM404 (tj. N-arachidonoyl-aminofenol) působí in vivo jako silný inhibitor těchto transportních systémů (zejména FABP5), a analgetický účinek paracetamolu tak může být, mimo jiné, dán i tímto jeho působením [13]. Podobně transport endokanabinoidů do buněk inhibují některé kanabinoidy jako např. D-9-tetrahydrokanabinol nebo kanabidiol [14].
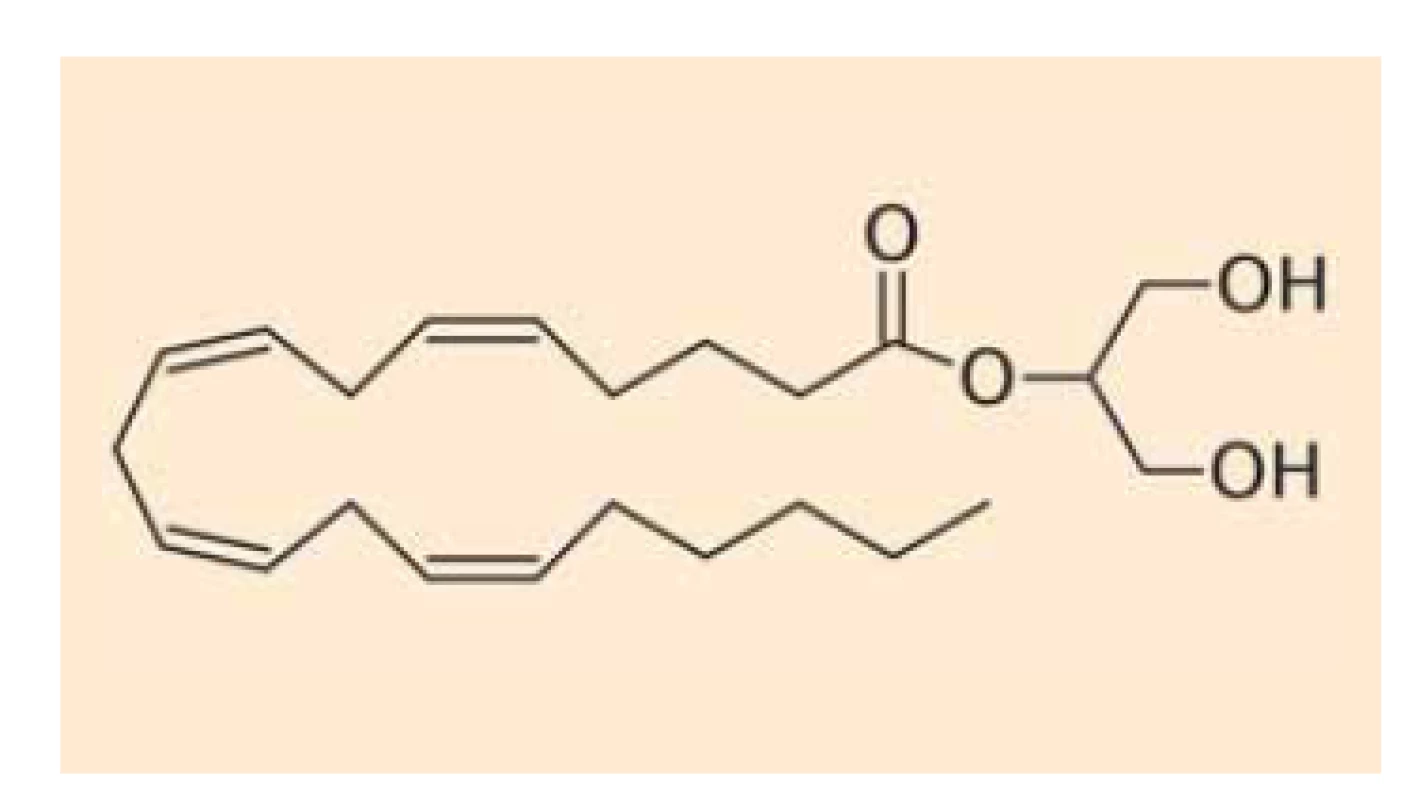
Endokanabinoidy nejsou v buňkách vezikulárně skladovány (podobně jako např. serotonin), ale jsou intracelulárně deamidovány či deesterifikovány a oxidovány za vzniku metabolitů, které nemají afinitu ke kanabinoidním receptorům. Anandamid (obr. 1) se takto mění na kyselinu arachidonovou a ethanolamin cestou hydrolázy amidů mastných kyselin (FAAH – fatty acid amide hydrolase) [15], z menší části je pak hydrolyzován také N-acylethanolamin amidázou (NAAA – N-acylethanolamine-hydrolyzing acid amidase) [16], alternativní cestou odbourávání anandamidu je tvorba prostamidu E2 cestou cyklooxygenázy-2 (OX-2) [17]. 2-AG (obr. 2) se pak mění na kyselinu arachidonovou a glycerol cestou lipázy pro monoacyl-glyceroly (MAGL – monoacylglycerol lipase) či hydrolázámi ABDH6 a ABDH12 (alpha/beta domain hydrolases 6 and 12) nebo podobně jako anandamid (z malé části) cestou FAAA [18]. Také v případě 2-AG existuje alternativní cesta odbourávání za vzniku glycerol-esteru prostaglandinu PGE2 [17]. Schematické znázornění odbourávání dvou nejvýznamnějších endokanabinoidů je znázorněno na schématu 1. Aktivita výše uvedených hydroláz může být ovlivněna současným užíváním jejich inhibitorů nebo genetickým polymorfizmem.
Fig. 1. Chemical structure of
anandamide.
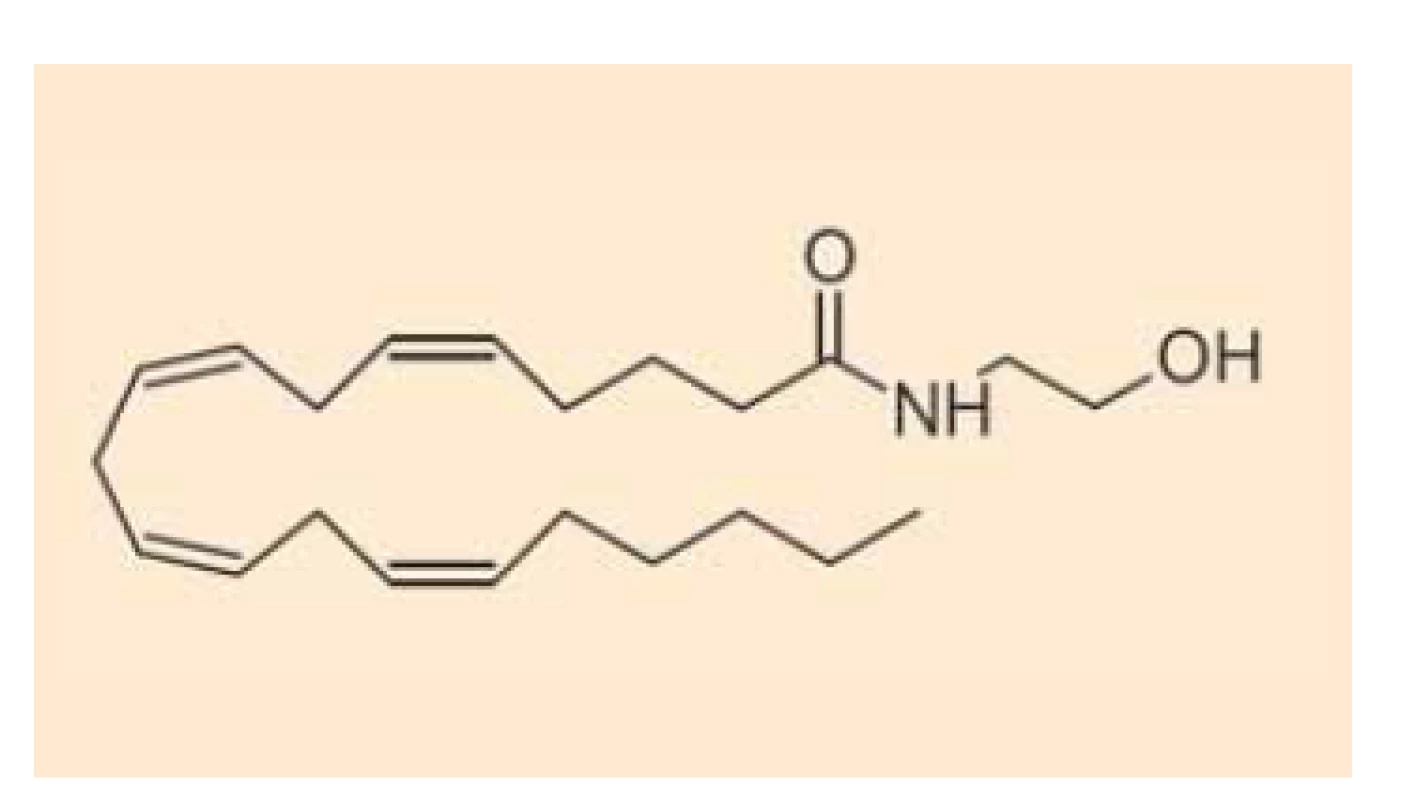
Fig. 2. Chemical structure of
2-arachidoyl-glycerol.
Poznámka: PTGDS je prostaglandin-H2 D-isomeráza, PGES je prostaglandin E syntáza, TXS je tromboxan A syntáza,
PTGIS je prostaglandin I syntáza a AKR1B1 je aldóza reduktáza.
Scheme 1. Scheme of conversion of anandamide or 2-arachidonoyl-glycerol to arachidonic acid (via FAAH and MAGL,
respectively) and formation of prostaglandins, prostamides, or esters of prostaglandins with glycerol (via COX-2).
Note: PTGDS is prostaglandin-H2 D-isomerase, PGES is prostaglandin E synthase, TXS is thromboxane A synthase,
PTGIS is prostaglandin I synthase, and AKR1B1 is aldose reductase.

V případě inhibitorů FAAH jsou již v současnosti vyvíjeny léky s protizánětlivým, analgetickým, anxiolytickým, antidepresivním a antineurodegenerativním účinkem [19]. Některé z těchto látek se momentálně nachází ve II. fázi klinického zkoušení, jedná se např. o látku s označení PF-04457845 s významným protizánětlivým a analgetickým účinkem [20] a velmi dobrým efektem při terapii závislostí [21]. V souvislosti s inhibitory FAAH byly v minulosti popsány tragické výsledky v rámci I. fáze klinického hodnocení. V případě látky označené jako BIA 10-2474 probíhalo ve Francii klinické hodnocení I. fáze, přičemž u pěti jeho účastníků došlo k velmi vážným nežádoucím účinkům, z toho k úmrtí jednoho z dobrovolníků [22].
V případě genetického polymorfizmu FAAH jsou některé polymorfizmy (např. rs324420) spojeny s užíváním návykových látek nebo alkoholu s výrazně vyšším rizikem vzniku závislosti [23] nebo horších výsledků učení [24], ale také s obezitou [25]. U nositelů polymorfizmu rs2295633 bylo zjištěno zvýšené riziko epizody psychózy po použití konopí [26]. Bylo také prokázáno, že genetický polymorfizmus FAAH rs2295633 souvisí patrně s výskytem poruchy pozornosti s hyperaktivitou (ADHD – attention deficit hyperactivity disorder) [27].
V případě inhibitorů MAGL jsou také již v současnosti vyvíjeny léky např. pro různá neurologická nebo psychiatrická onemocnění či jako analgetika. Ve II. fázi klinického hodnocení je např. látka s označením ABX-1431 u pacientů s Tourettovým syndromem [28]. Již delší dobu je známo, že endokanabinoidy mají protinádorový efekt založený na antiproliferativním efektu, inhibici metastazování a indukci apoptózy [29]. Inhibitory MAGL by se v budoucnu mohly stát také léky účinnými u karcinomu endometria [30], i když k dispozici jsou dosud jen výsledky experimentálních studií. V každém případě počet patentů na látky s inhibičním účinkem na MAGL v poslední době dramaticky vzrostl [31].
V případě genetického polymorfizmu MAGL je ve srovnání s FAAH k dispozici méně informací. Genetický polymorfizmus rs604300 byl mimo jiné v pozitivní korelaci s budoucí závislostí na konopí [32]. Obdobné výsledky byly získány pro polymorfizmus rs484061 a pro poruchy při příjmu alkoholu u adolescentů [33].
Dlužno doplnit, že situaci dále komplikují polymorfizmy samotných kanabinoidních receptorů. V případě genetického polymorfizmu CB1 korelují některé polymorfizmy (např. rs1049353) se sníženou účinností antidepresivní terapie [34], s obezitou [35], impulzivitou adolescentů [36] a možná i s patologickým hráčstvím [37]. Výskyt jiného polymorfizmu (rs806368) pak byl asociován s výskytem preeklampsie [38] nebo s výskytem panické úzkostné poruchy [39]. V případě genetického polymorfizmu CB2 byla např. nalezena asociace mezi výskytem polymorfizmu rs35761398 a imunitní trombocytopenické purpury [40] či roztroušené sklerózy [41].
Dysfunkce endokanabinoidního systému vzniklá z jakéhokoliv důvodu se projevuje různými změnami. Například snížení aktivity FAAH vedlo u myší ke zvýšení koncentrací anandamidu na synaptické štěrbině (zejména v hypothalamu), což se projevilo zvýšením příjmu potravy a skladování energie, přičemž zvýšená míra skladování energie nebyla na příjmu potravy závislá [42]. Další často se vyskytující symptomy, jako je bolest nebo deprese, mohou také souviset s dysfunkcí endokanabinoidního systému [43], přičemž terapie analgetiky a/nebo antidepresivy nemusí být dostatečně účinná bez dosažení úpravy dysfunkce endokanabinoidního systému. Rozsáhle byla studována dysfunkce endokanabinoidního systému v gynekologii, přičemž v aktuálním shrnutí dosavadních poznatků [3] autoři uvádějí, že hladiny anandamidu jsou zvýšené u pacientek s endometriózou nebo v případě potratu, v případě karcinomu endometria či u mimoděložního těhotenství. Výskyt karcinomu endometria navíc může souviset s genetickým polymorfizmem CB2 receptoru.
Látky ovlivňující kanabinoidní receptory
Parciální agonisté CB1 a/nebo CB2
Parciální agonisté aktivují příslušný receptor, ale jejich účinnost je jen částečná ve srovnání s čistým agonistou. Mezi parciální agonisty působící na CB1 receptorech patří některé endokanabinoidy (např. anandamid), přírodní látky (např. D9-THC – D-9-tetrahydrokanabinol, THC) a řada syntetických látek vyvíjených jako léčiva.
Čistí agonisté CB1 a/nebo CB2
Čistí agonisté aktivují příslušný receptor a mají schopnost (v závislosti na dávce) vyvolat maximální účinek. Mezi čisté agonisty působící na CB1 receptorech patří některé endokanabinoidy (např. 2-AG), některé přírodní látky (např. epigalokatechin-galát – EGKG – obsažený v zeleném čaji) nebo syntetická léčiva (např. nabilon).
Antagonisté CB1 a/nebo CB2
Antagonisté kanabinoidních receptorů byly v minulosti vyvíjeny a dokonce i registrovány jako léčiva. Rimonabant (léčivý přípravek Acomplia) byl v zemích EU registrován 19. 6. 2006 v indikaci snížení tělesné hmotnosti, avšak již 23. října 2008 doporučila Evropská léková agentura pozastavení registrace a k 30. 1. 2009 byl rimonabant z trhu stažen pro zvýšený výskyt depresí a sebevražedného chování. Za krátkou dobu registrace bylo hlášeno celkem 36 000 závažných psychiatrických nežádoucích účinků. To mělo vliv na vývoj obdobných léků, a proto byl zastaven klinický vývoj surinabantu (31. 10. 2008), taranabantu (2. 10. 2008) a otenabantu (6. 10. 2008).
Přírodní látky působící na CB1 a/nebo CB2
Překvapivě velké množství rostlin obsahuje látky, které působí jako agonisté nebo parciální agonisté na CB1 či CB2 receptorech [44].
Nejznámější je jistě konopí seté (Cannabis sativa), které obsahuje až 120 kanabinoidů, z nichž nejvýznamnější jsou D-9-tetrahydrokanabinol (D9-THC, THC) a D-8-tetrahydrokanabinol (D8-THC), obě látky působí jako parciální agonisté CB1 a CB2, indukují tvorbu anandamidu a mají významné psychotropní účinky. K dalším kanabinoidům patří kanabidiol (CBD), který také působí jako parciální agonista CB1 a CB2, avšak nepůsobí psychotropně, vedle toho CBD také inhibuje aktivitu FAAH, čímž zpomaluje odbourávání anandamidu, a zvyšuje tak je koncentrace. Kanabinol (CBN) má vyšší afinitu k CB2 než CB1 a vykazuje jen mírné psychotropní účinky.
K dalším rostlinám obsahujícím látky působící na kanabinoidní receptory patří vedle výše uvedeného zeleného čaje třapatka nachová (Camellia sinensis) nebo úzkolistá (Echinacea purpurea, resp. Echinacea angustifolia). Obsahují alkylamidy, které mají parciálně agonistický účinek na CB2 receptory, což vědecky vysvětluje důvod jejich empiricky zjištěné účinnosti při poruchách imunity. Dále je třeba uvést plamatku zelnou (Acmella oleracea), která také obsahuje alkylamid, konkrétně spilanthol, který působí jako agonista na CB2 receptorech. Pepřovník opojný (Kava kava) obsahuje yangonin, který působí agonisticky na CB1 receptorech a který je patrně odpovědný za „opojné“ účinky této rostliny. Jaterník (Radula marginata) obsahuje chemicky obdobnou látku, jako je yangonin, a to perotetinen, který také působí jako agonista na CB1 receptorech.
Smil písečný (Helichrysum umbraculigerum) obsahuje kanabigerol, což je kanabinoid působící jako agonista na CB1 a CB2 receptorech, který je také obsažen v konopí setém. Kakao (Theobroma cacao) sice neobsahuje kanabinoidy, avšak obsahuje hned tři látky, které působí jako inhibitory FAAH, čímž snižuje odbourávání anandamidu, a zvyšuje tak jeho koncentrace. I v tomto případě je empirické pozorování, že konzumace čokolády přináší štěstí, patrně založeno na vědeckých poznatcích. Pepřovník černý (Piper nigra) obsahuje b-karyofylen, který je selektivní agonista působící na CB2 receptorech. Pepřovník dlouhý (Piper longa) obsahuje alkaloid guineesin, který je inhibitorem uptake anandamidu a současně je in vitro silný inhibitor MAO.
Interakce mezi endokanabinoidy a exokanabinoidy
Jak bylo uvedeno, některé běžně používané léky mohou ovlivňovat endokanabinoidní systém. Jedná se zejména o paracetamol, jehož metabolit AM404, tj. N-arachidonoyl-aminofenol, je duální inhibitor FAAH a uptake endokanabinoidů. Paracetamol tak efektivně zvyšuje koncentrace jak anandamidu (inhibicí FAAH a uptake), tak i 2-AG (inhibicí uptake). Zdá se, že tento mechanizmus je odpovědný za alespoň část analgetické aktivity paracetamolu [13].
Také další běžně užívané analgetikum metamizol má pravděpodobně část analgetického působení „zajištěnu“ díky metabolitům metamizolu s kyselinou arachidonovou [45], které působí jako duální inhibitor FAAH a uptake endokanabinoidů.
Nelze vyloučit, že výrazné ovlivnění osudu anandamidu nebo jiných endokanabinoidů může být spojeno s klinicky významnými nežádoucími účinky. Již jsme uvedli, že velmi silný inhibitor FAAH označený jako BIA 10-2474 byl ve studii I. fáze klinického hodnocení spojován s výskytem úmrtí zdravého dobrovolníka. Cílem této studie [22] bylo zhodnotit bezpečnost a toleranci BIA 10-2474 a zjistit její základní farmakokinetické a farmakodynamické parametry. Do studie bylo zařazeno celkem 116 zdravých dobrovolníků. K úmrtí dobrovolníka došlo v části klinické studie, ve které byla hodnocena tolerance jednorázové dávky 0,25–100 mg a opakovaných dávek 2,5–50 mg podávaných po dobu 10 dnů. Ve skupině šesti dobrovolníků, kterým byla podávána opakovaná dávka 50 mg, byly závažné nežádoucí účinky pozorovány v pěti případech. Vzhledem k tomu, že došlo k úmrtí jednoho z dobrovolníků, byla studie ukončena a další klinický vývoj BIA 10-2474 byl zastaven. Příčina úmrtí není dosud definitivně uzavřena [46].
Závěr
Endokanabinoidní systém a léky, které jej ovlivňují, patří k velmi perspektivním oblastem dalšího výzkumu. Důvodem je především skutečnost, že endokanabinoidní signální dráhy hrají významnou roli v celé řadě patologických stavů (onemocnění CNS, gastrointestinálního traktu, kardiovaskulární onemocnění, metabolický syndrom, bolest atd.) nebo fyziologických stavů (těhotenství, porod). Současně jsou tyto signální dráhy úzce propojeny s řadou dalších regulačních drah (opioidní receptory, vaniloidní receptory atd.).
Endokanabinoidy kvůli změnám v expresi kanabinoidních receptorů, transportních systémů zajišťujících jejich uptake a enzymů zajišťujících jejich odbourávání představují dosud ne zcela poznaný systém uplatňující se v řadě fyziologických regulací.
Personalizovaná medicína, ke které vývoj neodvratně spěje, bude navíc v budoucnosti vyžadovat informace o genetických polymorfizmech receptorů, transportních systémů nebo enzymů, což umožní cílenější a pro pacientku na míru „šitou“ terapii.
Nadto je vyvíjena řada léků, které endokanabinoidní systém ovlivňují. Jedná se nejen o agonisty působící na CB1/CB2 receptorech, takové léky již ostatně dostupné jsou, ale především o antagonisty působící na CB1/CB2 a také o inhibitory FAAH či MAGL.
Doručeno/Submitted: 2. 8. 2021
Přijato/Accepted: 13. 9. 2021
PharmDr. Josef Suchopár
DrugAgency, a. s.
Klokotská 833/1a
142 00 Praha 4
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Dedikace: Podpořeno MZ ČR – RVO (,,Všeobecná fakultní nemocnice v Praze – VFN, 00064165‘‘).
Dedication: Supported by MH CZ – DRO ("General University Hospital in Prague – VFN, 00064165")
Sources
1. Pertwee RG. Cannabinoid pharmacology: the first 66 years. Br J Pharmacol 2006; 147 (Suppl 1): S163–S171. doi: 10.1038/sj.bjp.0706406.
2. Rodríguez de Fonseca F, Del Arco I, Bermudez-Silva FJ et al. The endocannabinoid system: physiology and pharmacology. Alcohol Alcohol 2005; 40 (1): 2–14. doi: 10.1093/alcalc/ agh110.
3. Maia J, Fonseca BM, Teixeira N et al. The fundamental role of the endocannabinoid system in endometrium and placenta: implications in pathophysiological aspects of uterine and pregnancy disorders. Hum Reprod Update 2020; 26 (4): 586–602. doi: 10.1093/humupd/dmaa 005.
4. Kozakiewicz ML, Grotegut CA, Howlett AC. Endocannabinoid system in pregnancy maintenance and labor: a mini-review. Front Endocrinol (Lausanne) 2021; 12 : 699951. doi: 10.3389/ fendo.2021.699951.
5. Matsuda LA, Lolait SJ, Brownstein MJ et al. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Nature 1990; 346 (6284): 561–564. doi: 10.1038/346561a0.
6. Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature 1993; 365 (6441): 61–65. doi: 10.1038/365061a0.
7. Mackie K. Cannabinoid receptors: where they are and what they do. J Neuroendocrinol 2008; 20 (Suppl 1): 10–14. doi: 10.1111/j.1365 - 2826.2008.01671.x.
8. Devane W, Hanus L, Breuer A et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 1992; 258 (5090): 1946–1949. doi: 10.1126/science.1470919.
9. Pacher P, Bátkai S, Kunos G. The endocannabinoid system as an emerging target of pharmacotherapy. Pharmacol Rev 2006; 58 (3): 389–462. doi: 10.1124/pr.58.3.2.
10. Okamoto Y, Morishita J, Tsuboi K et al. Molecular characterization of a phospholipase D generating anandamide and its congeners. J Biol Chem 2004; 279 (7): 5298–5305. doi: 10.1074/jbc.M306642200.
11. Yoshida T, Fukaya M, Uchigashima M et al. Localization of diacylglycerol lipase-alpha around postsynaptic spine suggests close proximity between production site of an endocannabinoid, 2-arachidonoyl-glycerol, and presynaptic cannabinoid CB1 receptor. J Neurosci 2006; 26 (18): 4740–4751. doi: 10.1523/jneurosci.0054-06.2006.
12. Fowler CJ. Anandamide uptake explained? Trends Pharmacol Sci 2012; 33 (4): 181–185. doi: 10.1016/j.tips.2012.01.001.
13. Jóźwiak-Bebenista M, Nowak JZ. Paracetamol: mechanism of action, applications and safety concern. Acta Pol Pharm 2014; 71 (1): 11–23.
14. Elmes MW, Kaczocha M, Berger WT et al. Fatty acid-binding proteins (FABPs) are intracellular carriers for Delta9-tetrahydrocannabinol (THC) and cannabidiol (CBD). J Biol Chem 2015; 290 (14): 8711–8721. doi: 10.1074/jbc.M114.618447.
15. Di Marzo V, Maccarrone M. FAAH and anandamide: is 2-AG really the odd one out? Trends Pharmacol Sci 2008; 29 (5): 229–233. doi: 10.1016/j.tips.2008.03.001.
16. Sun YX, Tsuboi K, Zhao LY et al. Involvement of N-acylethanolamine-hydrolyzing acid amidase in the degradation of anandamide and other N-acylethanolamines in macrophages. Biochim Biophys Acta 2005; 1736 (3): 211–220. doi: 10.1016/j.bbalip.2005.08.010.
17. Urquhart P, Nicolaou A, Woodward DF. Endocannabinoids and their oxygenation by cyclo-oxygenases, lipoxygenases and other oxygenases. Biochim Biophys Acta 2015; 1851 (4): 366–376. doi: 10.1016/j.bbalip.2014.12. 015.
18. Savinainen JR, Saario SM, Laitinen JT. The serine hydrolases MAGL, ABHD6 and ABHD12 as guardians of 2-arachidonoylglycerol signalling through cannabinoid receptors. Acta Physiol (Oxf) 2012; 204 (2): 267–276. doi: 10.1111/j.1748 - 1716.2011.02280.x.
19. Tripathi RK. A perspective review on fatty acid amide hydrolase (FAAH) inhibitors as potential therapeutic agents. Eur J Med Chem 2020; 188 : 111953. doi: 10.1016/j.ejmech.2019.111 953.
20. Li GL, Winter H, Arends R et al. Assessment of the pharmacology and tolerability of PF-04457845, an irreversible inhibitor of fatty acid amide hydrolase-1, in healthy subjects. Br J Clin Pharmacol 2012; 73 (5): 706–716. doi: 10.1111/ j.1365-2125.2011.04137.x.
21. D‘Souza DC, Cortes-Briones J, Creatura G et al. Efficacy and safety of a fatty acid amide hydrolase inhibitor (PF-04457845) in the treatment of cannabis withdrawal and dependence in men: a double-blind, placebo-controlled, parallel group, phase 2a single-site randomised controlled trial. Lancet Psychiatry 2019; 6 (1): 35–45. doi: 10.1016/s2215-0366 (18) 30 427-9.
22. Rocha JF, Santos A, Gama H et al. Safety, tolerability, and pharmacokinetics of FAAH inhibitor BIA 10-2474: a double-blind, randomized, placebo-controlled study in healthy volunteers. Clin Pharmacol Ther 2021. doi: 10.1002/cpt. 2290.
23. Sipe JC, Chiang K, Gerber AL et al. A missense mutation in human fatty acid amide hydrolase associated with problem drug use. Proc Natl Acad Sci U S A 2002; 99 (12): 8394–8399. doi: 10.1073/pnas.082235799.
24. Ney LJ, Matthews A, Hsu CK et al. Cannabinoid polymorphisms interact with plasma endocannabinoid levels to predict fear extinction learning. Depress Anxiety 2021; 38 (10): 1087–1099. doi: 10.1002/da.23170.
25. Doris JM, Millar SA, Idris I et al. Genetic polymorphisms of the endocannabinoid system in obesity and diabetes. Diabetes Obes Metab 2019; 21 (2): 382–387. doi: 10.1111/dom.13 504.
26. Bioque M, Mas S, Costanzo MC et al. Gene-environment interaction between an endocannabinoid system genetic polymorphism and cannabis use in first episode of psychosis. Eur Neuropsychopharmacol 2019; 29 (6): 786–794. doi: 10.1016/j.euroneuro.2019.04. 005.
27. Ahmadalipour A, Mehdizadeh Fanid L, Zeinalzadeh N et al. The first evidence of an association between a polymorphism in the endocannabinoid-degrading enzyme FAAH (FAAH rs2295633) with attention deficit hyperactivity disorder. Genomics 2020; 112 (2): 1330–1334. doi: 10.1016/j.ygeno.2019.07.024.
28. Cisar JS, Weber OD, Clapper JR et al. Identification of ABX-1431, a selective inhibitor of monoacylglycerol lipase and clinical candidate for treatment of neurological disorders. J Med Chem 2018; 61 (20): 9062–9084. doi: 10.1021/acs.jmedchem.8b00951.
29. Qin H, Ruan ZH. The role of monoacylglycerol lipase (MAGL) in the cancer progress. Cell Biochem Biophys 2014; 70 (1): 33–36. doi: 10.1007/s12013-014-9899-2.
30. Li X, Gao S, Li W et al. Effect of monoacylglycerol lipase on the tumor growth in endometrial cancer. J Obstet Gynaecol Res 2019; 45 (10): 2043–2054. doi: 10.1111/jog.14070.
31. Bononi G, Poli G, Rizzolio F et al. An updated patent review of monoacylglycerol lipase (MAGL) inhibitors (2018-present). Expert Opin Ther Pat 2021; 31 (2): 153–168. doi: 10.1080/13543776.2021.1841166.
32. Carey CE, Agrawal A, Zhang B et al. Monoacylglycerol lipase (MGLL) polymorphism rs604300 interacts with childhood adversity to predict cannabis dependence symptoms and amygdala habituation: evidence from an endocannabinoid system-level analysis. J Abnorm Psychol 2015; 124 (4): 860–877. doi: 10.1037/abn0000079.
33. Elkrief L, Spinney S, Vosberg DE et al. Endocannabinoid gene × gene interaction association to alcohol use disorder in two adolescent cohorts. Front Psychiatry 2021; 12 : 645746. doi: 10.3389/fpsyt.2021.645746.
34. Domschke K, Dannlowski U, Ohrmann P et al. Cannabinoid receptor 1 (CNR1) gene: impact on antidepressant treatment response and emotion processing in major depression. Eur Neuropsychopharmacol 2008; 18 (10): 751–759. doi: 10.1016/j.euroneuro.2008.05. 003.
35. Sadeghian M, Rahmani S, Mansoori A. G1359A variant of the cannabinoid receptor gene (rs1049353) and obesity-related traits and related endophenotypes: a meta-analysis. Ann Nutr Metab 2018; 73 (1): 76–85. doi: 10.1159/000490668.
36. Buchmann AF, Hohm E, Witt SH et al. Role of CNR1 polymorphisms in moderating the effects of psychosocial adversity on impulsivity in adolescents. J Neural Transm (Vienna) 2015; 122 (3): 455–463. doi: 10.1007/s00702-014 - 1266-3.
37. Qin H, Zeng J, Chen H et al. Can your DNA influence your bet-placing? The impact of cannabinoid receptor 1 gene on gambling tasks. Front Hum Neurosci 2018; 12 : 458. doi: 10.3389/ fnhum.2018.00458.
38. Bienertova-Vasku J, Bienert P, Dostalova Z et al. A common variation in the cannabinoid 1 receptor (CNR1) gene is associated with pre-eclampsia in the Central European population. Eur J Obstet Gynecol Reprod Biol 2011; 155 (1): 19–22. doi: 10.1016/j.ejogrb.2010.11. 004.
39. Peiró AM, García-Gutiérrez MS, Planelles B et al. Association of cannabinoid receptor genes (CNR1 and CNR2) polymorphisms and panic disorder. Anxiety Stress Coping 2020; 33 (3): 256–265. doi: 10.1080/10615806.2020.1732 358.
40. Ezzat DA, Hammam AA, El-Malah WM et al. Role of cannabinoid CB2 receptor gene (CNR2) polymorphism in children with immune thrombocytopenic purpura in beni-suef governorate in Egypt. Egypt J Immunol 2017; 24 (1): 57–66.
41. Tahamtan A, Rezaiy S, Samadizadeh S et al. Cannabinoid CB2 receptor functional variation (Q63R) is associated with multiple sclerosis in Iranian subjects. J Mol Neurosci 2020; 70 (1): 26–31. doi: 10.1007/s12031-019-01395-9.
42. Touriño C, Oveisi F, Lockney J et al. FAAH deficiency promotes energy storage and enhances the motivation for food. Int J Obes (Lond) 2010; 34 (3): 557–568. doi: 10.1038/ijo.2009.262.
43. Huang WJ, Chen WW, Zhang X. Endocannabinoid system: role in depression, reward and pain control (Review). Mol Med Rep 2016; 14 (4): 2899–2903. doi: 10.3892/mmr.2016.5585.
44. Di Marzo V, Piscitelli F. The endocannabinoid system and its modulation by phytocannabinoids. Neurotherapeutics 2015; 12 (4): 692–698. doi: 10.1007/s13311-015-0374-6.
45. Schlosburg JE, Radanova L, Di Marzo V et al. Evaluation of the endogenous cannabinoid system in mediating the behavioral effects of dipyrone (metamizol) in mice. Behav Pharmacol 2012; 23 (7): 722–726. doi: 10.1097/FBP.0b013e3283584794.
46. Hayes AW. Commentary on BIA 10-2474. Regul Toxicol Pharmacol 2020; 111 : 104541. doi: 10.1016/j.yrtph.2019.104541.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2021 Issue 6
-
All articles in this issue
- Srovnání využití dinoprostonu, misoprostolu a amniotomie při indukci vaginálního porodu
- Rekonstrukce prsou u pacientek s BRCA mutací a karcinomem prsu – náš přístup
- Parciálna mola hydatidóza s nejednoznačným histopatologickým obrazom – význam genetickej diagnostiky
- Robotická stagingová lymfadenektomie v těhotenství – kazuistika
- Cervikální tuberkulóza u postmenopauzální ženy
- Autoimunitní anti-N-methyl-D-aspartát receptorová encefalitida – paraneoplastický projev ovariálního teratomu
- Parazitární leiomyomy – kazuistika a rešerše článků
- Kontinuální monitorace glykemie – nový a rozšiřující se prvek v péči o pacientky s diabetes mellitus v době těhotenství
- Covid-19 jako rizikový faktor intrauterinního úmrtí plodu
- Endokanabinoidy
- Úloha mikrobiomu v těhotenství
- Zemřel profesor prim. em. MR Dr. Rudolf Slunský, DrSc.
- Poděkování recenzentům
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Úloha mikrobiomu v těhotenství
- Srovnání využití dinoprostonu, misoprostolu a amniotomie při indukci vaginálního porodu
- Rekonstrukce prsou u pacientek s BRCA mutací a karcinomem prsu – náš přístup
- Covid-19 jako rizikový faktor intrauterinního úmrtí plodu
