Monitorování hladin markerů aktivace endotelu během fyziologické gravidity
Monitoring of endothelial activation markers during physiological pregnancy
Aim of the study:
To establish endothelial activation markers which could uncover endothelial damage during physiological pregnancy.
Type of study:
Prospective study.
Method:
We examined 403 pregnant women with a physiological pregnancy. Venous blood samples were collected from the women at the beginning of the pregnancy, a second sample was collected in the interval 24-28 weeks gestation. Parameters were examined using methods: t-PA – ELISA, PAI-1 – ELISA, vWF Ag – EIA ePCR – ELISA, MMP-2,9 – ELISA with fluorogenic detection, TIMP-2 – ELISA, endothelial microparticles - flow cytometry.
Results:
The level of vWF antigen increased during the entire course of pregnancy (in the I. trimester the average level was 152,32%, in the II. and III. trimester 173.34% and 216.20% respectively). At the same time, vWf activity also increased (I. trimester average level 130.20%, II. and III. trimester 150.09% and 181.91% respectively). The level of thrombomodulin significantly increased during pregnancy (I. trimester average level 19,05 ng/ml, II. and III. trimester 28,47 ng/ml and 39,86 ng/ml respectively). The level of soluble form of EPCR increased during pregnancy (I. trimester average level 201.76 ng/ml, II. and III. trimester 274.68 ng/ml and 324.07 ng/ml respectively). The level of PAI–1 increased during the entire course of pregnancy (I. trimester average level 36.14 ng/ml, II. and III. trimester 50.07 ng/ml and 60.12 ng/ml respectively). The level of t - PA did not change significantly during the course of pregnancy (I. trimester average level 2.48 ng/ml, II. and III. trimester 2.97 and 3,34 ng/ml respectively). The levels of MMP-2 (I. trimester average level 9043,76 RFU, II. and III. trimester 9315.38 and 8800.27 RFU respectively), MMP-9 (I. trimester average level 8371.90, II. and III. trimester 8290.81 and 7470.50 respectively), TIMP-2 (I. trimester average level 92.5 ng/ml, II. and III. trimester 98.5 and 96.5 ng/ml respectively) or endothelial microparticles (I. trimester average level 3838.38 particles/μl, II. and III. trimester 3836.59 and 3650.59 particles/μl respectively) did not change significantly throughout the individual trimesters.
Conclusion:
We confirmed the hypothesis regarding the significant influence pregnancy has on changes in levels of these markers.
Key words:
endothelium, pregnancy, activation, preeclampsia.
Autoři:
J. Procházková 1; I. Dhaifallah 2; A. Měchurová 3; R. Pilka 2; O. Šimetka 4
; L. Slavík 1; J. Úlehlová 1; M. Lubušký 2; M. Procházka 2
Působiště autorů:
Hemato-onkologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. K. Indrák, DrSc.
1; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta doc. MUDr. R. Pilka, Ph. D.
2; Ústav pro péči o matku a dítě, Praha, ředitel doc. MUDr. J. Feyereisl, CSc.
3; Porodnicko-gynekologická klinika FN, Ostrava, přednosta MUDr. O. Šimetka
4
Vyšlo v časopise:
Ceska Gynekol 2010; 75(2): 92-100
Souhrn
Cíl studie:
Stanovit markery aktivace endotelu k odhalení endoteliálního poškození během fyziologické gravidity.
Typ studie:
Prospektivní studie.
Metodika:
Vyšetřili jsme 403 těhotných žen s fyziologickou graviditou. Ženám byla odebrána venózní krev na začátku gravidity, druhý odběr byl proveden v období mezi 24.–28. týdnem. Parametry byly vyšetřovány metodikami: t-PA – ELISA, PAI-1 – ELISA, vWF Ag – EIA ePCR – ELISA, MMP-2,9 – ELISA s fluorogenní detekcí, TIMP-2 – ELISA, endoteliální mikropartikule – průtoková cytometrie.
Výsledky:
Hladina antigenu vWf stoupala během celého těhotenství (v I. trimestru průměrná hladina 152,32 %, ve II., resp. III. trimestru 173,34, resp. 216,20 %). Současně stoupala aktivita vWf, v I. trimestru průměrná hladina 130,20 %, ve II., resp. III. trimestru 150,09, resp. 181,91 %). Hladina trombomodulinu významně stoupala během gravidity (v I. trimestru průměrná hladina 19,05 ng/ml, ve II. resp. III. trimestru 28,47 ng/ml, resp. 39,86 ng/ml). Hladina solubilní formy EPCR stoupala během gravidity (v I. trimestru průměrná hladina 201,76 ng/ml, ve II., resp. III. trimestru 274,68, resp. 324,07 ng/ml). Hladina PAI-1 stoupala během celého těhotenství (v I. trimestru průměrná hladina 36,14 ng/ml, ve II., resp. III. trimestru 50,07, resp. 60,12 ng/ml). Hladina t-PA se během gravidity významněji neměnila (v I. trimestru průměrná hladina 2,48 ng/ml, ve II., resp. III. trimestru 2,97, resp. 3,34 ng/ml). Hladiny MMP-2 (v I. trimestru průměrná hladina 9043,76 RFU (fluorescenčních jednotek), ve II., resp. III. trimestru, 9315,38 resp. 8800,27 RFU), MMP-9 (v I. trimestru průměrná hladina 8371,90 RFU, ve II., resp. III. trimestru 8290,81, resp. 7470,50 RFU), TIMP-2 (v I. trimestru průměrná hladina 92,5 ng/ml, ve II., resp. III. trimestru 98,5, resp. 96,5 ng/ml) ani endotelových mikropartikulí (v I. trimestru průměrná hladina 3838,38 částic/μl, ve II., resp. III. trimestru 3836,59, resp. 3630,59 částic/μl) se neměnily významně v jednotlivých trimestrech.
Závěr:
Potvrdili jsme hypotézu o výrazném vlivu gravidity na změny hladin těchto markerů.
Klíčová slova:
endotel, těhotenství, aktivace, preeklampsie.
ÚVOD
Fyziologická gravidita je provázena výraznými změnami ve všech aspektech hemostázy. Změny zahrnují jak zvýšení hladin většiny koagulačních faktorů (I, V, VII, VIII, vWf, IX, X, XII), tak snížení hladiny či účinnosti některých přirozených inhibitorů koagulace (hladina proteinu S, snížená senzitivita vůči aktivovanému proteinu C) a výrazně je modifikován i fibrinolytický systém (snížení t-PA, zvýšení PAI-1, PAI-2) [8, 9].
V těhotenství dochází vlivem hormonálních a hemodynamických změn také k významnému ovlivnění funkce endotelu. Endotelové buňky tvoří spolu s buňkami hladkého svalstva a fibroblasty cévní stěnu. Jsou umístěny v jedné vrstvě na luminálním povrchu cév. Netvoří jen pasivní výstelku cévního lumen, ale naopak jsou extrémně metabolicky aktivním orgánem tvořícím bariéru mezi krví a tkáněmi. Lze je považovat jak za senzorické struktury přijímající hemodynamické a humorální signály, tak za efektorové buňky, produkující celou řadu působků s vlivem jak na sousední vrstvu svalových buněk, tak cestou cirkulace na celý organismus. V organismu dospělého člověka se nachází 6 trilionů endotelových buněk, ty tvoří orgán vážící 1 kg a zaujímající plochu 5000 m2 [2].
Endotelové buňky obsahují na svém povrchu celou řadu receptorů, kterými přijímají jak hemodynamické signály (intenzitu pulzace, proudění a roztažení cévní stěny), tak humorální působky (receptory cytokinů, růstových faktorů, bakteriálních substancí, angiotenzinu II, koagulačních faktorů II, V, IX, X apod.) [3]. Na základě těchto podnětů dojde k aktivaci endotelu, což vede k uvolňování mnoha produktů, kterými endotelové buňky řídí vazomotoriku (cévní tonus, krevní tlak, perfuzi orgánů), koagulaci (adhezi a agregaci trombocytů, aktivaci koagulační kaskády a fibrinolýzy), udržování reologických vlastností krve a v neposlední řadě zánětlivou reakci (migraci a chemotaxi leukocytů, monocytů a makrofágů, fagocytózu, cévní permeabilitu) [1, 3]. Všechny tyto děje potom hrají klíčovou roli v regulaci buněčného metabolismu.
V poslední době dochází k prudkému rozvoji poznatků o funkci produktů aktivace endotelových buněk a snaze vyvinout laboratorní metody k jejich detekci. Stejně tak je zájem odborníků zaměřen na význam stanovení těchto markerů u patologických stavů spojených s poškozením endotelu, jako jsou projevy aterosklerózy (ischemická choroba srdeční a dolních končetin, ischemické cévní mozkové příhody), vznik maligních nádorů a jejich metastazování a v neposlední řadě některé patologické stavy v těhotenství (preeklampsie).
Bylo již potvrzeno, že v klinické fázi těchto onemocnění dochází k signifikantnímu zvýšení některých látek, které signalizují poškození endotelu – endotelin, vitronektin a endoteliální adhezivní molekuly VCAM-1 (vascular cell adhesive molecules), ICAM-1 (intercellular adhesive molecules) [7]. Nyní se rozvíjejí laboratorní metody stanovující další markery aktivace endotelu, např. t-PA, PAI-1, vWF, EPCR, metaloproteinázy a jejich inhibitory, trombomodulin a endotelové mikropartikule s prokoagulační aktivitou, jejichž prediktivní klinický význam již byl prokázán např. při alteraci endotelu následkem aterosklerózy, méně jsou zatím prozkoumány jejich změny v průběhu těhotenství.
Tkáňový aktivátor plazminogenu
Tkáňový aktivátor plazminogenu (t-PA) je detekovatelný v celé řadě tělních tekutin (sliny, mléko, žluč, cerebrospinální mok, moč [5]. Sekrece t-PA v klidovém stavu je velmi nízká, stejně tak jako jeho hladina v cirkulaci, odkud je rychle degradován, ale syntéza stimulovaná různými podněty je velmi rychlá. Endotelové buňky jsou hlavním místem jeho produkce v organismu, dalším zdrojem jsou aktivované monocyty a megakaryocyty [5]. T-PA je hlavním aktivátorem fibrinolýzy a jediným specifickým aktivátorem plazminogenu, který štěpí na aktivní molekuly plazminu [5]. Plazmin potom odbourává fibrin obsažený v trombech. V plazmě se t-PA nachází v koncentraci 2–8 ng/ml, nicméně 95 % tohoto množství je vázáno v komplexech s PAI-1 a pouze 5 % tvoří volná forma. Zvýšené hodnoty t-PA nacházíme po chirurgických zákrocích, traumatech, při zánětech, postižení cév aterosklerózou, léčbě heparinem, ale i po větší fyzické zátěži a stresu.
Inhibitor aktivátoru plazminogenu 1
Inhibitor aktivátoru plazminogenu (PAI-1) je přirozený inhibitor t-PA a urokinázy a je produkován aktivovanými endotelovými buňkami, hepatocyty a megakaryocyty [5]. V plazmě se vyskytuje ve dvou formách – ve funkčně aktivní volné formě, která je stabilizována vazbou na vitronektin a ve funkčně inaktivní formě v komplexu s t-PA či urokinázou – 80 % celkového množství.
Bazální hladina v plazmě je nízká, vykazuje diurnální cyklus s ranním peakem. PAI-1 je „proteinem akutní fáze“, jeho hladina se tedy zvyšuje při infekcích, malignitách a v pooperačních stavech [4]. Zvýšená hladina PAI-1 je nalézána u pacientů s projevy aterosklerózy, při terapii heparinem, zánětech a v těhotenství. Fyziologická koncentrace PAI-1 je za bazálních podmínek 7–23 ng/ml.
Von Willebrandův faktor
Von Willebrandův faktor (vWf) je produktem převážně endotelových buněk – 85 % celkového množství a je pak skladován ve Weibelových-Paladeho tělískách, zbývajících 15 % je tvořeno v megakaryocytech a a skladováno v α-granulích trombocytů. Von Willebrandův faktor hraje klíčovou roli v tvorbě primární hemostatické zátky – umožňuje adhezi trombocytů k místu poškození cévní stěny a dále stabilizuje koagulační faktor VIII, který chrání před degradací. Fyziologická hladina antigenu vWf je 61-158 % a zvyšuje se u celé řady stavů spojených s aktivací endotelu – trauma, operace, infekce, malignity.
Trombomodulin
Trombomodulin (TM) je transmembránový glykoprotein s významným inhibičním účinkem na proces koagulace. Je exprimován na cévním endotelu a trofoblastu. Jeho solubilní forma v plazmě je považována za indikátor endotelového poškození [9], při kterém je z povrchu endotelových buněk uvolňován proteolytickým štěpením elastázou neutrofilů [5]. Funkcí TM je inhibice trombinu, se kterým vytváří po vazbě inaktivní komplex [4]. Další klíčovou roli v inhibici koagulace hraje aktivací proteinu C, a to prostřednictvím komplexu s aktivovaným koagulačním faktorem II [4]. Fyziologická koncentrace je u mužů 10–52 ng/ml, u žen 10–42 ng/ml.
Endotelový receptor proteinu C
Endotelový receptor proteinu C (EPCR) je transmembránový glykoprotein primárně lokalizovaný na endotelu velkých cév. Jeho funkce spočívá v umožnění vazby proteinu C (PC) na endotel a zde jeho interakci s komplexem trombin-trombomodulin, což výrazně urychluje aktivaci PC (až pětinásobně) a současně propůjčuje PC jeho protizánětlivou aktivitu [4]. Fyziologické rozmezí solubilní formy EPCR je 65–230 ng/ml.
Endotelové mikropartikule
Neporušený povrch endotelu hraje klíčovou roli v udržování integrity cévní stěny a hemostázy. Při alteraci endotelu a obnažení subendoteliálních struktur dochází k adhezi leukocytů a trombocytů na postižené místo, k aktivaci koagulačních faktorů a dalšímu poškozování endoteliálních buněk, což má za následek uvolňování jejich fragmentů (mikropartikulí) do cirkulace. Endoteliální mikropartikule (EMP) jsou drobné (≤ 1 μm) vezikuly, jejichž množství a struktura nám umožňuje posoudit míru a povahu endoteiálního poškození. Při vyšetření EMP průtokovou cytometrií s použitím celé řady monoklonálních protilátek je za fyziologických poměrů nalézáno 1177–1765 částic/μl.
Metaloproteinázy a inhibitory metaloproteináz
Metaloproteinázy (MMP) a jejich inhibitory (TIMP) představují skupinu proteolytických enzymů, které štěpí složky extracelulární matrix [6].
Při aktivaci MMP a TIMP jako následku aktivace endotelových buněk v důsledku jak fyziologických pochodů (růst a diferenciace tkání a orgánů), tak patologických procesů (zánět, ischémie, nádorová transformace apod.) dochází k modifikaci extracelulární subendoteliální matrix těmito enzymatickými systémy, poté k migraci endotelových buněk s následnou neovaskularizací či zánikem cév v dané oblasti.
MMP a TIMP tedy hrají důležitou roli v procesu remodelace cévní stěny, při tvorbě kolaterál v ischemizované tkáni, při procesu metastázování a neovaskularizace nádorů a v neposlední řadě v rámci implantace embrya do děložní sliznice a vývoji utero-placentární jednotky.
CÍL STUDIE
Cílem studie bylo určit laboratorní vyšetřovací postup k odhalení endoteliálního poškození během fyziologické gravidity stanovením některých markerů aktivace endotelu.
Na základě dostupné recentní literatury jsme naplánovali vyšetření tkáňového aktivátoru plazminogenu, inhibitoru aktivátoru plazminogenu 1, aktivity a antigenu von Willebrandova faktoru, trombomodulinu, endoteliálního receptoru aktivovaného proteinu C a endoteliálních mikropartikulí.
SOUBOR ŽEN A METODIKA
V období let 2007-2009 jsme vyšetřili na Porodnicko-gynekologické klinice FN a LF UP Olomouc, FN Ostrava a UPMD Praha celkem 403 těhotných žen s fyziologicky probíhající graviditou. Výběr těhotných a jejich zařazení do studie probíhalo formou náhodného výběru, všechny těhotné se zařazením do studie souhlasily a podepsaly informovaný souhlas. Studie byla schválena etickými komisemi všech tří institucí.
U skupiny zdravých těhotných bylo komplexně vyšetřeno poškození endotelu pomocí dostupných markerů. Ženám byla odebrána venózní krev standardním způsobem v období těhotenských odběrů na začátku gravidity (do konce I. trimestru). Druhý odběr byl proveden v období 24.–28. týdne. Získané krevní vzorky byly následně zpracovány v koagulační laboratoři Hemato--onkologické kliniky FN a LF UP Olomouc. V této laboratoři byly uvedené parametry vyšetřovány následujícími metodikami: t-PA – ELISA, PAI-1 – ELISA, vWF Ag – EIA (imunologické stanovení využívající imunoturbidimetrie), ePCR – ELISA, MMP-2,9 – ELISA s fluorogenní detekcí, TIMP-2 – ELISA, endoteliální mikropartikule – průtoková cytometrie. Vzhledem k náročnosti odběru a preanalytické fáze byly mikropartikule vyšetřeny pouze u pacientek sledovaných ve FN Olomouc. Pro vyšetření bylo použito vzorků venózní krve odebrané do 0,129 M citrátu sodného (Vacuette, Greiner). Pro samotné vyšetření pak byla použita bezdestičková plazma (PPP), která byla získána centrifugací při 3000 g po dobu 10 minut a uchována do doby vyšetření při -80 °C. Pro stanovení EMP bylo použito vzorku venózní krve odebraného do K3EDTA.
Tkáňový aktivátor plazminogenu
Hladiny t-PA byly stanoveny ELISA metodou. Stanovení je založeno na vazbě t-PA na specifickou polyklonální protilátku navázanou na pevné fázi.
Vlastní stanovení – vzorek 100 μl 5krát naředěné PPP byl inkubován 1 hodinu s polyklonální protilátkou za fyziologické teploty. Následně po vazbě t-PA přítomného ve vzorku byla funkční aktivita t-PA stanovena specifickým štěpením plazminogenu v přítomnosti substrátu plazminu. Množství antigenu bylo stanoveno po promytí použitím peroxidázově značené monoklonální protilátky.
Inhibitor aktivátoru plazminogenu 1
Hladiny PAI-1 byly stanoveny ELISA metodou. Stanovení je založeno na vazbě na specifickou polyklonální protilátku navázanou na pevné fázi.
Vlastní stanovení – vzorek 100 μl 5krát naředěné PPP byl inkubováno 1 hodinu s polyklonální protilátkou za fyziologické teploty. Následně po vazbě PAI-1 vázaného do komplexu s t-PA přítomným ve vzorku byla funkční aktivita PAI-1 stanovena pomocí peroxidázově značené monoklonální protilátky. Stanovení je specifické pro PAI-1 bez interference s PAI-2 (5 U/mL) a PAI-3 (5.5 μg/ml).
Von Willebrandův faktor
Hladina vWF antigenu byla stanovena enzymovou imunoanalýzou. Celkem 20 μl bezdestičkové plazmy bylo inkubováno s polyklonální protilátkou po dobu 5 minut za fyziologické teploty a v průběhu inkubace byla kontinuálně měřena absorbance při 620 nm. Naměřené hodnoty byly přepočteny pomocí kalibrační křivky získané stanovením různých koncentrací purifikovaného lidského vWF přidaného k vzorku plazmy získaného od pacientů s těžkou formou vW choroby typu I, kde jsou hladiny vWF pod 10 %.
Trombomodulin
Stanovení trombomodulinu jsme prováděli technikou mikro ELISA, kdy jsme na jamky potažené monoklonální protilátkou proti trombomodulinu napipetovali vzorek obsahující trombomodulin. Dojde k navázání molekul trombomodulinu na zakotvenou protilátku. Následně se přidá protilátka proti jinému vazebnému místu trombomodulinu značená peroxidázou. V konečné fázi se množství navázaného trombomodulinu stanovuje přidáním o-fenylendiaminu, který je v přítomnosti peroxidu rozkládán peroxidázou za vzniku žlutého zbarvení.
Endotelový receptor proteinu C
Stanovení EPCR jsme prováděli technikou mikro ELISA, kdy jsme na jamky potažené monoklonální protilátkou proti EPCR napipetovali vzorek obsahující EPCR. Dojde k navázání molekul EPCR na zakotvenou protilátku. Následně se přidá protilátka proti jinému vazebnému místu EPCR značená peroxidázou. V konečné fázi se množství navázaného EPCR stanovuje přidáním o-fenylendiaminu, který je v přítomnosti peroxidu rozkládán peroxidázou za vzniku žlutého zbarvení.
Endotelové mikropartikule
EMP byly kvantifikovány ve vzorcích podle práce Combese. Vzorky 40 μl plné krve byly inkubovány po dobu 30 min za laboratorní teploty s 10 μl PE-konjugované CD144. Vzorky byly následně ředěny s 1,0 ml PBS pufru a známým množstvím fluorescenčních latexových kuliček (Flowcount, Beckman Coulter Immunotech), které sloužily jako standard pro počet mikropartikulí při analýze průtokovou cytometrií. EMP byly měřeny na průtokovém cytometru Coulter Epics XL (Beckman Coulter, Switzerland, Nyon). Použití 0,8 μm latexových kuliček nám umožnilo MP definovat jako částice do 1 μm pozitivně značené PE-konjugovanou protilátkou CD144. Výsledky byly vyjádřeny jako počet MP v μl plné krve.
Metaloproteináza 2 a 9
Aktivita MMP-2 a MMP-9 ve vzorcích plazmy byla stanovena ELISA metodikou s použitím EDANS/ /DABCYL FRET peptidu (AnaSpec, USA, CA). Na základě štěpení FRET peptidu pomocí MMP na separátní fragmenty vznikly samostatné molekuly EDANS, které jsou fluorescenčně aktivní. Jejich aktivita byla stanovena excitací/emisí = 340 nm/490 nm na fluorimetru TECAN Genios.
Tkáňový inhibitor metaloproteinázy 2
Aktivita TIMP-2 ve vzorcích plazmy byla stanovena ELISA metodou (R&D Systems, USA). Metoda využívá protilátku proti rekombinantnímu lidskému TIMP-2 proteinu. Samotné stanovení využívá vazby TIMP-2 na monoklonální protilátku imobilizovanou na mikrotitrační destičce. Dojde k navázání molekul TIMP-2 na zakotvenou protilátku. Následně se přidá protilátka proti jinému vazebnému místu TIMP-2 značená peroxidázou. V konečné fázi se množství navázaného TIMP-2 stanovuje přidáním o-fenylendiaminu, který je v přítomnosti peroxidu rozkládán peroxidázou za vzniku žlutého zbarvení.
Statistické metody
Veškeré kalkulace byly provedeny za pomoci SPSS software (Statistical Package for the Social Sciences, SPSS Inc., Chicago, USA). Pro analýzy byly použity Kruskalův-Wallisův test, Studentův t-test, chi-squared test nebo Fisherův exact test.
VÝSLEDKY
V období let 2007–2009 byly analyzovány krevní vzorky celkem 403 těhotných. Rodičky zařazené do této skupiny měly negativní osobní a bezvýznamnou rodinnou anamnézu, 298 žen, tj. 74 %, byly primipary, 72 žen, tj. 18 %, byly secundipary, 33 žen, tj. 8,1 %, byly tercipary. Průměrný věk těhotných žen byl 27,6 let (±4,5 let). Průměrná hmotnost rodiček na začátku gravidity byla 62,6 kg (±8,8 kg). Průměrný váhový přírůstek činil 10,03 kg (±4,4 kg), průměrná výška rodiček byla 167 cm (±5,6 cm).
Z celkového počtu 403 žen se u 38 (9,4 %) vyvinul lehčí až středně těžký stupeň preeklampsie, u 8 rodiček (1,9 %) byl diagnostikován HELLP syndrom s různou tíží klinické manifestace. Celkem 28 rodiček (7 %) porodilo předčasně před ukončeným 37. týdnem gravidity. Pět těhotenství (1,2 %) bylo ukončeno z genetické indikace pro vrozenou vadu plodu. Kompletní protokol studie (odběry ve všech třech trimestrech) tedy absolvovalo 358 těhotných.
Laboratorní výsledky
Kompletní výsledky jsou uvedeny v tabulce 1 a grafech 1–10.
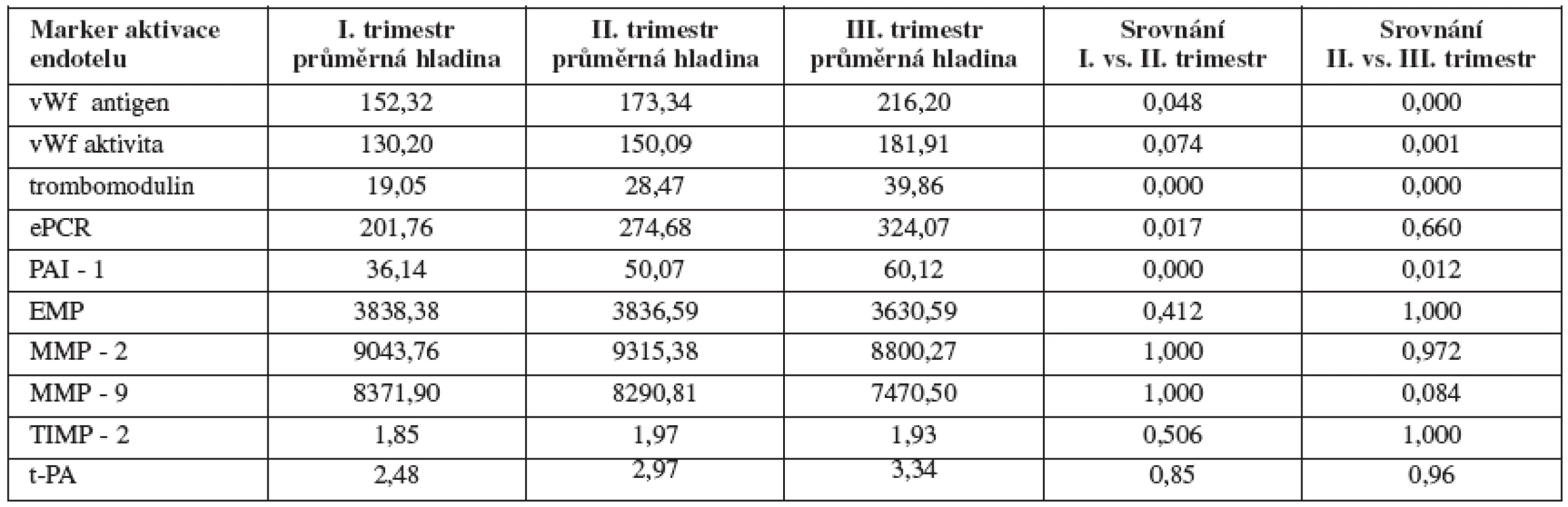







Hladina antigenu vWf stoupala během celého těhotenství (v I. trimestru průměrná hladina 152,32 %, ve II., resp. III. trimestru 173,34, resp. 216,20 %), v našem souboru jsme prokázali statisticky významný rozdíl hladin mezi II. a III. trimestrem, rozdíl mezi I. a II. trimestrem byl na hranici statistické významnosti. Současně stoupala aktivita vWf (v I. trimestru průměrná hladina 130,20 %, ve II., resp. III. trimestru 150,09, resp. 181,91 %), v našem souboru jsme prokázali statisticky významný rozdíl hladin mezi II. a III. trimestrem, rozdíl mezi I. a II. trimestrem nebyl statisticky významný. Hladina trombomodulinu významně stoupala během gravidity (v I. trimestru průměrná hladina 19,05 ng/ml, ve II. resp. III. trimestru 28,47 ng/ml, resp. 39,86 ng/ml), v našem souboru jsme prokázali statisticky významný rozdíl hladin mezi I. a II. i II. a III. trimestrem. Hladina solubilní formy EPCR stoupala během gravidity (v I. trimestru průměrná hladina 201,76 ng/ml, ve II., resp. III. trimestru 274,68, resp. 324,07 ng/ml), v našem souboru jsme prokázali statisticky významný rozdíl hladin mezi I. a II. trimestrem, rozdíl mezi II. a III. trimestrem nebyl statisticky významný. Hladina PAI-1 stoupala během celého těhotenství (v I. trimestru průměrná hladina 36,14 ng/ml, ve II., resp. III. trimestru 50,07, resp. 60,12 ng/ml), v našem souboru jsme prokázali statisticky významný rozdíl hladin mezi I. a II. i II. a III. trimestrem. Hladina t - PA se během gravidity významněji neměnila (v I. trimestru průměrná hladina 2,48 ng/ml, ve II., resp. III. trimestru 2,97, resp. 3,34 ng/ml). Neprokázali jsme statisticky signifikantní rozdíl v hladinách MMP-2 (v I. trimestru průměrná hladina 9043,76 RFU (fluorescenčních jednotek), ve II., resp. III. trimestru 9315,38 resp. 8800,27 RFU), MMP-9 (v I. trimestru průměrná hladina 8371,90 RFU, ve II., resp. III. trimestru 8290,81, resp. 7470,50 RFU), TIMP-2 (v I. trimestru průměrná hladina 92,5 ng/ml, ve II., resp. III. trimestru 98,5 resp. 96,5 ng/ml) ani endotelových mikropartikulí (v I. trimestru průměrná hladina 3838,38 částic/μl, ve II., resp. III. trimestru 3836,59, resp. 3630,59 částic/μl) v jednotlivých trimestrech.
DISKUSE
Osud těhotenství a stav plodu závisí rozhodující měrou na správné funkci uteroplacentární jednotky, která je ovlivněna hemostázou jak mateřské, tak fetální strany. Fyziologické těhotenství je spojeno se změnami ve všech složkách koagulace. Dochází k vzestupu většiny koagulačních faktorů, klesá koncentrace některých přirozených inhibitorů koagulace a významně je ovlivněna i aktivita fibrinolýzy. Tyto změny umožňují dostatečnou funkci fetoplacentární jednotky a správný vývoj plodu. Vychýlení v jakékoli složce tohoto složitého systému může způsobit jak krvácení, tak trombotické komplikace v placentární oblasti.
V těhotenství dochází vlivem hormonálních a hemodynamických změn také k významnému ovlivnění funkce endotelu. Mezi markery aktivace endotelu, k jejichž významným změnám dochází během gravidity, patří např. t-PA, PAI-1, vWF, EPCR, metaloproteinázy a jejich inhibitory, trombomodulin a endotelové mikropartikule s prokoagulační aktivitou.
Faktory prokoagulační
V těhotenství stoupají signifikantně hladiny koagulačních faktorů V, VII, VIII, IX, X, XII a vWf. Tyto změny jsou doprovázeny vzestupem hladiny fibrinogenu, který stoupá až na dvojnásobek oproti období mimo graviditu. V souladu s literárními údaji jsme i v našem souboru prokázali signifikantní nárůst aktivity i antigenu vWf [11].
Faktory antikoagulační
Systém přirozených inhibitorů koagulace hraje v udržení gravidity klíčovou roli. Solubilní forma trombomodulinu v plazmě může být využívána jako významný marker endoteliálního poškození. Hladina TM v průběhu gravidity stoupá signifikantně v jednotlivých trimestrech. Z její hladiny ve 12. týdnu nelze predikovat potenciální ohrožení těhotenství, avšak náhlé zvýšení hladiny by mohlo indikovat závažnou placentární komplikaci gravidity [10].
Kromě trombomodulinu patří do systému proteinu C dále protein S, jehož hladina v průběhu gravidity klesá, C4b vazebný protein a aktivovaný protein C (APC). Aktivita tohoto systému je zahájena ihned po navázání trombomodulinu na trombin, tato vazba je zprostředkována endoteliálním receptorem proteinu C, který je rovněž významným markerem aktivace endotelu. V souladu s literárními údaji [9] jsme prokázali vzestup hladiny EPCR během gravidity.
Fibrinolýza
Aktivita fibrinolytického systému je v průběhu těhotenství redukována, zůstává snížena během porodu, ale promptně se vrací k normě bezprostředně po porodu [11]. Hladina tkáňového aktivátoru plazminogenu se během gravidity v našem souboru neměnila, tento výsledek je v souladu s literárními údaji [12]. Hladiny t-PA nejsou ovlivněny pouze vzestupem hladiny PAI-1, který jsme prokázali se statistickou významností i v našem souboru, ale hlavně zvýšením hladiny PAI-2, pocházejícím z placentární tkáně. Hladina PAI-1 ve III. trimestru dosahuje několikanásobku výchozí hladiny na začátku těhotenství a vrací se k normálu bezprostředně po porodu [3].
Endotelové mikropartikule
Fyziologické těhotenství je charakterizováno zvýšením hladiny jak destičkových, tak endotelových mikropartikulí. Jejich role v etiopatogenezi porodnických komplikací zůstává nejasná [14]. Vanwijk et al. prokázali, že mikropartikule u žen s preeklampsií, avšak nikoli od zdravých těhotných žen, vyvolávají na izolovaných myometriálních arteriích poškození endotelu [15]. V našem souboru jsme ve shodě s literaturou prokázali nárůst endotelových mikropartikulí během těhotenství, i když bez statistické významnosti.
Systém metaloproteináz
Rovnováha mezi MMP a TIMP hraje důležitou roli při cévní remodelaci, angiogenezi a děložní a systémové vazodilataci během těhotenství. Porucha této rovnováhy souvisí s celou řadou závažných klinických stavů, v těhotenství pak zejména s hypertenzí a preeklampsií. V I. trimestru těhotenství byla popsána exprese MMP-2 převážně v extravilózním trofoblastu, zatímco MMP-9 hlavně ve vilózním cytotrofoblastu. Aktivita MMP-2 je pozorována až do termínu porodu, invazivita cytotrofoblastu je inhibována aktivitou TIMP-2 a protilátkami anti--MMP‑2. Vzestup v plazmatické hladině metaloproteináz byl také popsán v průběhu fyziologické gravidity a je dáván do souvislosti s cévními změnami, které probíhají zejména na začátku gravidity [16]. V naší studii jsme potvrdili konstantně zvýšenou hladinu MMP-2, MMP-9 i TIMP-2 bez signifikantní změny během celé gravidity.
ZÁVĚR
Těhotenství vede k fyziologickému vystupňování prokoagulačních procesů, které jsou nezbytné pro správný vývoj fetoplacentární jednotky i jako ochrana před peripartálním krvácením. Dochází ke vzestupu koagulačních faktorů, potlačení aktivity přirozených antikoagulancií, změnám fibrinolytické aktivity a také aktivaci endotelu a složitého systému metaloproteináz a jejich inhibitorů. V naší studii jsme se zaměřili na výzkum změn některých metapoproteináz a markerů aktivace endotelu. Potvrdili jsme hypotézu o výrazném vlivu gravidity na změny hladin těchto markerů. Do budoucna bude nutné další studium k určení klinického významu těchto změn a jejich prediktivního potenciálu k určení rizika vývoje závažných komplikací těhotenství, a tím možnosti jejich včasné terapie.
Práce je podpořena grantem Ministerstva zdravotnictví ČR IGA NR 9282-3/2007 a NS10319-3/2009.
MUDr. Jana Procházková
Hemato-onkologická klinika
FN a LF UP
I.P. Pavlova 6
775 20 Olomouc
e-mail: prochazkovajana@hotmail.com
Zdroje
1. Blann, AD. Assessment of endothelial dysfunction: focus on atherothrombotic disease. Pathophysiol Haemostasis Thrombosis 2005, 34.
2. De Caterina, R., Libby, P. Endothelial dysfunctions and vascular disease. Viley and sons: Blackwell Publishing, 2007, p. 3-25.
3. Hoffbrand, AV., Catovsky, D., Tuddenham, EGD. Postgraduate Hematology. Viley and sons: Blackwell Publishing, 2005, p. 787-792.
4. Kvasnička, J. Trombofilie a trombotické stavy v klinické praxi. Praha: Grada Publishing, 2003, s. 40-65.
5. Pecka, M. Laboratorní hematologie v přehledu. Fyziologie a patofyziologie hemostázy. 2004, s. 22-24, 87-97, 113-118.
6. Pilka, R., Hrachovec, P. Matrix metaloproteinázy a menstruace. Čes Gynek 2003, 68, s. 36-40.
7. Šimetka, O., Brychtová, P., Procházková, J., Procházka, M. Laboratorní změny aktivace endotelu u syndromu HELLP. Gynekolog 2008, 2, s. 48-53.
8. Holmes, VA., Wallace, JMW. Haemostasis in normal pregnancy: a balancing act? Biochemical Society Transactions 2005, 33, part 2, p. 428-432.
9. Brenner, B. Haemostatic changes in pregnancy. Thromb Res 2004, 114, p. 409-414.
10. Buffa, MC., Valsecchi, L., Fausto, A. Predictive value of plasma thrombomodulin in preeclampsia and gestational hypertension. Tromb Haemost 1998, 79, p. 1092-1095.
11. Stirling, Y., Woolf, L., North, WR., et al. Haemostasis in normal pregnancy. Thromb Haemost 1984, 52, p. 176-182.
12. Ishii, A., Yamada, R., Hamada, H. t-PA activity in peripheral blond obtained from pregnant women. J Perinat Med 1994, 22, p. 113-117.
13. Bremme, K., Ostlund, E., Almquist, I. Enhanced thrombin generation and fibrinolytic activity in the normal pregnancy and the puerperium. Obstet Gynecol 1992, 80, p. 132-137.
14. Bretelle, F., Sabatier, F., Desprez, D., et al. Circulating microparticles: a marker of procoagulant state in normal pregnancy complicated by preeclamsia or intrauterine growth restriction. Thromb Haemost 2003, 89, p. 486-492.
15. VanWijk, MJ., Svedas, E., Boer, K., et al. Isolated microparticles, but not whole plasma, from women with preeclampsia impair endothelium-dependent relaxation in isolated myometrial arteries from healthy pregnant women. Am J Obstet Gynecol 2002, 187, p. 1686-1693.
16. Raffaetto, JD., Khalil, RA. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol 2008, 75(2), p.346-59. Epub 2007 Jul 7. Review.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2010 Číslo 2
-
Všechny články tohoto čísla
- První zkušenosti s novou minipáskou k léčbě stresové inkontinence moči u žen – MiniArc
- Význam resektoskopie v diagnostice karcinomu endometria
- Doporučení pro hormonální substituční terapii v postmenopauze
- Současné možnosti diagnostiky vulvovaginálních infekcí
- Vztah stresové inkontinence moči či urgence k defektu předního kompartmentu před jeho operačním řešením a po něm
- Alogenní prolenové implantáty ve srovnání se sakrospinální fixací v léčbě prolapsu; randomizovaná multicentrická prospektivní srovnávací studie
- Změny délky implantované síťky po rekonstrukčním výkonu přední stěny poševní
- Zhodnotenie rutinného sledovania pacientok po primárnej liečbe pre karcinóm krčka maternice v I. a II. štádiu: retrospektívna analýza
- Antikoncepční chování českých žen: Výsledky národního výzkumu
- Moravská konference FETOMATERNÁLNÍ MEDICÍNY
- XXVII. konference Sekce perinatální medicíny ČGPS ČLS JEP
- K článku Běžný variabilní imunodeficit v těhotenství (soubor kazuistik)
- 20th World Congress on Ultrasound in Obstetrics and Gynecology
- Editorial
- Aquaporiny a regulace cirkulace plodové vody
- Peripartálne hysterektómie – audit na Slovensku v roku 2007
- Monitorování hladin markerů aktivace endotelu během fyziologické gravidity
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Současné možnosti diagnostiky vulvovaginálních infekcí
- Doporučení pro hormonální substituční terapii v postmenopauze
- Význam resektoskopie v diagnostice karcinomu endometria
- První zkušenosti s novou minipáskou k léčbě stresové inkontinence moči u žen – MiniArc



