Racionální předoperační diagnostika benigních a maligních ovariálních nádorů – zobrazovací metody, nádorové markery
The rational preoperative diagnosis of ovarian tumors – imaging techniques and tumor biomarkers (review)
The majority of patients who suffer from an early-stage or advanced-stage of ovarian cancer complain about symptoms, mainly gastrointestinal ones. The pelvic examination in ovarian cancer detection is limited by the adnexal position in the pelvis and frequent extraovarian spread of disease. Recently, any reliable tumor biomarker (CA 125 and/or HE4), which can be used in diffential diagnosis between benign and malignant ovarian tumors, does not exist. According the results of the largest multicenter International Ovarian Trial Analysis (IOTA), ultrasound if performed by an experienced sonologist is an ideal diagnostic method in diferential diagnosis between benign and malignant ovarian tumors. The experienced examiner is also able to detect extraovarian tumor spread and to assess tumor operability. Magnetic resonance imaging (MRI) is used only to complement ultrasound in cases when high tissue resolution is needed. Computed tomography (CT) is a useful method for detection of extraovarian spread, especially in cases when an ultrasound examiner experienced in abdominal scanning is not available. Similarly, fusion of positron emission tomography with CT (PET/CT) is a highly accurate method for the detection of abdominal and extraabdominal tumor spread, but its use is limited by cost and the low availability of this method. On the other hand, PET/CT is not recommended for primary ovarian cancer detection because of its lower sensitivity in comparison to ultrasound and its high false positive rates as well.
Key words:
ovarian cancer, ultrasound, RMI, CT, PET, IOTA, RMI, pelvic examination, symptom, CA 125.
Autoři:
D. Fischerová 1; Michal Zikán 1
; I. Pinkavová 1; S. Sláma 1; F. Frühauf 1; P. Freitag 1; P. Dundr 2; Andrea Burgetová 3
; D. Cibula 1
Působiště autorů:
Onkogynekologické centrum, Gynekologicko-porodnická klinika Všeobecné fakultní nemocnice a 1. lékařské fakulty Univerzity Karlovy, Praha, přednosta prof. MUDr. A. Martan, DrSc.
1; Ústav patologie Všeobecné fakultní nemocnice a 1. lékařské fakulty Univerzity Karlovy, Praha, prof. MUDr. C. Povýšil, DrSc.
2; Radiodiagnostická klinika Všeobecné fakultní nemocnice a 1. lékařské fakulty Univerzity Karlovy, Praha, přednosta prof. MUDr. J. Daneš, CSc.
3
Vyšlo v časopise:
Ceska Gynekol 2012; 77(4): 272-287
Souhrn
Většina pacientek s časným i pokročilým stadiem maligního ovariálního nádoru udává symptomy onemocnění, přičemž mezi nejčastějšími jsou zastoupeny gastrointestinální obtíže. Fyzikální vyšetření v diagnostice ovariálních nádorů je limitováno, vzhledem k uložení adnex a časté extraovariální manifestaci onemocnění. Podle současných dat neexistuje žádný vhodný nádorový marker (CA 125 a/nebo HE4) pro diferenciální diagnostiku benigních a maligních ovariálních nádorů a jejich odběr v této indikaci není opodstatněný. Podle výsledků největší mezinárodní studie (International Ovarian Trial Analysis) je ultrazvukové vyšetření zkušeným sonografistou ideální diagnostickou metodou v diferenciální diagnostice benigních a maligních ovariálních nádorů. V případě zkušeného sonografisty umožní ultrazvukové vyšetření současně i stanovení stadia a operability onemocnění. Magnetická rezonance s kontrastní látkou je využívána pouze komplementárně, a to v případě nutnosti lepšího tkáňového rozlišení. Počítačová tomografie se většinou používá ke zhodnocení rozsahu pokročilého nádorového onemocnění, zvláště pokud není na pracovišti dostatečná erudice v abdominálním ultrazvukovém vyšetření. Kombinace počítačové tomografie s pozitronovou emisní tomografií (PET/CT) je nejpřesnější metodou ve stanovení vzdálených metastáz, její využití je však omezeno dostupností metody. Využití PET/CT v diferenciální diagnostice benigních a maligních ovariálních nádorů je limitováno vyšším počtem falešně negativních a falešně pozitivních nálezů ve srovnání s ultrazvukovým vyšetřením.
Klíčová slova:
ovariální karcinom, ultrazvuk, magnetická rezonance, počítačová tomografie, pozitronová emisní tomografie, IOTA, RMI, fyzikální vyšetření, symptom, CA 125.
ÚVOD
V roce 2008 dosáhla incidence maligního ovariálního nádoru v České republice 21,8/100 000 žen (celkem 1164 žen s nově zjištěným maligním nádorem ovaria) a úmrtnost na tento nádor činila 13,6/100 000 žen (celkem 724 žen zemřelo na následky tohoto zhoubného onemocnění) (graf 1). Vysoká mortalita odráží pozdní diagnostiku tohoto onemocnění až v jeho pokročilých stadiích. Bohužel se zatím nepodařilo zajistit efektivní screeningový program, který by zlepšil záchyt časných stadií tohoto onemocnění a vedl ke zlepšení morbidity a mortality postižených pacientek [8]. Prognóza pacientek s maligním nádorem ovaria je ovšem závislá nejen na detekci časného stadia onemocnění, ale také na včasném odhalení pokročilého onemocnění, jelikož dosažení nulového pooperačního nádorového rezidua u pokročilých onemocnění zvyšuje dvojnásobně šanci na vyléčení pacientky. Možnost vyléčení pacientek s pokročilým karcinomem operovaných bez nádorového rezidua je 30–40 % ve srovnání s možností vyléčení u pacientek s ponechaným reziduálním nádorem, kdy dosahuje 15–20 % [7].
Vzhledem k absenci účinného screeningu je včasné odhalení ovariální malignity založeno na symptomech pacientky, fyzikálním vyšetření, zobrazovacích metodách a nádorových markerech. O přínosu těchto klinických informací a uvedených vyšetření v diagnostice maligního ovariálního nádoru budeme podrobně diskutovat.

SUBJEKTIVNÍ SYMPTOMY PACIENTKY
Ovariální karcinom byl dlouho nazýván „tichým zabijákem“, protože se předpokládalo, že jeho uložení v břišní dutině vede k rozvoji symptomů až v pokročilém, většinou nevyléčitelném stadiu onemocnění. Ve studiích, které porovnávaly symptomy pacientek s ovariálním karcinomem s klinickou skupinou bez onemocnění, bylo ve skupině s ovariálním karcinomem zaznamenáno signifikantně více následujících obtíží: pánevní/abdominální bolest (p<0,001), nárůst objemu břicha/nadýmání (p<0,001), obtíže s přijímáním potravy/časný pocit plnosti (p=0,01) [22, 23]. Ve srovnání se zdravými pacientkami byly tyto symptomy u pacientek s ovariální malignitou nejen častější (20–30krát vs. 2–3krát za měsíc), ale také intenzivnější a kratšího trvání (<1 rok). Index symptomů byl hodnocen jako pozitivní, pokud byl zastoupen alespoň jeden z výše uvedených 6 symptomů, a to v trvání méně než 1 rok a při frekvenci více než 12 dní v měsíci (tab. 1). Přesnost indexu symptomů v diagnostice ovariálního maligního nádoru je uvedena v tabulce 2 a přibližně odpovídá diagnostické přesnosti předoperačního stanovení nádorového markeru CA125. Ze stejného pracoviště vyšla další práce, která kombinovala index symptomů s předoperačním stanovením hodnoty CA125. Senzitivita záchytu ovariálního karcinomu se významně zvýšila při kombinaci indexu symptomů a odběru CA125, kdy bylo správně diagnostikováno více než 80 % časných ovariálních karcinomů (tab. 2) [2]. Naopak pokles specificity vyšetření, který by vedl ke zbytečnému chirurgickému výkonu u mnoha zdravých pacientek, byl v uvedené studii řešen doplněním předoperačního transvaginálního ultrazvukového vyšetření, které správně identifikovalo tyto falešně pozitivní pacientky. Na základě uvedených dat se zdá být mnohem racionálnější postup kombinovat symptomy pacientky přímo s ultrazvukovým vyšetřením, současný odběr CA125 je již nadbytečným vyšetřením.
Pro klinickou praxi je důležité věnovat pozornost výše uvedeným relativně specifickým symptomům pacientky, mezi kterými převažují zvláště gastrointestinální obtíže. Tyto symptomy bývají přítomny již v časném stadiu onemocnění a měly by být alarmujícím markerem možné přítomnosti ovariálního maligního nádoru. U těchto pacientek by nemělo být opominuto gynekologické komplexní vyšetření (palpační a ultrazvukové vyšetření), tak aby gastroenterologická či jiná vyšetření nevedla ke zbytečnému prodlení ve stanovení správné diagnózy. Stanovení nádorového markeru CA125 ve vyšetřujícím algoritmu symptomatické pacientky není opodstatněné.

FYZIKÁLNÍ VYŠETŘENÍ
Významu fyzikálního vyšetření v detekci adnexální léze je věnováno málo studií, a téměř žádná data nejsou dostupná o významu fyzikálního vyšetření v diferenciální diagnostice benigních a maligních ovariálních nádorů. V přehledovém článku 5 studií (Agency for Healthcare Research and Quality, 2004), které se zaměřily na zhodnocení přínosu gynekologického fyzikálního vyšetření v detekci adnexálního tumoru, byla stanovena senzitivita a specificita palpačního vyšetření 45 % a 90 % [21]. V jiné studii, zaměřené na přesnost fyzikálního vyšetření ve stanovení pánevní patologie (adnexální léze, velikost a uložení dělohy), byla nejvyšší přesnost zaznamenána při vyšetření gynekologem specialistou (70,2 %) a postupně se snižovala, pokud vyšetření provedl lékař bez atestace (64 %) a/nebo student medicíny (57,3 %) [35]. Významné zhoršení detekce adnexální léze bylo podmíněno obezitou pacientky a také její relaxací (vyšetření bez/v celkové anestezii).
Fyzikálním vyšetřením není možné odlišit ovariální benigní a časné maligní „opouzdřené“ nádory [75]. Navíc se ovariální karcinomy v době prvního záchytu manifestují ve více než 70 % extraovariálním rozsevem, jehož přesný rozsah také není možné určit fyzikálním vyšetřením (obr. 1). Formou abstraktu byly publikovány výsledky Evropské multicentrické studie, která probíhala v letech 2004 až 2008 a bylo v ní zahrnuto143 žen (113 s maligním a 39 s benigním ovariálním nádorem) [26]. V rámci studie byl hodnocen přínos fyzikálního vyšetření (viz tab. 1), stanovení indexu symptomů a ultrazvukového dopplerovského vyšetření v diagnostice ovariálního karcinomu, přičemž senzitivita a specificita fyzikálního vyšetření pro detekci zhoubného nádoru ovarií byla nejnižší z těchto tří uvedených diagnostických metod (tab. 2).
Přínos gynekologického palpačního vyšetření v záchytu adnexální patologie je limitováno uložením adnex, zkušeností vyšetřujícího lékaře, obezitou pacientky (BMI) a její relaxací. V případě podezření na přítomnost maligní léze je součástí gynekologického vyšetření nejen vyšetření v gynekologických zrcadlech kombinované s bimanuálním vyšetřením, ale také celkové fyzikální vyšetření (zhodnocení stavu pacientky a vitálních funkcí, hmatných lymfatických uzlin, vyloučení pleurálního výpotku nebo ascitu a další).
ZOBRAZOVACÍ METODY
1. Ultrazvukové vyšetření
V současné době je ultrazvukové vyšetření metodou volby v diagnostice pánevních nádorů. Jeho cílem je určit původ nádoru (ovariální vs. extraovariální), odlišit benigní a maligní ovariální nádor, stanovit specifickou diagnózu nádoru benigního či maligního nádoru (např. teratom vs. cystadenom vs. endometriom; borderline ovariální nádor vs. primární ovariální karcinom nebo metastatický ovariální nádor apod.) a rozsah onemocnění v pánvi a břišní dutině [16].
Ultrazvukové vyšetření vyžaduje přístrojovou kvalitu i zkušenost vyšetřujícího, proto je nutné odlišit tzv. základní ultrazvukové vyšetření provedené ošetřujícím gynekologem s cílem diferencovat normální a abnormální pánevní nález a tzv. expertní ultrazvukové vyšetření, které upřesní specifickou diagnózu léze a rozsah onemocnění [9]. Benigní nález buď nevyžaduje chirurgické řešení, nebo vyžaduje pouze minimálně invazivní chirurgický výkon (laparoskopii), zatímco maligní nález je řešen v onkogynekologickém centru, které garantuje nejvyšší léčebnou kvalitu [12].
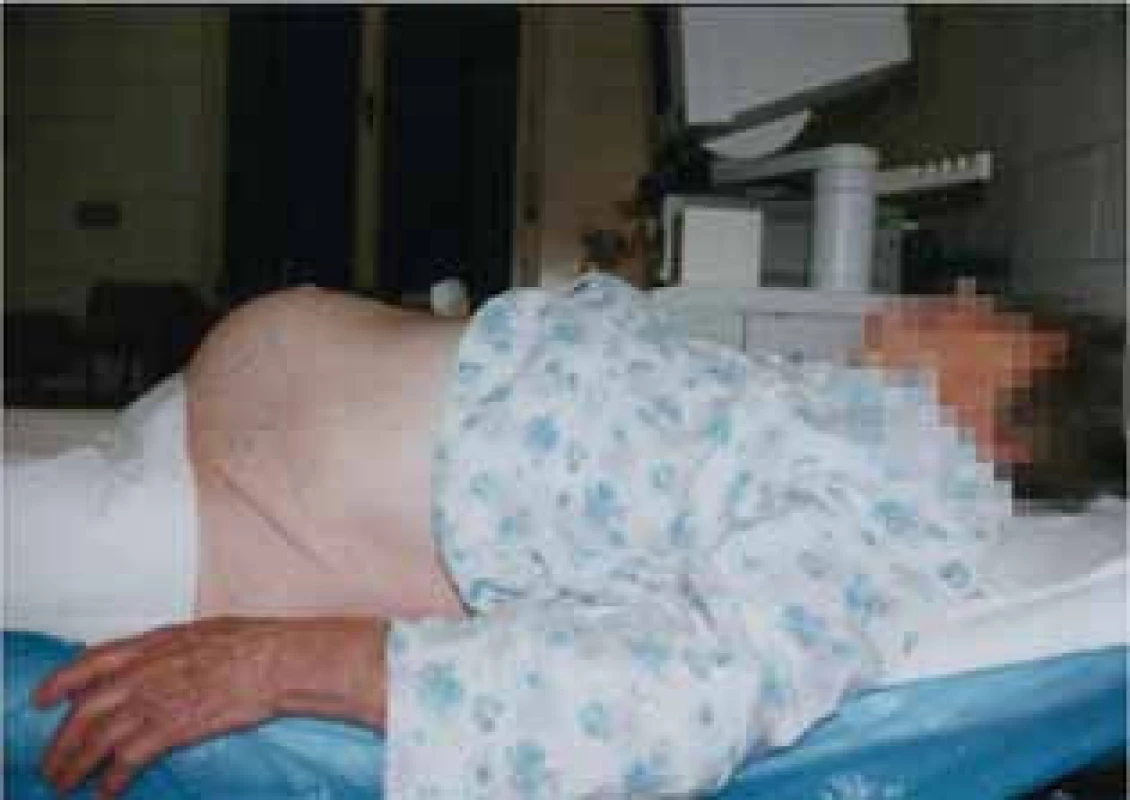
Transvaginální zavedení sondy umožňuje detailní zobrazení původu a typu pánevního nádoru na základě jeho sonomorfologických a dopplerovských cévních charakteristik. V případě patologického nálezu je vždy zároveň doplněno transabdominální sonografické vyšetření. Mezi ultrazvukové známky malignity patří nález perfundovaných nerovných („květákovitých“) papilárních prominencí a solidní složky uvnitř či již na povrchu ovariálního nádoru (obr. 2). V rámci zlepšení diferenciální diagnostiky benigních a maligních ovariálních nádorů se nepotvrdil přínos trojrozměrného ultrazvuku (3D) [1] či kontrastních látek, které slouží k detailnější vizualizaci cévní nádorové perfuze [42, 43].
V současné době je nejspolehlivějším zdrojem ultrazvukových dat o adnexálních lézích mezinárodní ultrazvuková studie ovariálních nádorů (International Ovarian Trial Analysis, IOTA), jejíž součástí je i Onkogynekologické centrum Gynekologicko-porodnické kliniky 1. LF UK a VFN v Praze. Tato studie umožňuje jednotné zpracování statistických dat prospektivně získaných z 21 evropských center a od roku 1999 do 2007 již zahrnula celkem 3511 pacientek s adnexálními nádory (IOTA fáze 1, 2, 3). Studie IOTA je jedinečná nejen počtem pacientek s adnexálními lézemi, mezinárodním designem, striktním protokolem (přesná ultrazvuková terminologie, ověření expertizy sonografistů participujících ve studii, jednotný počítačový program neumožňující změnu demografických, klinických a ultrazvukových parametrů po jejich zadání, histologická zpráva z operace, která musí proběhnout do 120 dnů od ultrazvukového vyšetření a další), ale také počtem hodnoceným proměnných (více než 50 proměnných) umožňujících tvorbu různých skórovacích a matematických modelů (logistické regresní modely, umělá neuronová síť [arteficial neural networks], least squares support vector machines [LS/SVM], relevance vector machines [RVM]) [68]. Navíc jako jediná studie hodnotí 5 stupňů tzv. diagnostické jistoty či spolehlivosti (diagnostic confidence) sonografisty během vyšetření ovariální léze (léze je jistě benigní, možná benigní, obtížně klasifikovatelná, možná maligní, jistě maligní), jelikož není pochyb, že pro klinickou praxi je míra diagnostické spolehlivosti podstatná.
Ultrazvukové hodnocení typu ovariální léze (benigní vs. maligní) je možné buď subjektivně, nebo s využitím skórovacích systémů a matematických modelů obsahujících ultrazvuková a klinická data.
Subjektivní zhodnocení ovariálního nádoru zkušeným sonografistou (subjective assessment, pattern recognition) je v současné době nejpřesnější předoperační metodou v diferenciální diagnostice benigních a maligních nádorů ovarií (přesnost 89–96 %) [45, 55, 56]. Kvalita ultrazvukového vyšetření je odrazem zkušenosti vyšetřujícího, který během ultrazvukového vyšetření stanoví diagnózu na základě demografických a klinických dat v kombinaci s přítomnými ultrazvukovými charakteristikami nádoru [66]. Zkušenost sonografisty se zvláště odvíjí od počtu a zastoupení vyšetřených nádorů (prevalence benigních a maligních nálezů), zpětné kontroly ultrazvukových nálezů a teoretických znalostí sonografisty. Podle výsledků největší mezinárodní studie ovariálních nádorů (International Ovarian Trial Analysis, IOTA) umožnilo ultrazvukové vyšetření zkušeným sonografistou odlišit benigní a maligní ovariální nádory se senzitivitou 90 % (853/951) a specificitou 94 % (2394//2560) a poměrem pravděpodobnosti pro pozitivní a negativní výsledek testu (likelihood ratio, LR) LR+:15 a LR-: 0,11 [57]. Výsledek LR svědčí o tom, že ultrazvuk je prakticky ideální diagnostická metoda, což je taková metoda, která má zároveň LR+ >10 a LR - <0,1 [30]. Tato přesnost je však garantována pouze v případech, že jde o ultrazvukové vyšetření v reálném čase provedené samotným expertem [65]. V případě hodnocení statických ultrazvukových snímků nelze takové přesnosti dosáhnout, a to ani v případě, že statické snímky hodnotí ultrazvukový expert [65]. Subjektivní hodnocení nálezů (benigní vs. maligní nádor) méně zkušeným sonografistou je nejen méně přesné, ale je také spojeno se signifikantně vyšší diagnostickou nejistotou a neumožňuje stanovení specifické diagnózy nádoru [67].
Na základě prezentovaných dat je zřejmé, že přesnost ultrazvuku v diferenciální diagnostice benigních a maligních ovariálních nádorů je ovlivněna zkušeností sonografisty, který stanoví správnou diagnózu u 90 % nádorů [57]. Druhou limitací ultrazvukové diagnostiky je však typ nádorů. Přibližně v 7–10 % případů jde o tzv. obtížně interpretovatelné nádory, jejichž makroskopické známky se navzájem překrývají a není možné je spolehlivě klasifikovat jako benigní či maligní ovariální léze na základě subjektivního ultrazvukového hodnocení (obr. 3) [57, 59]. Využití logistického regresního modelu s event. implementací CA125 či stanovení indexu rizika malignity (RMI) nevedl ke zlepšení predikce benigních vs. maligních nádorů v případech obtížně klasifikovatelných nádorů [59]. V současné době se hledá tzv. second stage test (proteomika, biomarkery, 3D-ultrazvuk, kontrastní látky, jiné zobrazovací metody aj.), který by pomohl upřesnit, o jaký typ nádorů se v těchto případech spolehlivě jedná.
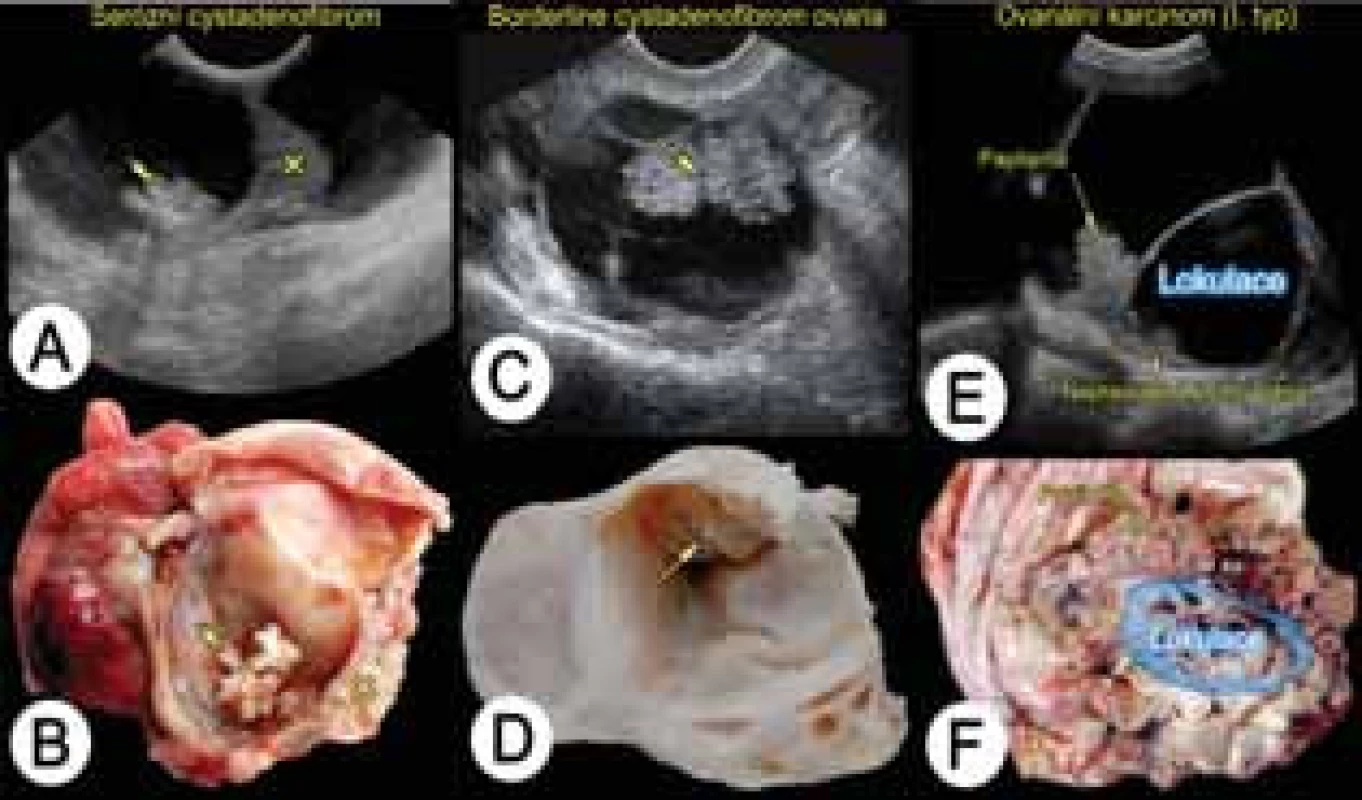
Vzhledem k přímé závislosti přesnosti ultrazvukového vyšetření na erudici vyšetřujícího sonografisty [45, 67, 73], bylo během posledních desetiletí vytvořeno mnoho skórovacích systémů či matematických modelů, jejichž cílem je objektivně stanovit přítomnost benigního či maligního ovariálního nádoru [20]. Tyto modely obsahují různé demografické, klinické a ultrazvukové proměnné (věk a menopauzální stav pacientky, údaje o současné hormonální léčbě, rodinnou a osobní anamnézu ovariálního karcinomu, údaje o bolesti během ultrazvukového vyšetření, hladinu markeru CA125 a jednoduché sonografické parametry, které jsou snadno detekovatelné i méně erudovanými sonografisty). Tyto modely byly vytvořeny retrospektivně, a bohužel se v rámci dalších ověřovacích studií u většiny těchto modelů nepotvrdila jejich původně referovaná spolehlivost a přesnost. Pro zapojení takových modelů do klinické praxe je nezbytné prospektivní ověření jejich spolehlivosti na nové databázi v jiném centru, než byl model vytvořen (external validation). Tento postup zaručí univerzální platnost modelu. Důvodem, proč tyto modely nefungovaly v externím testování, může být původně malá databáze a rozdílná populace pacientek (prevalence malignity), ve které byl model vytvořen; dále menší počet proměnných; využití proměnných, které neumožní jejich objektivní hodnocení a jednotnou interpretaci; absence univerzální ultrazvukové terminologie aj. Mezi modely, které se při externím testování ukázaly jako spolehlivé a vhodné pro klinickou praxi – pro předoperační stanovení typu ovariálního nádoru, patří dnes nejpoužívanější klinický model tzv. index stanovení rizika malignity (risk of malignancy index, RMI) vytvořený Jacobsem a kol. [29], dále velmi slibnými modely jsou tzv. jednoduchá ultrazvuková pravidla vytvořená skupinou IOTA (International Ovarian Trial Analysis) [50] a dva matematické modely (logistické regresní modely LR1 a LR2) určené ke stanovení individuálního rizika malignity také vytvořené mezinárodní skupinou IOTA [51].
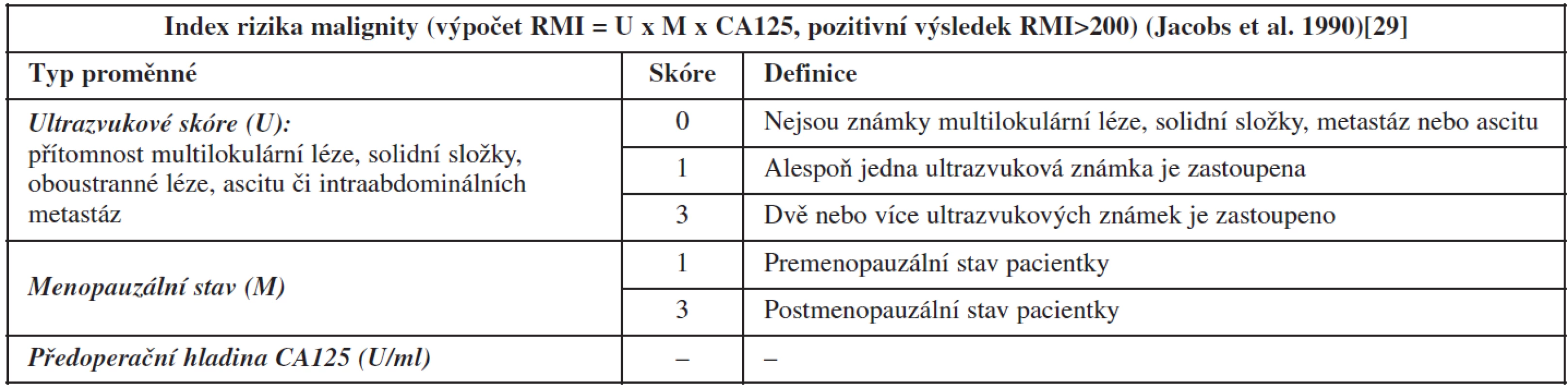
Index rizika stanovení malignity (RMI) je snadno vypočítán na základě algoritmu, který zahrnuje pět ultrazvukových proměnných (přítomnost multilokulární léze, solidní složky, oboustranné léze, ascitu či intraabdominálních metastáz), menopauzální stav pacientky a hladinu CA125 (tab. 3). Pozitivní hodnota RMI >200 je využívána v diferenciální diagnostice benigních a maligních ovariálních nádorů a slouží k objektivní stratifikaci pacientek k adekvátní péči podle vypočítaného rizika malignity (nízké vs. vysoké riziko). Stanovení a využití RMI je však limitováno nutností intravenózního odběru CA125, nejednotnou interpretací ultrazvukových proměnných mezi vyšetřujícími sonografisty a celkově vyšším počtem falešně negativních výsledků, zvláště u časných stadií ovariálního karcinomu. Nižší senzitivita metody (78 %) [20] vede k podcenění nálezu u více než 20 % pacientek a jejich odeslání k neadekvátnímu výkonu (nejčastěji laparoskopii s rizikem rozsevu nádoru) se zhoršením přežití pacientek [12, 69]. Index rizika malignity má dále omezenou aplikaci u premenopauzálních žen (častá falešná pozitivita CA125 ve fertilním věku) a u nádorů, které nelze jednoduše ultrazvukově charakterizovat. Původně referovaná vysoká přesnost indexu rizika malignity Jacobsem a kol. (RMI 1: senzitivita 85 % a specificita 97 %) stanovená na 101 případech benigních a 42 maligních nádorů již nebyla doložena v externích ověřovacích studiích (Davies 1993, Morgante 1999, Mol 2001, Bailey 2006 aj.) a velkých metaanalýzách (viz tab. 2) [20, 47]. Další úpravy RMI – tzv. RMI 2, 3, 4 (změna skórování, přidání proměnných do modelu), podobně jako snaha o využití jiné hladiny (cut-off) pro pozitivitu testu se neukázaly jako efektivní [52, 53, 72].
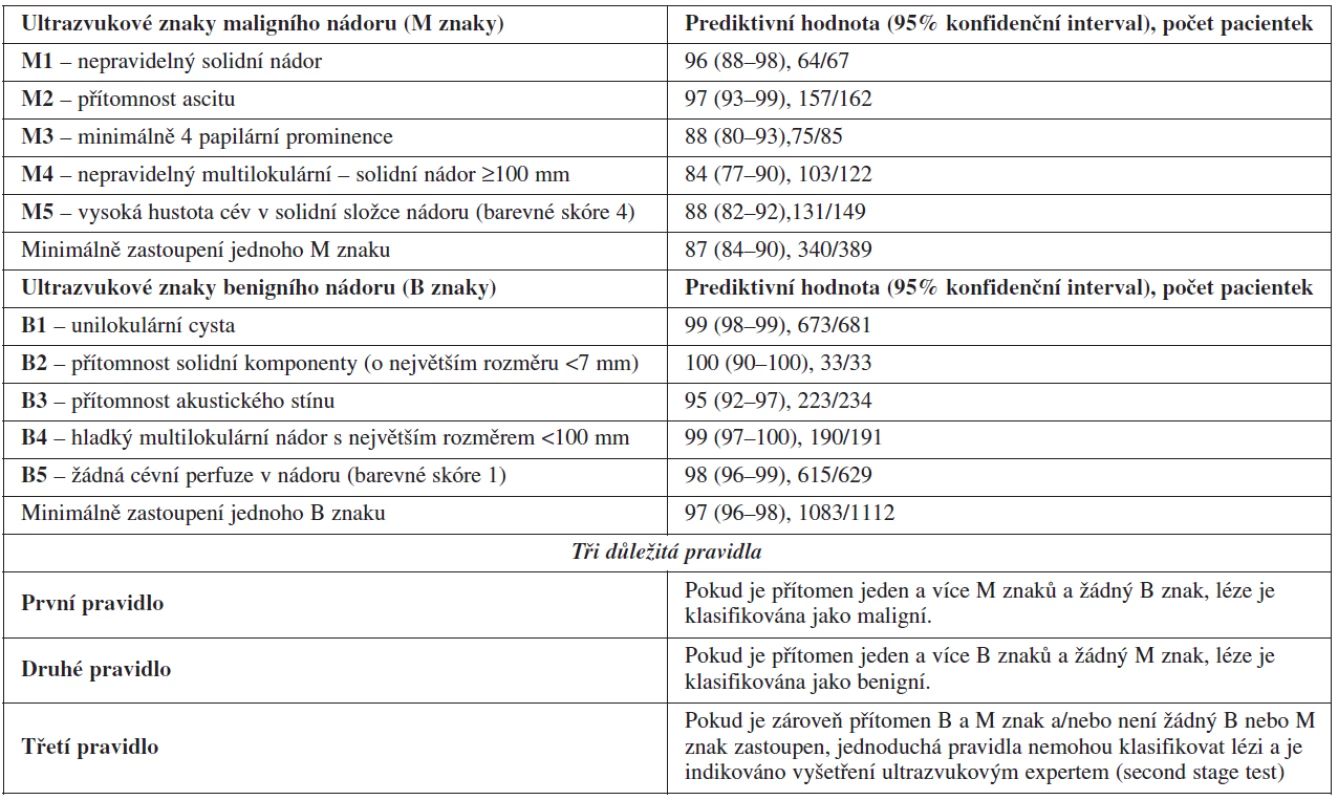
Mezinárodní ultrazvuková skupina IOTA (International Ovarian Trial Analysis) vytvořila a prospektivně ověřila tzv. jednoduchá ultrazvuková pravidla diferenciální diagnostiky benigních a maligních ovariálních nádorů (simple ultrasound based rules), kdy bylo vybráno pět nejčastějších ultrazvukových proměnných asociovaných s přítomností maligního nálezu (tzv. M znaky – mají nejvyšší pozitivní prediktivní hodnotu pro přítomnost maligní léze) a pět nejčastějších ultrazvukových proměnných asociovaných s přítomností benigního nálezu (tzv. B znaky – mají nejnižší pozitivní prediktivní hodnotu pro přítomnost maligní léze) (tab. 4) [49]. Nezbytnou podmínkou je osvojení standardní ultrazvukové terminologie pro popis ovariálních lézí, aby byly B a M znaky jednotně interpretovány (tab. 5) [46]. Pokud je zastoupen alespoň jeden maligní znak a žádný benigní znak, je léze klasifikována jako maligní (1. pravidlo). Naopak, pokud je zastoupen alespoň jeden B znak a žádný maligní znak, je ovariální léze klasifikována jako benigní (2. pravidlo). Pokud jsou zároveň detekovány jak benigní, tak maligní znaky, nebo pokud není ani jeden znak zastoupen, nelze tato pravidla použít a je indikován tzv. druhý krok (second stage test) – odeslání pacientky k expertnímu ultrazvukovému vyšetření. Využití jiných testů v tzv. druhém kroku (matematické modely - LR1, LR2 nebo stanovení indexu rizika malignity – RMI) se ve srovnání s expertním ultrazvukových vyšetřením ukázalo jako méně přesné. Tato pravidla jsou aplikovatelná přibližně u 76 % vyšetřovaných pacientek a pouze 24 % je odesláno ke zhodnocení nálezu expertním sonografistou (second stage test). Tento dvoustupňový algoritmus dosahuje přesnosti subjektivního hodnocení expertem, to je senzitivity a speficity nad 90 % (tab. 2) a je velmi snadno použitelný pro klinickou praxi [50]. Tato pravidla neztratila svoji přesnost ani při prospektivním externím testování v centrech s expertní ultrazvukovou erudicí [50] a nyní se objevují již první práce, které spolehlivost těchto jednoduchých ultrazvukových pravidel potvrzují i v rukou méně zkušených sonografistů. Vzhledem k tomu, že jednoduchá pravidla jsou přesnější metodou v diagnostice maligního ovariálního nádoru, než je stanovení indexu rizika malignity (RMI), který dosud doporučovala RCOG (the Royal College of Obstetricians and Gynaecologist), bylo iniciováno nové doporučení této společnosti. V tomto doporučení publikovaném v listopadu 2011 (Green-top Guideline No. 22, Managament of Suspected Ovarian Masses in Premenopausal Women) je využití jednoduchých ultrazvukových pravidel uvedeno jako současná metoda volby k odlišení benigního a maligního ovariálního nádoru, zvláště u premenopauzálních žen, kdy má stanovení indexu rizika malignity (RMI) své již zmíněné limitace.

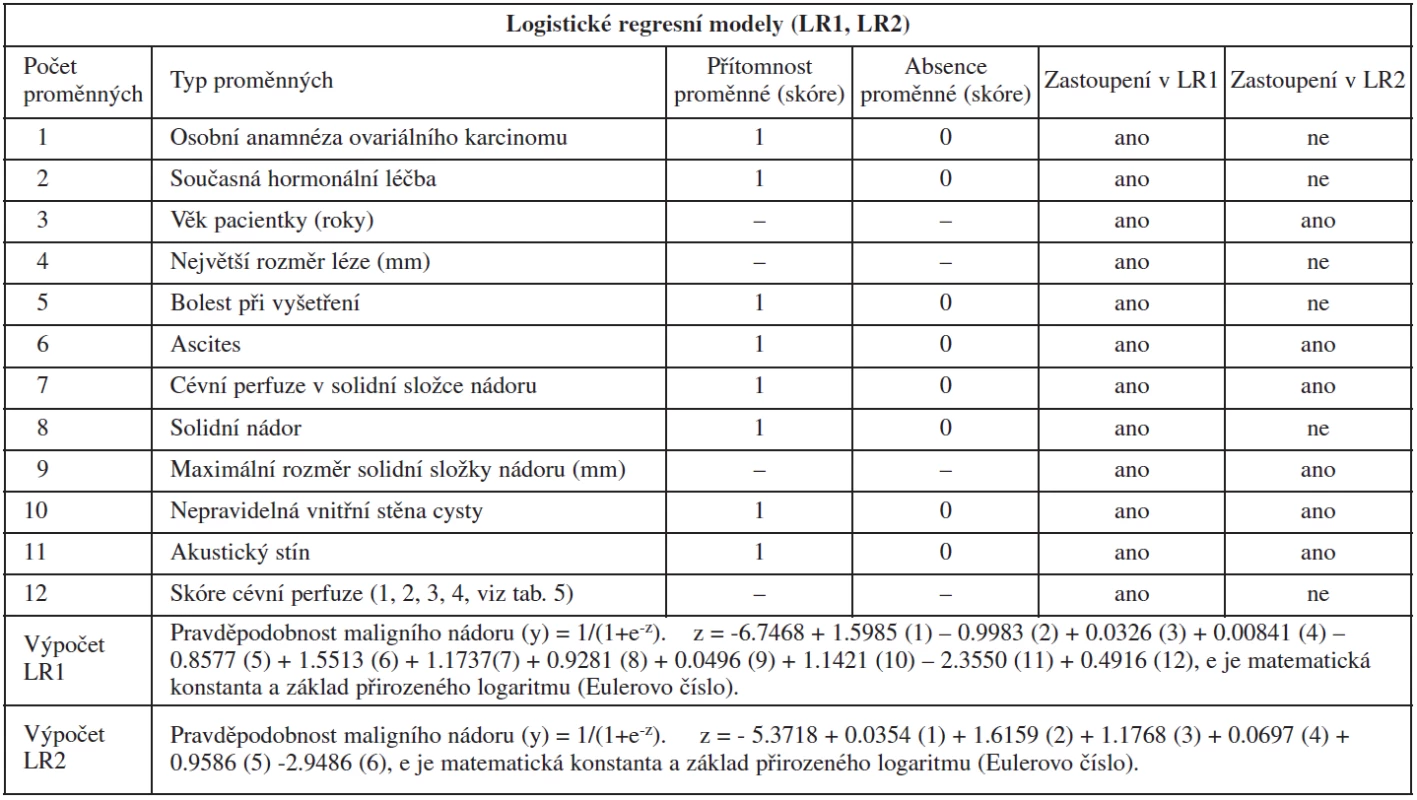
Hlavním cílem mezinárodní multicentrické skupiny IOTA bylo kromě vytvoření jednoduchých ultrazvukových pravidel vytvoření a ověření matematických modelů k výpočtu individuálního rizika malignity na základě dosazení klinických a ultrazvukových proměnných do modelů. Osvědčily se zejména dva matematické modely (logistický regresní model LR1 a LR2), které poprvé v historii dosáhly přesnosti subjektivního hodnocení nádoru ultrazvukovým expertem (maligní vs. benigní ovariální nádor), a to i v prospektivním testování na 1501 pacientkách. Oba modely se navzájem liší počtem zadávaných klinických a ultrazvukových proměnných, kdy v LR1 modelu je 12 proměnných, zatímco v LR2 modelu pouze 6 proměnných (tab. 6). LR1 nejlépe identifikoval časné ovariální karcinomy ve srovnání s LR2, subjektivním hodnocením nádoru a RMI. Falešná negativita u stadia I ovariálního karcinomu a u borderline nádorů byla v LR1 3 % (1/38) a 17 % (7/42), v LR2 5 % (2/38) a 21 % (9/42, při subjektivním hodnocení 8 % (3/38) a 21 % (9/42) a podle RMI 42 % (16/38) a 73 % (31/42) [68]. Tyto modely jsou vhodné pro méně zkušené sonografisty, kteří preferují popis ultrazvukových proměnných před stanovením specifické diagnózy. Nezbytnou podmínkou pro využívání testu je opět dokonalá znalost ultrazvukové terminologie (tab. 5), jelikož spolehlivost modelů může být garantována, pouze pokud jsou sonografistou správně interpretovány ultrazvukové parametry adnexální léze [66]. Matematické vzorce logistických regresních modelů jsou volně přístupné, mohou být instalovány na vlastním počítači nebo ultrazvukovém přístroji, přičemž nádor je hodnocen jako maligní, pokud výpočet stanoví individuální riziko malignity 10 a více procent (tab. 6) [47, 51].
Úkolem ultrazvukového vyšetření je nejen správně odlišit přítomnost benigního a maligního ovariální nádoru, ale v případě ultrazvukových charakteristik zhoubného nádoru stanovit během stejného vyšetření i klinický staging onemocnění – definitivní rozsah nádorového postižení v břišní dutině (postižení peritonea vč. omenta, parenchymatózních orgánů a spádových lymfatických uzlin) [16]. Na základě ultrazvukového zhodnocení celkového rozsahu nádorového postižení je zároveň možné posoudit i operabilitu onemocnění [44]. V případě jednoznačných známek inoperability nádoru není vhodné zatížit pacienku probatorní laparotomií s možností biopsie nádoru, ale odběr vzorku nádoru je proveden minimálně invazivním přístupem, tj. cílenou biopsií nádoru pod ultrazvukovou kontrolou [13, 76]. Biopsie nádoru silnou jehlou umožní získání reprezentativního histologického vzorku nádoru s přesností 97,7 % (95% CI 91,85–99,72 %) a je nezbytným krokem před zahájením léčby neoadjuvantní chemoterapií [13].
2. Magnetická rezonance
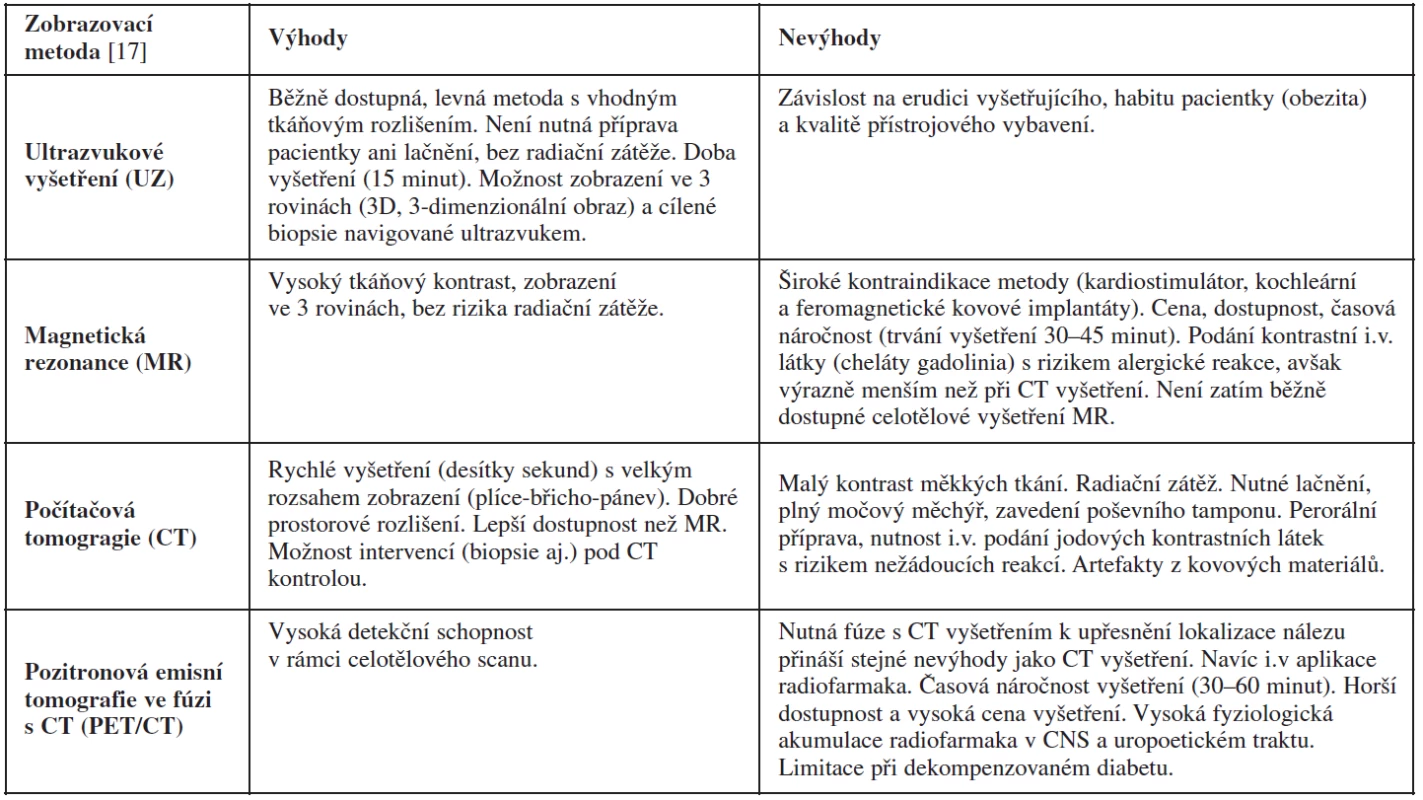
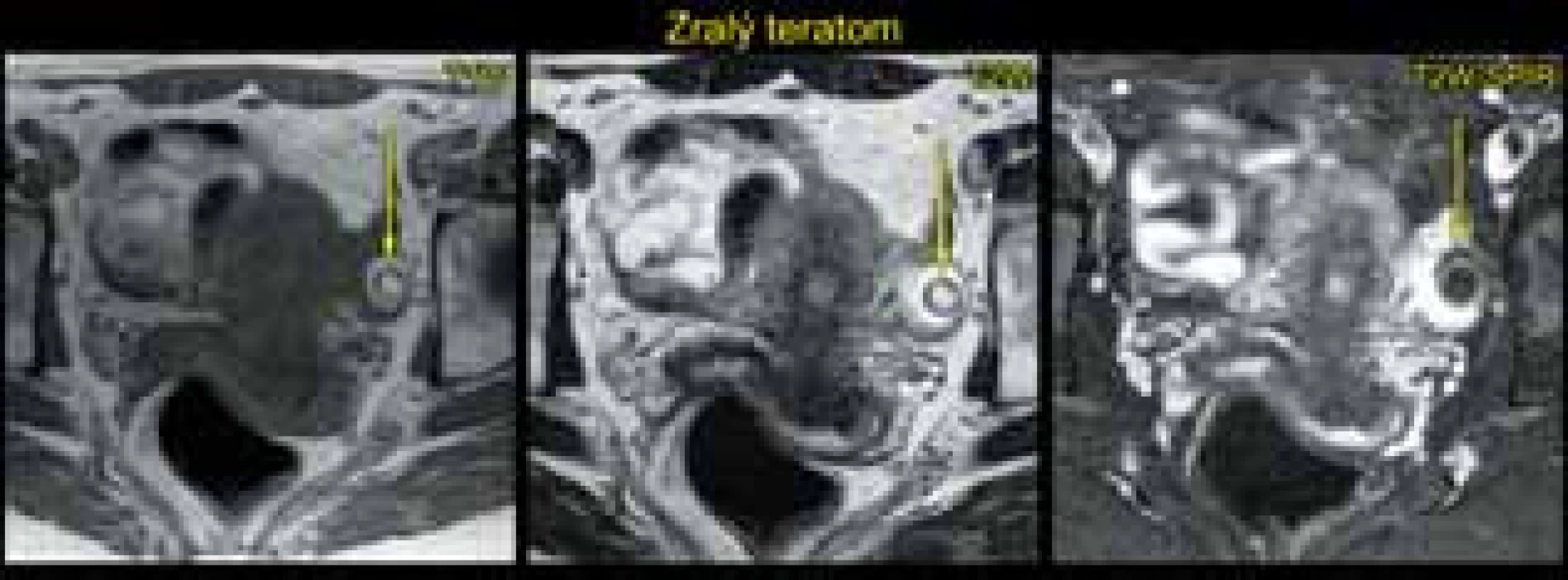
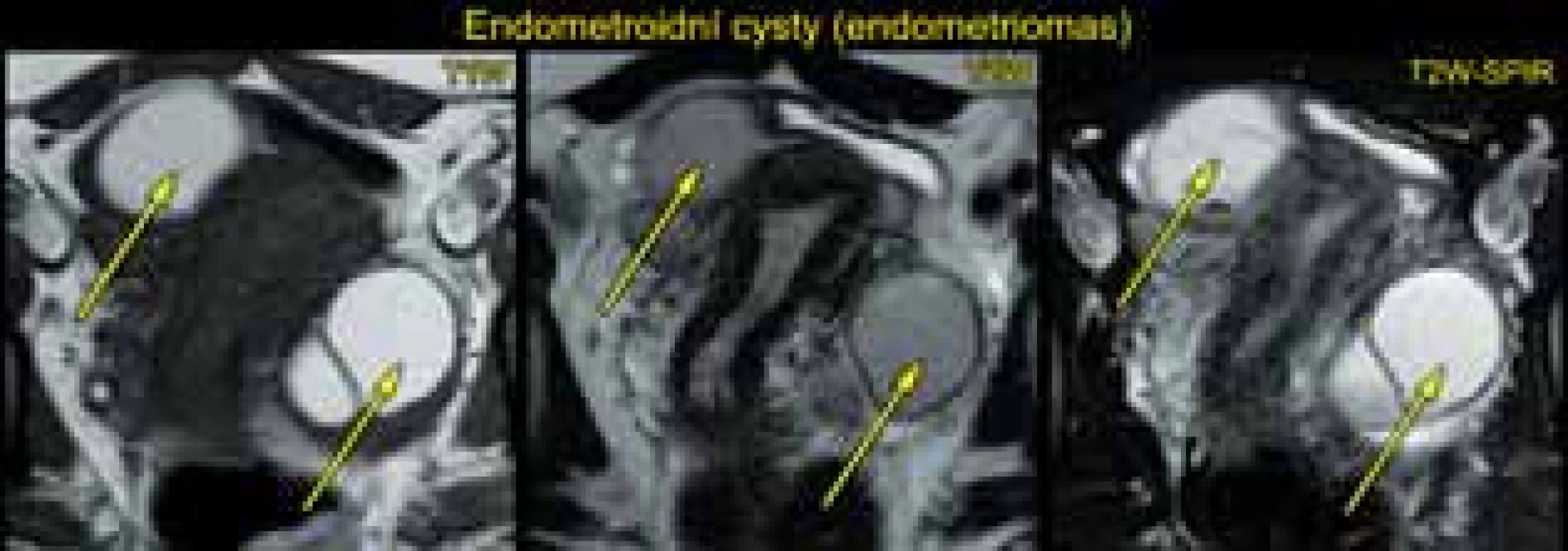
Magnetická rezonance (MR) v rukou zkušeného radiodiagnostika specializovaného na problematiku gynekologických nádorů má také popsanou vysokou přesnost (83–93 %) ve stanovení benigních a maligních ovariálních nádorů [5]. Její výhodou je vysoké tkáňové rozlišení na základě T1 a T2 vážených obrazů, difuzně vážených obrazů a perfuze. Magnetická rezonance má však známé limitace (např. v zobrazení malých nádorů <2–4 cm, odlišení borderline a invazivních ovariálních nádorů) a kontraindikace ve srovnání s ultrazvukovým vyšetřením (tab. 7). V běžné praxi je MR využívána pouze ve sporných případech (odlišení tuku/kožního mazu od krevních produktů v diferenciální diagnostice dermoidní vs. endometroidní cysty apod.) (obr. 4 a 5).
3. Počítačová tomografie
Počítačová tomografie (computed tomography, CT) není vhodnou metodou pro diferenciální diagnostiku pánevních nádorů, vzhledem k nízkému tkáňovému rozlišení (tab. 7) [54]. Naopak je CT často využíváno v případě pokročilých ovariálních nádorů ke stanovení rozsahu onemocnění v břišní a hrudní dutině [27, 41]. Ve studii Forstnera a kol. dosáhlo CT ve stanovení předoperačního stadia karcinomu ovarií 50% senzitivity a 92% specificity [19]. Možnosti CT diagnostiky byly limitovány v detekci postižení mezenteria a drobné karcinomatózy na tenkém střevě. Také byla ověřována role CT v predikci operability. Podle studie Axtella a kol. dosáhlo CT v predikci suboptimální cytoredukce 79% senzitivity a 75% specificity, tyto příznivé výsledky se však v dalších studiích nepotvrdily, jelikož stanovení markerů inoperability je zcela individuální pro dané onkogynekologické centrum a jeho specifickou operační erudici [3]. Je důležité zdůraznit i radiační zátěž CT vyšetření asociovanou s rizikem vzniku malignity. Toto riziko se týká nejen onkologických pacientek s opakovaným CT vyšetřením, ale také běžné populace, kde narůstá počet CT vyšetření mnohdy bez opodstatněné indikace. Ve Spojených státech se očekává 29 000 nových zhoubných nádorů na základě CT vyšetření břicha/pánve (vznik zhoubných nádorů střeva) a plic (vznik nádorů plic, prsů) provedených v roce 2007 a 14 00 úmrtí na tato onemocnění (asi 1 úmrtí/2000 CT vyšetření) [6].
4. Počítačová emisní tomografie kombinovaná s CT
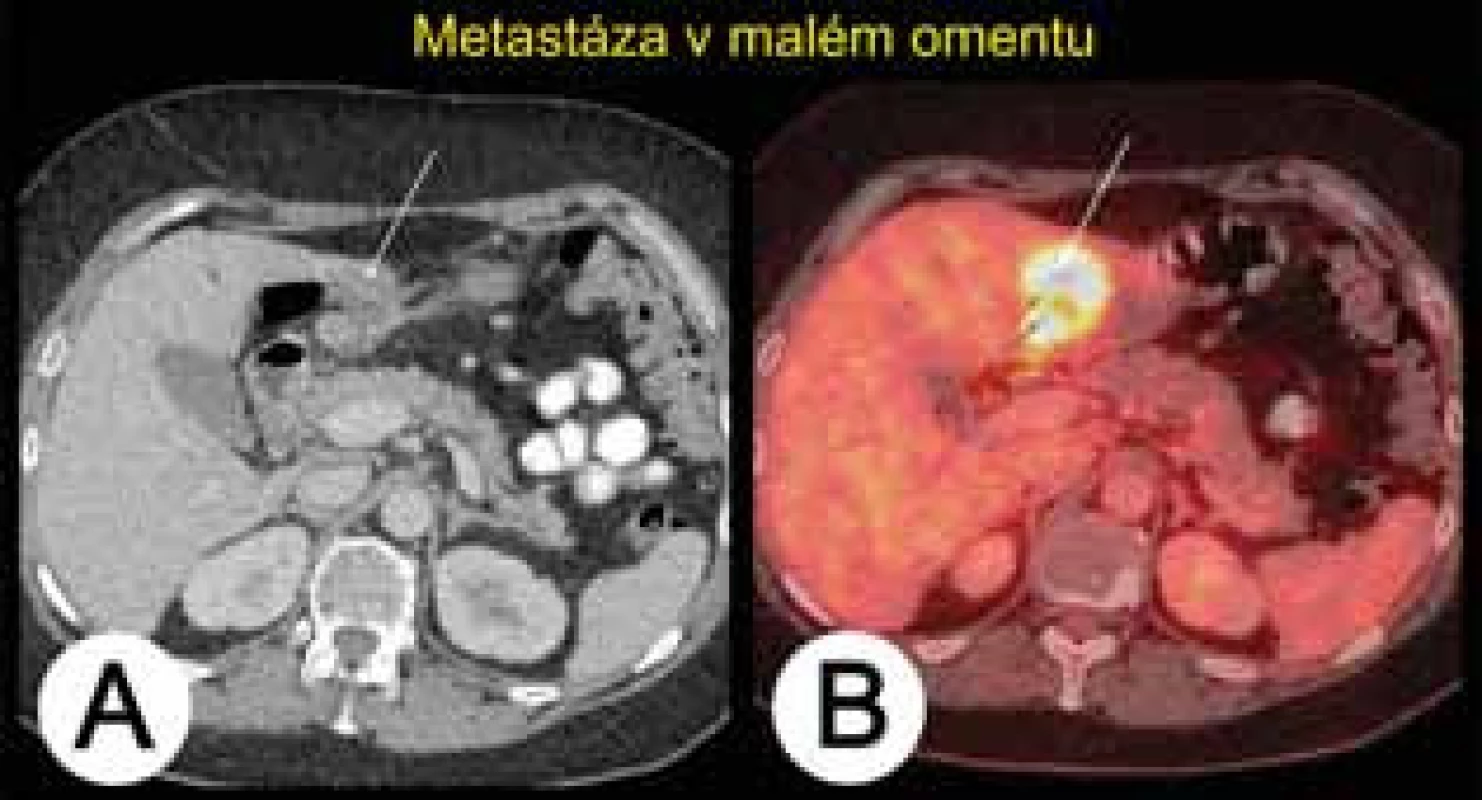
Počítačová emisní tomografie kombinovaná s CT (PET/CT) (tab. 7) není vhodnou metodou v diferenciální diagnostice ovariálních nádorů. Vzhledem k převaze cystické složky u borderline nádorů či dobře diferencovaných ovariálních karcinomů mohou být tyto nádory chybně interpretovány během PET/CT vyšetření jako nádory benigní [31, 38]. Podobně PET/CT nezachytí malé maligní léze (≤5–10 mm), čímž vede k dalším falešně negativním nálezům v 5–10 % případů. Naopak může být tato metoda falešně pozitivní se zvýšením příjmu radiofarmaka – značené glukózy (2-(F-18)-fluoro-2-deoxy-D-glucose, FDG) – v ovariích během ovulace či při zánětu (tuboovariální absces) a benigních afekcích (pendulující myom, endometroidní nebo dermoidní cysta, cystadenomy aj.). Z těchto důvodů musí být nález z PET/CT vždy korelován s menopauzálním stavem ženy a datací menstruačního cyklu. Alarmujícím nálezem pro možnou přítomnost ovariálního maligního nádoru nadále zůstává zvýšená akumulace radiofarmaka v ovariích u postmenopauzální ženy. Větší přínos PET/CT je v detekci extraabdominálních metastáz (např. supraklavikulární lymfadenopatie) či duplicitních nádorů (např. karcinom prsu nebo štítné žlázy) v rámci vstupního vyšetření před plánovanou operací pokročilého ovariálního karcinomu. Podle studie Risuma a kol. až 60 % pacientek (16 ze 27 pacientek) s ovariálním karcinomem FIGO stadia IIIC bylo na základě PET/CT překlasifikováno na stadium IV, což vedlo ke změně definitivního rozsahu plánované cytoredukční operace. Vzhledem k limitované časové dostupnosti vyšetření a jeho ceně se však PET/CT v rámci předoperační diagnostiky pokročilých nádorů využívá pouze ojediněle. Častěji je PET/CT indikováno v rámci sledování onkologických pacientek, u nichž je vysloveno podezření na recidivující nádor většinou na základě elevace CA125, kdy běžné zobrazovací metody jeho přítomnost neprokázaly. Podle metaanalýzy srovnávající přínos PET/CT, MR a CT v detekci nádorové recidivy dosáhlo PET/CT nejlepších výsledků (senzitivita 91 % a specificita 88 %), zatímco CT a MR mělo senzitivitu 79 a 75 %, specificitu 84 % a 78 % [25]. PET/CT lépe zobrazilo hypermetabolické implantáty v subhepatální (obr. 6) či subdiafragmatické oblasti, na serózách střeva či drobné infiltrované uzliny. Dále na základě hodnocení stupně akumulace radiofarmaka PET/CT lépe odlišilo pooperační změny (seromy, tukové nekrózy, reaktivní lymfadenopatii aj.) od nádorové recidivy.
Moderní zobrazovací metody (UZ, CT, MR) diferencují benigní a maligní ovariální nádory na základě morfologických a cévních parametrů. Hlavním diagnostickým úskalím všech moderních zobrazovacích metod je překrývání makroskopických známek u benigních a maligních ovariálních nádorů. Nejpřesnější zobrazovací metodou zůstává ultrazvukové vyšetření, přičemž jednoduchá ultrazvuková pravidla a logistické regresní modely s využitím ultrazvukových proměnných (LR1 a LR2) poprvé v historii dosáhly přesnosti subjektivního hodnocení nádoru expertem, které nám však umožňuje i stanovení specifické diagnózy nádoru. Logistické regresní modely dokonce zachytily více časných invazivních nádorů a borderline nádorů než expertní ultrazvukové vyšetření. Lze očekávat, že využití jednoduchých ultrazvukových pravidel a matematických modelů (LR1 a LR2) v klinické praxi by mohlo vést nejen ke zlepšení managementu pacientky s ovariální malignitou, ale hlavně dlouhodobé prognózy jejího onemocnění, pokud by byla primárně operována v onkogynekologickém centru [11, 71]. Stanovení indexu rizika malignity (RMI) je ve srovnání s ultrazvukovým expertním vyšetřením a ověřenými modely prezentovanými výše (LR 1 a LR2 a jednoduchá ultrazvuková pravidla) nejméně spolehlivým modelem současné klinické praxe (tab. 2) [47, 50, 51, 68].
NÁDOROVÉ MARKERY
Je překvapivé, že za posledních 25 let bylo pouze velmi málo biomarkerů schváleno ke klinickému použití. V roce 1983 publikoval Bast a kol. práci o využití monoklonální protilátky k detekci CA125 (cancer antigen 125) pro monitorování průběhu léčby ovariálního karcinomu [4]. V roce 1999 byl popsán další biomarker HE4 (human epididymis secretory protein 4) zvýšeně se exprimující u ovariálních karcinomů, který byl v roce 2009 uveden do klinické praxe [40]. Tento marker byl FDA (Food and Drug Administration) schválen pouze pro monitoraci recidivujících ovariálních karcinomů, nikoliv pro diferenciální diagnostiku benigních a maligních ovariálních nádorů či pro screening. Dále FDA schválila využití panelu markerů (OVA 1), které v kombinaci s gynekologickým vyšetřením by měly přispět k rozhodnutí o odeslání pacientky do onkogynekologického centra.
Nádorové markery CA125 a HE4 jsou zvýšeně exprimovány v případě non-mucinózních ovariálních karcinomů a jejich přítomnost závisí na stadiu onemocnění (tab. 8). CA125 je méně senzitivní v časném stadiu ovariálního karcinomu, zatímco HE4 v pozdním stadiu onemocnění. Navíc CA125 je méně specifický u premenopauzálních žen, kde je často falešně pozitivně zvýšen v souvislosti s myomy, endometriózou, pánevním zánětem, zatímco HE4 může být falešně pozitivní spíše v postmenopauze, zvláště v případě renální insuficience. Panel markerů OVA 1 (Transthyretin (TT or prealbumin), Apolipoprotein A-1 (Apo A-1), beta2-Microglobulin (beta2M), Transferrin (Tfr) and Cancer Antigen 125 (CA125 II)) byl navržen jako doplňkový test k fyzikálnímu vyšetření. V případě pozitivního OVA 1 testu jsou odeslány pacientky do onkogynekologických center k dovyšetření. Vzhledem k vysoké falešné pozitivitě testu je nutná kombinace testu se zobrazovacími metodami. Tento test není vhodný ani ke screeningu ovariálního maligního nádoru, ani k diferenciální diagnostice benigních a maligních ovariálních nádorů.
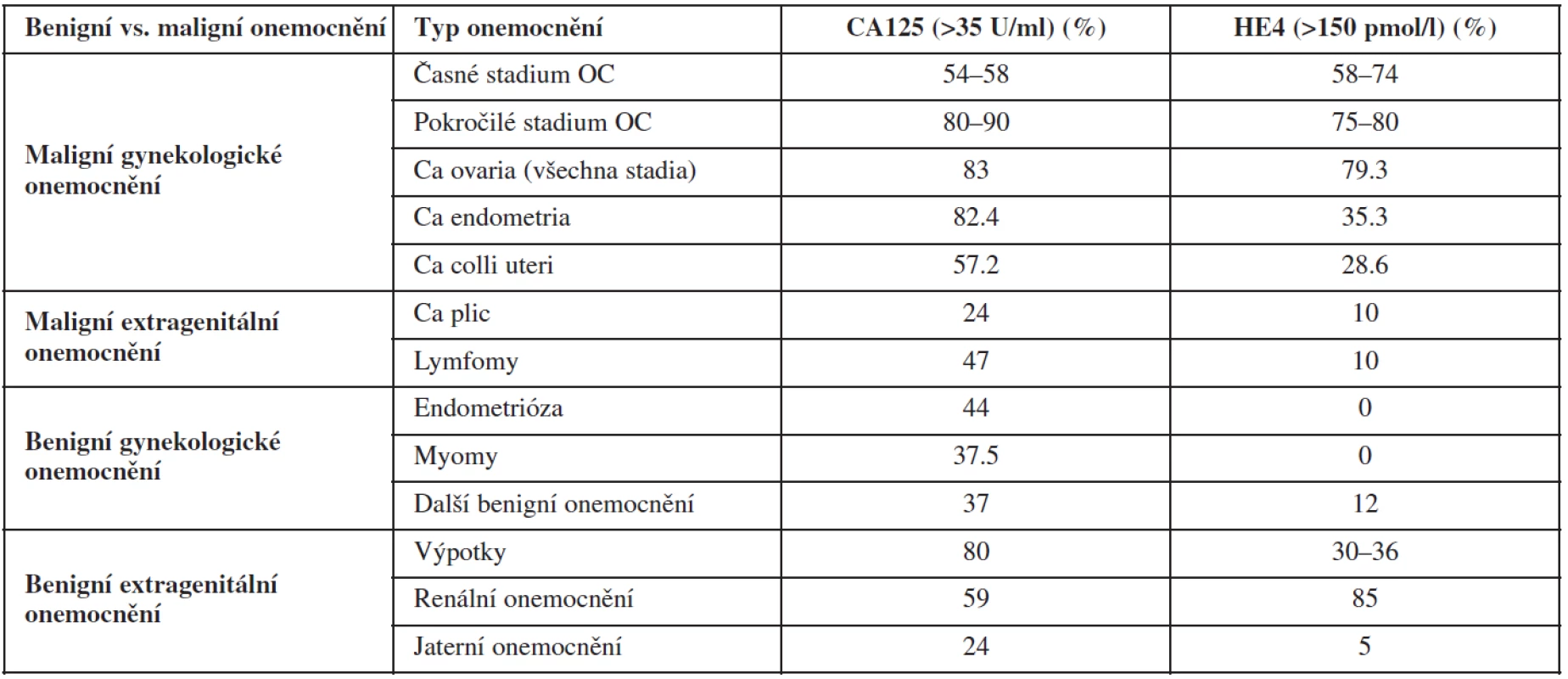
Antigen CA125 je glykoprotein, který patří mezi onkofetální antigeny. Tento marker je zatím nejčastěji využívaným markerem v diagnostice ovariálního karcinomu, i když jeho senzitivita a specificita v detekci ovariální malignity není vyhovující. Falešně pozitivně zvýšené hodnoty (pozitivní výsledek CA125 ≥35 U/ml) se mohou naměřit u žen za fyziologických stavů, jako je menstruace nebo gravidita. U nezhoubných gynekologických onemocnění mohou být zvýšené hodnoty CA125 nalezeny u pacientek s benigními nálezy, viz výše, kdy podle databáze IOTA u 3511 pacientek s ovariálními nádory byl medián hladiny CA125 43 U/ml u pacientek s endometroidní cystou a 45 U/mL v souvislosti s abscesem adnex [61]. K elevaci markeru CA125 dochází také u nezhoubných extragenitálních onemocnění, většinou spojených s tvorbou výpotků (renální, jaterní či kardiální onemocnění). V případě maligních onemocnění opět není CA125 orgánově ani nádorově specifický (tab. 8). Bývá zvýšen u zhoubných epitelových nádorů (endometroidní karcinom dělohy, endocervikální karcinom, karcinom plic) i non-epitelových nádorů (lymfomy). Navíc, jak již bylo uvedeno, jeho senzitivita je ovlivněna histotypem (mucinózní vs. non-mucinózní karcinomy ovarií) a stadiem ovariálního karcinomu. Abnormální hladiny CA125 jsou přítomny pouze u 50–60 % borderline nádorů a časných stadií ovariálních karcinomů a v 80 % pokročilých stadií. Na základě těchto informací je zřejmé, že výsledek předoperační hladiny CA125 (negativní výsledek CA125 <35 U/ml vs. pozitivní výsledek CA125 ≥35 U/ml) nemůže spolehlivě odlišit benigní a maligní onemocnění (vysoký počet falešně pozitivních nálezů u žen s endometriodními cystami, fibromy, pánevním zánětem vs. 40–50 % falešně negativních nálezů u časných stadií ovariálního karcinomu a borderline ovariálních nádorů) [60]. Proto zajímavou prací, vycházející opět z pracovní skupiny IOTA, bylo stanovení pravděpodobnosti přítomnosti určité ovariální nádorové léze na základě hladiny naměřené hodnoty CA125 než pouze hodnocení negativního/pozitivního výsledku tohoto markeru (graf 2) [61].

Další biomarker HE4 (pozitivní výsledek >150 pmol/l), který je zvýšeně exprimován v ovariálních karcinomech, je také glykoprotein [40]. HE4 má vyšší specificitu než CA125, i když také bývá falešně pozitivně zvýšen, a to například u karcinomů plic nebo endometria, renálních onemocnění nebo výpotků. Jeho výhodou, ve srovnání s CA125, je nižší falešná pozitivita u benigních gynekologických onemocnění (zvláště endometriózy). Samotné využití HE4 se neosvědčilo, vzhledem k vysokému počtu falešně negativních nálezů (až 21 %). Z těchto důvodů byl Moorem a kol. vytvořen logistický regresní model tzv. ROMA algoritmus (risk of ovarian malignancy algorithm), který kombinuje oba markery (dual marker algorithm) a menopauzální stav pacientky. ROMA algoritmus detekuje pre - a postmenopauzální ženy v nízkém či vysokém riziku ovariálního karcinomu [34]. Tento test se stal populárním zvláště ve Spojených státech. Kombinace obou markerů vede k vyšší senzitivitě záchytu maligních ovariálních nádorů, avšak za cenu zvýšení falešně pozitivních nálezů, zvláště u premenopauzálních žen. Proto je využíván ROMA algoritmus spíše u postmenopauzálních žen. Další limitací obou markerů je jejich nižší prediktivní hodnota u mucinózních karcinomů, kde se doporučuje stanovení jiného markeru – CA 19-9. Přínos kombinace CA125 a HE4 v rámci ROMA algoritmu byl doložen zvláště jeho autory [34], ale další studie již neprokázaly výhody kombinovaného odběru HE4/CA125 nebo samotného odběru HE4 ve srovnání se samotným odběrem CA125 [28, 63].
Studie, které porovnávaly přínos dostupných biomarkerů (samotný odběr CA125 a HE4 nebo kombinaci těchto markerů v ROMA algoritmu) s ultrazvukovým vyšetřením, potvrdily opět omezenou roli těchto biomarkerů ve srovnání s ultrazvukovým vyšetřením. Samotný odběr HE4 sice zachytí více časných stadií ovariálního karcinomu ve srovnání s CA125 (senzitivita 46,2 % vs. 23,1 %) [33], ale tyto výsledky jsou nesrovnatelně horší než přináší ultrazvukové vyšetření v detekci časného ovariálního karcinomu (subjektivní hodnocení, LR1 a LR2 test mají senzitivitu 92 %, 97 % a 95 %) [68]. Pokud byl srovnáván přínos samotného předoperačního stanovení CA125 a ultrazvukového vyšetření, tak stanovení CA125 klasifikovalo správně 83 % nádorů (95% CI = 80,3–85,6 %), zatímco ultrazvuk nejen správně klasifikoval 93 % nádorů (95% CI = 90,9–94,6 %), ale navíc určil i specifickou diagnózu nádoru [60]. V této studii se neosvědčilo využití CA125 ani při testování různých hladin CA125 (cut-off) pro pozitivní / negativní test pro pre - a postmenopauzální populaci. Přínos předoperačního stanovení CA125 nebyl potvrzen ani v případě diagnostické nejistoty o typu léze (benigní vs. maligní) při vyšetření ultrazvukovým expertem [58]. Podobně kombinace markerů v rámci ROMA algoritmu přinesla horší výsledky než ultrazvukové vyšetření (subjektivní hodnocení expertem a/nebo stanovení indexu rizika malignity) v diferenciální diagnostice benigních a maligního ovariálního nádoru (graf 3) [64].

Další otázkou bylo, zda kombinace ultrazvukového vyšetření s následným odběrem CA125 (second stage test) nezlepší predikci adnexální léze. Předoperační stanovení hladiny CA125 negativně ovlivnilo přesnost subjektivního hodnocení ovariální léze expertem, pokud byla hodnota markeru známa nebo byl marker doplněn v druhém kroku (second stage test) [58]. Podobně se neosvědčila kombinace CA125 s matematickými modely [48, 59]. Ve studii publikované v roce 2007 nebyl prokázán přínos multimodálního logistického regresního modelu (M2), který obsahoval CA125, proti již zmíněnému logistickému regresnímu modelu LR1. Přínos multimodálního nového modelu nebyl nalezen, ani pokud byl testován v subpopulaci pre - a postmenopauzálních žen [M3, M4] [48]. Podobně se nepotvrdil přínos logistického regresního modelu s implementací CA125 v případě obtížně klasifikovatelných nádorů při expertním ultrazvukovém vyšetření [59].
V roce 2011 bylo publikováno klinické doporučení číslo 122 (Recognition and initial management of ovarian cancer) vydané NICE (National Institute of Health and Clinical Excellence) [36], které podpořila ACOG (American College of Obstetricians and Gynecologists) a původně také RCOG (Royal College of Obstetricians and Gynaecologists). V tomto doporučení, v rozporu s výše prezentovanými daty z velkých metaanalýz, je v primární diagnostice (podezření na ovariální karcinom na základě symptomů) i v sekundární péči, kterou poskytuje vyšší pracoviště, kladena hlavní role odběru CA125. Pouze v případě elevace CA125 je doporučeno doplnit ultrazvukové vyšetření. Jako prediktivní model volby v předoperační diagnostice adnexálních nádorů je doporučeno stanovení indexu rizika malignity (RMI). Je evidentní, že NICE doporučení byla postavena pouze na výsledku jedné metaanalýzy (Geomini a kol.) a malých RMI studií [20]. Na základě NICE doporučení by se v primární péči zanedbalo až 40 % časných ovariálních karcinomů (IOTA databáze, 63/159 pacientek s ovariálním karcinomem FIGO stadia I), kde je CA125 negativní (<35 IU/ml). Podobně by byla nedostatečná diagnostika u více než 50 % borderline nádorů podle velké metanalýzy du Bois a kol. (1042/1937 pacientek s BOT) s negativní hodnotou markeru CA125 [10], což je ve shodě s daty IOTA studie, kdy borderline nádory měly medián CA125 29 U/ml [15, 61]. Naopak by bylo mnoho pacientek zbytečně referováno k expertnímu ultrazvukovému vyšetření (second stage test) na základě falešně pozitivní hodnoty CA125 a k častým a zbytečným operačním intervencím. Proto naše mezinárodní pracovní skupina iniciovala kritický komentář k těmto NICE doporučením publikovaný v roce 2011 v BMJ online, z něhož vyplývá, že v případě symptomů pacientky je metodou volby provedení ultrazvukového vyšetření (subjektivní hodnocení nádoru nebo využití jednoduchých ultrazvukových pravidel nebo matematických modelů s predikcí individuálního rizika malignity), nikoliv samotný odběr markeru CA125 a/nebo stanovení indexu rizika malignity založeném opět na markeru CA125. Tento komentář byl kladně přijat RCOG a inicioval změnu jejich doporučení (Green-top guideline No. 22), viz výše.
Závěrem je třeba zdůraznit, že stanovení CA125 není zatím indikováno ani v případě screeningu (záchytu maligní ovariální léze) u asymptomatické ženy a podle velké screeningové studie PLCO (The Prostate, Lung, Colorectal and Ovarian Cancer Screening Randomized Controlled Trial) zvyšuje pouze počet nadbytečných výkonů a závažných komplikací u falešně pozitivních nálezů [8]. Výsledky další screeningové studie UKCTOCS (The UK Collaborative Trial of Ovarian Cancer Screening) budou známy až v roce 2015. Jedinou oblastí, kdy lze doporučit odběr CA125, je sledování efektu léčby u maligního ovariálního nádoru na základě dynamiky poklesu markeru [4]. Sledování CA125 u pacientek v kompletní remisi po ukončené primární léčbě je podle doporučení ESGO (European Society of Gynaecological Cancer) doporučeno zvláště u pacientek, kde časný záchyt recidivy umožní provedení sekundárního cytoredukčního výkonu, nebo pokud byla či bude pacientka zahrnuta do studie nového léku či nové léčebné kombinace v rámci první či druhé linie léčby [62, 70]. Vliv rutinního sledování CA125 na přežití u neselektované populace pacientek po primární léčbě ovariálního karcinomu nebyl ve studii OV05/EORTC 55955 doložen [39].
Na základě současných dat nevede předoperační stanovení samotného nádorového markeru CA125, HE4 nebo jejich kombinace ke zlepšení predikce maligního ovariálního nádoru ve srovnání s ultrazvukovým vyšetřením (subjektivní zhodnocení nádoru zkušeným sonografistou nebo využití jednoduchých ultrazvukových pravidel nebo modelů LR1 a LR2). Další úsilí bude věnováno studiu nových spolehlivějších biomarkerů nebo využití současných biomarkerů pouze u určitých typů nádorů.
VÝHLED DO BUDOUCNOSTI
Nelze předpokládat, že jedna metoda dovede spolehlivě charakterizovat všechny ovariální nádory, proto pokračuje testování kombinace diagnostických testů (např. ultrazvuku a biochemických parametrů – biomarkery, proteomika aj.). Nejtěžším úkolem zůstává rozpoznat typ nádoru u tzv. obtížně klasifikovatelných lézí. Klinicky důležité je také spolehlivě předoperačně odlišit jednotlivé subtypy nádorového onemocnění, jelikož je odlišný management, pokud jde o primární ovariální nádor typu borderline nádoru, nebo již invazivní karcinom, či dokonce o zhoubný nádor jiné lokality metastazující do ovarií. První výsledky testování kombinace diagnostických testů očekáváme z nyní dokončené třetí fáze IOTA studie (uk. leden 2012, IOTA phase 3). Na těchto datech bude také pokračovat tvorba dalších modelů (Bayesian networks), které by mohly predikovat nejen typ nádoru (benigní vs. maligní nádor), ale také specifickou diagnózu nádoru. Spolehlivé předoperační stanovení specifické diagnózy nádoru bylo zatím možné pouze ultrazvukovým expertem [14].
Dalším cílem je zlepšit predikci benigního a maligního ovariálního nádoru při vyšetření méně zkušeným sonografistou se zapojením jednoduchých ultrazvukových pravidel a matematických modelů. V rámci mezinárodní prospektivní studie IOTA fáze 5 (IOTA phase 5) bude nejprve ověřena znalost těchto sonografistů v popisu adnexálních lézí s využitím obecně platné ultrazvukové terminologie (tab. 5). Následně bude v ukou méně zkušených sonografistů testován přínos matematických modelů (LR1 a LR2) a jednoduchých ultrazvukových pravidel ve stanovení typu nádoru (benigní vs. maligní nádor), jelikož vysoká spolehlivost modelů vytvořených mezinárodní skupinou IOTA byla zatím doložena pouze při testování sonografickými experty.
Neposledním úkolem bude ověřit bezpečnost konzervativního postupu u určitých ovariálních nádorů (např. v případě nálezu nesuspektní unilokulární anechogenní cysty u postmenopauzální ženy) a stanovit spolehlivá sonomorfologická a dopplerovská kritéria nádorů, u kterých není nutná operační intervence. Následně budou ověřovány matematické modely, které dokážou spolehlivě selektovat pacientky ke konzervativnímu postupu na základě zadaných ultrazvukových parametrů. Tento úkol bude také řešen v prospektivní studii IOTA fáze 5.
ZÁVĚR
V současné době není známá účinná screeningová metoda, která by umožnila časnou detekci maligního nádoru ovarií. Ovariální nádor je zachycen buď na základě vyšetřujícího algoritmu iniciovaného symptomy pacientky, nebo náhodně, v rámci gynekologického či jiného vyšetření. Zvláště gastroenterologické obtíže vyšší intenzity a častější frekvence (více než 12krát za měsíc, trvání méně než 1 rok) by měly vést k doplnění pečlivého gynekologického vyšetření, jehož náplní je také pečlivé ultrazvukové zobrazení adnex. Ultrazvukové vyšetření má nejvyšší senzitivitu v detekci i zcela diskrétní adnexální patologie ve srovnání s dalšími moderními zobrazovacími metodami. V případě abnormálního ultrazvukového nálezu patří následné zhodnocení ovariální patologie zkušeným sonografistou k nejpřesnější předoperační metodě nejen v diferenciální diagnostice benigních a maligních ovariálních nádorů, ale také ve stanovení specifické diagnózy nádoru. Další zobrazovací metody (MR, CT, PET/CT) se v této indikaci využívají pouze komplementárně. U pokročilých nádorů má CT event. PET/CT významnou roli ve stanovení rozsahu šíření nádoru do dutiny břišní a extraabdominálně. I když bylo mnoho úsilí věnováno nalezení účinných biomarkerů a vytvoření algoritmů pro jejich efektivní využití, jejich klinický přínos zůstává nadále limitován. Dokud nebude nalezena a ověřena přesnější předoperační metoda, vhodná pro diferenciální diagnostiku benigních a maligních ovariálních nádorů, měla by být hlavní pozornost soustředěna na vzdělávání ošetřujících gynekologů v základní ultrazvukové diagnostice a zajištění dostatečného počtu expertních sonografistů pro následné zhodnocení těchto abnormálních gynekologických nálezů. Tento postup zajistí cílené předání pacientky k adekvátní léčbě podle závažnosti nálezu.
Poděkování Adamu Preislerovi (Fakulta architektury, České vysoké učení technické v Praze) za grafickou úpravu obrazové dokumentace.
Práce byla podpořena Univerzitou Karlovou v Praze (projekt UNCE 204024), grantem Ministerstva zdravotnictví ČR RVO-VFN64165/2012 a grantem Interní grantové agentury Ministerstva zdravotnictví ČR NT 13070.
MUDr. Daniela Fischerová, Ph.D.
Onkogynekologické centrum
Gynekologicko-porodnická klinika
l. LF UK a VFN
Apolinářská 18
128 51 Praha 2
e-mail: daniela.fischerova@seznam.cz
Zdroje
1. Alcazar, JL., Jurado, M. Three-dimensional ultrasound for assessing women with gynecological cancer: a systematic review. Gynecol Oncol, 2011, 120, 3, p. 340–346.
2. Andersen, MR., Goff, BA., Lowe, KA., et al. Combining a symptoms index with CA125 to improve detection of ovarian cancer. Cancer, 2008, 113, 3, p. 484–489.
3. Axtell, AE., Lee, MH., Bristow, RE., et al. Multi-institutional reciprocal validation study of computed tomography predictors of suboptimal primary cytoreduction in patients with advanced ovarian cancer. J Clin Oncol, 2007, 25, 4, p. 384–389.
4. Bast, RC., Jr., Klug, TL., St John, E., et al. A radioimmunoassay using a monoclonal antibody to monitor the course of epithelial ovarian cancer. N Engl J Med, 1983, 309, 15, p. 883–887.
5. Bazot, M., Darai, E., Nassar-Slaba, J., et al. Value of magnetic resonance imaging for the diagnosis of ovarian tumors: a review. J Comput Assist Tomogr, 2008, 32, 5, p. 712–723.
6. Berrington de Gonzalez, A., Mahesh, M., Kim, KP., et al. Projected cancer risks from computed tomographic scans performed in the United States in 2007. Arch Intern Med, 2009, 169, 22, p. 2071–2077.
7. Bristow, RE., Tomacruz, RS., Armstrong, DK., et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis. J Clin Oncol, 2002, 20, 5, p. 1248–1259.
8. Buys, SS., Partridge, E., Black, A., et al. Effect of screening on ovarian cancer mortality: the prostate, lung, Colorectal and Ovarian (PLCO) Cancer Screening Randomized Controlled Trial. JAMA, 2011, 305, 22, p. 2295–2303.
9. Calda, P., Břešták, M., Fischerová, D. Ultrazvukové vyšetření v porodnictví a gynekologii: třístupňová koncepce a certifikace. Actual Gyn, 2012, 4, s. 22–30.
10. du Bois, A., Ewald-Riegler, N., du Bois, N., Harter, P. Borderline tumors of the ovary – a systematic review. Geburtsh Frauenheilk, 2009, 69, p. 807–833.
11. du Bois, A., Reuss, A., Pujade-Lauraine, E., et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: a combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials: by the Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) and the Groupe d’Investigateurs Nationaux Pour les Etudes des Cancers de l’Ovaire (GINECO). Cancer, 2009, 115, 6, p. 1234–1244.
12. du Bois, A., Rochon, J., Pfisterer, J., Hoskins, WJ. Variations in institutional infrastructure, physician specialization and experience, and outcome in ovarian cancer: a systematic review. Gynecol Oncol, 2009, 112, 2, p. 422–436.
13. Fischerova, D., Cibula, D., Dundr, P., et al. Ultrasound-guided tru-cut biopsy in the management of advanced abdomino-pelvic tumors. Int J Gynecol Cancer, 2008, 18, 4, p. 833–837.
14. Fischerova, D. Ultrazvukové zobrazení benigních a maligních ovariálních nádorů. In Ultrazvuková diagnostika v těhotenství a gynekologii, Calda, P. ed. Praha: Aprofema, 2010, s. 457–476.
15. Fischerova, D., Franchi, D., Testa, A., et al. Ultrasound in diagnosis of new and borderline ovarian tumors. Ultrasound Obstet Gynecol, 2010, 36, Suppl.1, Abstract OC01.03, p. 1.
16. Fischerova, D. Ultrasound scanning of the pelvis and abdomen for staging of gynecological tumors: a review. Ultrasound Obstet Gynecol, 2011, 38, 3, p. 246–266.
17. Fischerová, D., Burgetová, A., Seidl, Z., Bělohlávek, O. Diagnostika. In Onkogynekologie, Cibula, D., Petruželka, L. ed. Praha: Grada Publishing, 2009, p. 105.
18. Fischerová, D. Pánevní anatomie v ultrazvukovém obraze, In Ultrazvuková diagnostika v těhotenství a gynekologii, Calda, P. ed. Praha: Aprofema, 2010, s. 380–401.
19. Forstner, R., Hricak, H., Occhipinti, KA., et al. Ovarian cancer: staging with CT and MR imaging. Radiology, 1995, 197, 3, p. 619–626.
20. Geomini, P., Kruitwagen, R., Bremer, GL., et al. The accuracy of risk scores in predicting ovarian malignancy: a systematic review. Obstet Gynecol, 2009, 113, 2 Pt 1, p. 384–394.
21. Givens, V., Mitchell, GE., Harraway-Smith, C., et al. Diagnosis and management of adnexal masses. Am Fam Physician, 2009, 80, 8, p. 815–820.
22. Goff, BA., Mandel, LS., Melancon, CH., Muntz, HG. Frequency of symptoms of ovarian cancer in women presenting to primary care clinics. JAMA, 2004, 291, 22, p. 2705–2712.
23. Goff, BA., Mandel, L.S., Drescher, CW., et al. Development of an ovarian cancer symptom index: possibilities for earlier detection. Cancer, 2007, 109, 2, p. 221–227.
24. Grab, D., Flock, F., Stohr, I., et al. Classification of asymptomatic adnexal masses by ultrasound, magnetic resonance imaging, and positron emission tomography. Gynecol Oncol, 2000, 77, 3, p. 454–459.
25. Gu, P., Pan, LL., Wu, SQ., et al. CA125, PET alone, PET-CT, CT and MRI in diagnosing recurrent ovarian carcinoma: a systematic review and meta-analysis. Eur J Radiol, 2009, 71, 1, p. 164–174.
26. Guerriero, S., Alcazar, JL. The role of ovarian cancer symptom index, physical examination and power Doppler mapping for predicting ovarian cancer in suspicious adnexal masses on B-mode ultrasound. Ultrasound Obstet Gynecol, 2009, 34, Supp.1.
27. Iyer, VR., Lee, SI. MRI, CT, and PET/CT for ovarian cancer detection and adnexal lesion characterization. AJR Am J Roentgenol, 2010, 194, 2, p. 311–321.
28. Jacob, F., Meier, M., Caduff, R., et al. No benefit from combining HE4 and CA125 as ovarian tumor markers in a clinical setting. Gynecol Oncol, 2011, 121, 3, p. 487–491.
29. Jacobs, I., Oram, D., Fairbanks, J., et al. A risk of malignancy index incorporating CA125, ultrasound and menopausal status for the accurate preoperative diagnosis of ovarian cancer. Br J Obstet Gynaecol, 1990, 97, 10, p. 922–929.
30. Jaeschke, R., Guyatt, G., Sackett, DL. Users’ guides to the medical literature. III. How to use an article about a diagnostic test. A. Are the results of the study valid? Evidence-Based Medicine Working Group. JAMA, 1994, 271, 5, p. 389–391.
31. Jung, DC., Choi, HJ., Ju, W., et al. Discordant MRI/FDG-PET imaging for the diagnosis of borderline ovarian tumors. Int J Gynecol Cancer, 2008, 18, 4, p. 637–641.
32. Maggino, T., Gadducci, A., D’Addario, V., et al. Prospective multicenter study on CA125 in postmenopausal pelvic masses. Gynecol Oncol, 1994, 54, 2, p. 117–123.
33. Moore, RG., Brown, AK., Miller, MC., et al. The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass. Gynecol Oncol, 2008, 108, 2, p. 402–408.
34. Moore, RG., McMeekin, DS., Brown, AK., et al. A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass. Gynecol Oncol, 2009, 112, 1, p. 40–46.
35. Padilla, LA., Radosevich, DM., Milad, MP. Limitations of the pelvic examination for evaluation of the female pelvic organs. Int J Gynaecol Obstet, 2005, 88, 1, p. 84–88.
36. Redman, C., Duffy, S., Bromham, N., Francis, K. Recognition and initial management of ovarian cancer: summary of NICE guidance. BMJ, 2011, 342, 2073.
37. Rieber, A., Nussle, K., Stohr, I., et al. Preoperative diagnosis of ovarian tumors with MR imaging: comparison with transvaginal sonography, positron emission tomography, and histologic findings. AJR Am J Roentgenol, 2001, 177, 1, p. 123–129.
38. Risum, S., Hogdall, C., Loft, A., et al. The diagnostic value of PET/CT for primary ovarian cancor – a prospective study. Gynecol Oncol, 2007, 105, 1, p. 145–149.
39. Rustin, GJ., van der Burg, ME., Griffin, CL., et al. Early versus delayed treatment of relapsed ovarian cancer (MRC OV05/EORTC 55955): a randomised trial. Lancet, 2010, 376, 9747, p. 1155–1163.
40. Schummer, M., Ng, WV., Bumgarner, RE., et al. Comparative hybridization of an array of 21,500 ovarian cDNAs for the discovery of genes overexpressed in ovarian carcinomas. Gene, 1999, 238, 2, p. 375–385.
41. Tempany, CM., Zou, KH., Silverman, SG., et al. Staging of advanced ovarian cancer: comparison of imaging modalities – report from the Radiological Diagnostic Oncology Group. Radiology, 2000, 215, 3, p. 761–767.
42. Testa, AC., Timmerman, D., Exacoustos, C., et al. The role of CnTI-SonoVue in the diagnosis of ovarian masses with papillary projections: a preliminary study. Ultrasound Obstet Gynecol, 2007, 29, 5, p. 512–516.
43. Testa, AC., Timmerman, D., Van Belle, V., et al. Intravenous contrast ultrasound examination using contrast-tuned imaging (CnTI) and the contrast medium SonoVue for discrimination between benign and malignant adnexal masses with solid components. Ultrasound Obstet Gynecol, 2009, 34, 6, p. 699–710.
44. Testa, AC., Ludovisi, M., Mascilini, F., et al. Ultrasound evaluation of intra-abdominal sites of disease to predict likelihood of suboptimal cytoreduction in advanced ovarian cancer: a prospective study. Ultrasound Obstet Gynecol, 2012, 39, 1, p. 99–105.
45. Timmerman, D., Schwarzler, P., Collins, WP., et al. Subjective assessment of adnexal masses with the use of ultrasonography: an analysis of interobserver variability and experience. Ultrasound Obstet Gynecol, 1999, 13, 1, p. 11–16.
46. Timmerman, D., Valentin, L., Bourne, TH., et al. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group. Ultrasound Obstet Gynecol, 2000, 16, 5, p. 500–505.
47. Timmerman, D., Testa, AC., Bourne, T., et al. Logistic regression model to distinguish between the benign and malignant adnexal mass before surgery: a multicenter study by the International Ovarian Tumor Analysis Group. J Clin Oncol, 2005, 23, 34, p. 8794–8801.
48. Timmerman, D., Van Calster, B., Jurkovic, D., et al. Inclusion of CA-125 does not improve mathematical models developed to distinguish between benign and malignant adnexal tumors. J Clin Oncol, 2007, 25, 27, p. 4194–4200.
49. Timmerman, D., Testa, AC., Bourne, T., et al. Simple ultrasound-based rules for the diagnosis of ovarian cancer. Ultrasound Obstet Gynecol, 2008, 31, 6, p. 681–690.
50. Timmerman, D., Ameye, L., Fischerova, D., et al. Simple ultrasound rules to distinguish between benign and malignant adnexal masses before surgery: prospective validation by IOTA group. BMJ, 2010, 341, c6839.
51. Timmerman, D., Van Calster, B., Testa, AC., et al. Ovarian cancer prediction in adnexal masses using ultrasound-based logistic regression models: a temporal and external validation study by the IOTA group. Ultrasound Obstet Gynecol, 2010, 36, 2, p. 226–234.
52. Tingulstad, S., Hagen, B., Skjeldestad, FE., et al. Evaluation of a risk of malignancy index based on serum CA125, ultrasound findings and menopausal status in the pre-operative diagnosis of pelvic masses. Br J Obstet Gynaecol, 1996, 103, 8, p. 826–831.
53. Tingulstad, S., Hagen, B., Skjeldestad, FE., et al. The risk-of-malignancy index to evaluate potential ovarian cancers in local hospitals. Obstet Gynecol, 1999, 93, 3, p. 448–452.
54. Togashi, K. Ovarian cancer: the clinical role of US, CT, and MRI. Eur Radiol, 2003, 13. Suppl 4, L87–104.
55. Valentin, L. Prospective cross-validation of Doppler ultrasound examination and gray-scale ultrasound imaging for discrimination of benign and malignant pelvic masses. Ultrasound Obstet Gynecol, 1999, 14, 4, p. 273–283.
56. Valentin, L., Hagen, B., Tingulstad, S., Eik-Nes, S. Comparison of ‘pattern recognition’ and logistic regression models for discrimination between benign and malignant pelvic masses: a prospective cross validation. Ultrasound Obstet Gynecol, 2001, 18, 4, p. 357–365.
57. Valentin, L., Ameye, L., Jurkovic, D., et al. Which extrauterine pelvic masses are difficult to correctly classify as benign or malignant on the basis of ultrasound findings and is there a way of making a correct diagnosis? Ultrasound Obstet Gynecol, 2006, 27, 4, p. 438–444.
58. Valentin, L., Jurkovic, D., Van Calster, B., et al. Adding a single CA125 measurement to ultrasound imaging performed by an experienced examiner does not improve preoperative discrimination between benign and malignant adnexal masses. Ultrasound Obstet Gynecol, 2009, 34, 3, p. 345–354.
59. Valentin, L., Ameye, L., Savelli, L., et al. Adnexal masses difficult to classify as benign or malignant using subjective assessment of gray-scale and Doppler ultrasound findings: logistic regression models do not help. Ultrasound Obstet Gynecol, 2011, 38, 4, p. 456–465.
60. Van Calster, B., Timmerman, D., Bourne, T., et al. Discrimination between benign and malignant adnexal masses by specialist ultrasound examination versus serum CA-125. J Natl Cancer Inst, 2007, 99, 22, p. 1706–1714.
61. Van Calster, B., Valentin, L., Van Holsbeke, C., et al. A novel approach to predict the likelihood of specific ovarian tumor pathology based on serum CA-125: a multicenter observational study. Cancer Epidemiol Biomarkers Prev, 2011, 20, 11, p. 2420–2428.
62. van der Zee, AG., Colombo, N., Gitsch, G., et al. ESGO statement on the role of CA-125 measurement in follow-up of epithelial ovarian cancer. Int J Gynecol Cancer, 2012, 22, 1, p. 175.
63. Van Gorp, T., Cadron, I., Despierre, E., et al. HE4 and CA125 as a diagnostic test in ovarian cancer: prospective validation of the Risk of Ovarian Malignancy Algorithm. Br J Cancer, 2011, 104, 5, p. 863–870.
64. Van Gorp, T., Veldman, J., Van Calster, B., et al. Subjective assessment by ultrasound is superior to the risk of malignancy index (RMI) or the risk of ovarian malignancy algorithm (ROMA) in discriminating benign from malignant adnexal masses. Eur J Cancer, 2012.
65. Van Holsbeke, C., Yazbek, J., Holland, TK., et al. Real-time ultrasound vs. evaluation of static images in the preoperative assessment of adnexal masses. Ultrasound Obstet Gynecol, 2008, 32, 6, p. 828–831.
66. Van Holsbeke, C., Daemen, A., Yazbek, J., et al. Ultrasound methods to distinguish between malignant and benign adnexal masses in the hands of examiners with different levels of experience. Ultrasound Obstet Gynecol, 2009, 34, 4, p. 454–461.
67. Van Holsbeke, C., Daemen, A., Yazbek, J., et al. Ultrasound experience substantially impacts on diagnostic performance and confidence when adnexal masses are classified using pattern recognition. Gynecol Obstet Invest, 2010, 69, 3, p. 160–168.
68. Van Holsbeke, C., Van Calster, B., Bourne, T., et al. External validation of diagnostic models to estimate the risk of malignancy in adnexal masses. Clin Cancer Res, 2012, 18, 3, p. 815–825.
69. Vergote, I., De Brabanter, J., Fyles, A., et al. Prognostic importance of degree of differentiation and cyst rupture in stage I invasive epithelial ovarian carcinoma. Lancet, 2001, 357, 9251, p. 176–182.
70. Verheijen, RH., Cibula, D., Zola, P., Reed, N. Cancer antigen 125: lost to follow-up?: An European society of gynaecological oncology consensus statement. Int J Gynecol Cancer, 2012, 22, 1, p. 170–174.
71. Vernooij, F., Heintz, AP., Witteveen, PO., et al. Specialized care and survival of ovarian cancer patients in the Netherlands: nationwide cohort study. J Natl Cancer Inst, 2008, 100, 6, p. 399–406.
72. Yamamoto, Y., Yamada, R., Oguri, H., et al. Comparison of four malignancy risk indices in the preoperative evaluation of patients with pelvic masses. Eur J Obstet Gynecol Reprod Biol, 2009, 144, 2, p. 163–167.
73. Yazbek, J., Raju, SK., Ben-Nagi, J., et al. Effect of quality of gynaecological ultrasonography on management of patients with suspected ovarian cancer: a randomised controlled trial. Lancet Oncol, 2008, 9, 2, p. 124–131.
74. Yoshida, Y., Kurokawa, T., Tsujikawa, T., et al. Positron emission tomography in ovarian cancer: 18F-deoxy-glucose and 16alpha-18F-fluoro-17beta-estradiol PET. J Ovarian Res, 2009, 2, 1, p. 7.
75. Zanetta, G., Rota, S., Lissoni, A., et al. Ultrasound, physical examination, and CA125 measurement for the detection of recurrence after conservative surgery for early borderline ovarian tumors. Gynecol Oncol, 2001, 81, 1, p. 63–66.
76. Zikan, M., Fischerova, D., Pinkavova, I., et al. Ultrasound-guided tru-cut biopsy of abdominal and pelvic tumors in gynecology. Ultrasound Obstet Gynecol, 2010, 36, 6, p. 767–772.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2012 Číslo 4
-
Všechny články tohoto čísla
- Gynekologicko-porodnická klinika „U Apolináře“
- Racionální předoperační diagnostika benigních a maligních ovariálních nádorů – zobrazovací metody, nádorové markery
- Přehled současné klasifikace a terminologie onemocnění vulvy
- Ultrazvuk v urogynekologii
- Vaginální tahuprosté páskové operace řešící stresový typ inkontinence moči u žen
- Prolaps a avulzní poranění levatoru
- Management a výsledky ambulantní hysteroskopie
- Endometrióza
- Laparoskopická lymfadenektomie v gynekologické operativě
- Laparoskopická konzervativní léčba děložních myomů
- Detekce hlavních fetálních strukturálních anomálií během ultrazvukového vyšetření v 1.-14. týdnu těhotenství v neselektované populaci
- In vitro fertilizace – rozbor údajů Národního registru asistované reprodukce za roky 2007-2011
- Akutní, nebo expektační přístup u předčasného porodu s předčasně odteklou plodovou vodou?
- Childbirth analgesia and anesthesia in the Czech Republic in 2012 The 20th anniversary of post-gradual education
- Porovnání krátkodobých výsledků TVT-O a TVT‑S v operační léčbě stresové inkontinence moči
- Netypická bolest při ruptuře děložní
- Epidemiologie genitálních bradavic mezi ženami v České republice
- Validita onkologické cytodiagnostiky a kolposkopie versus biopsie v prevenci rakoviny cervixu
- Koniec panvový – zmeny postoja vo vedení v rokoch 1959–2011
- Prof. MUDr. Evžen Čech, DrSc., osmdesátiletý
- Vzpomínka na MUDr. Michala Pětroše
- Současné postavení IPVZ v systému postgraduálního vzdělávání v oboru gynekologie a porodnictví
- Perinatální úmrtnost novorozenců před 70 lety: Časopis Česká gynekologie z roku 1942
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Endometrióza
- Prolaps a avulzní poranění levatoru
- Racionální předoperační diagnostika benigních a maligních ovariálních nádorů – zobrazovací metody, nádorové markery
- Gynekologicko-porodnická klinika „U Apolináře“
