Použití metotrexátu u ektopické gravidity a těhotenství neznámé lokalizace
Use of methotrexate in the ectopic pregnancy and pregnancy of unknown location
Objective:
There are only a few gynaecological departments in the Czech Republic that use medical treatment of the ectopic pregnancy (EP) or persistent pregnancy of unknown location (PUL). We have started using this method in 2008 at our clinic. The aim of this study was to assess the success rate of conservative medical treatment with methotrexate (MTX) in the dose of 1 mg/kg intramuscularly in patients with ectopic pregnancy or persistent pregnancy of unknown location and to compare the results of clinical history, clinical finding and laboratory results in a group of successful and a group of unsuccessful treatment.
Type of study:
Retrospective analysis.
Setting:
Charles University in Prague, 1st Medical Faculty and Hospital Bulovka, Department of Obstetrics and Gynaecology, Prague.
Methods:
Patients diagnosed with EP or persistent PUL diagnosed at the outpatient of our clinic in 01/2008 - 08/2014 who were hemodynamically stable and fulfilled the indication for medical treatment were enrolled in the study. Treatment success was decrease of free subunit of β-hCG (β-hCG) < 5 IU/L independent of the number of methotrexate doses administered.
Results:
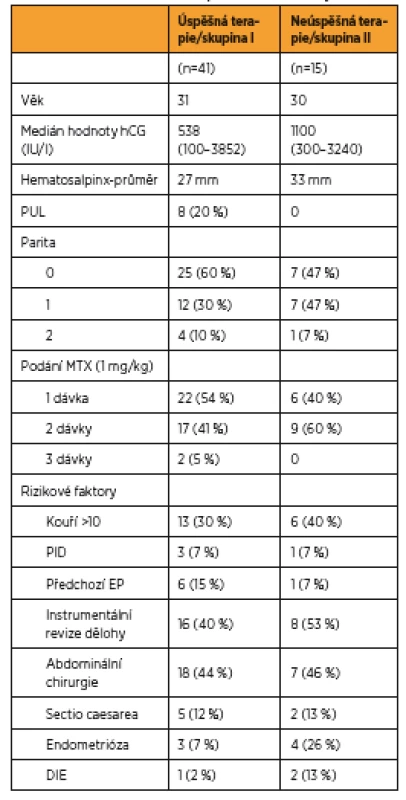
Two hundred and eleven patients were diagnosed with EP or PUL, sixty-three were eligible for our study and fulfilled the criteria for methotrexate treatment, fifty six women were finally analysed. From this number forty eight (86%) had clinically and laboratory diagnosed EP and eight (14%) were diagnosed with persistent PUL. Forty one patients (73%) had a successfull treatment (Group I) with the β-hCG level decrease <5 IU/L in a mean time of 27 days. When comparing the data of successful and unsuccessful treatment (Group II) we found a difference in the non-significant initial β-hCG level. In Group I there was a median β-hCG 538 IU/L (100–3852 IU/l), whereas in the unsuccessful Group II it was 1100 IU/L (300–3240 IU/l). Group I included more nuliparous women and more women with clinical histories of EP. Group II included more heavy smokers. The mean hematosalpinx diameter for group II, measured by transvaginal ultrasound, was larger. There were also more patients with endometriosis or deep infiltrating endometriosis in Group II, subsequently verified during laparoscopy, compared to Group I. There was no tubal rupture in these patients.
Conclusion:
The results of our study are comparable with foreign literature publications. We consider the pharmacological treatment of ectopic preganancy or persistent pregnancy of unknown location as effective and relatively safe for patients, with similar impact on a woman's fertility as laparoscopic salpingectomy.
Keywords:
ectopic pregnancy, pregnancy of unknown location, pharmacological treatment, methotrexate
Autoři:
Jana Racková
; Daniel Driák
; H. Neumannová; K. Hurt; B. Sehnal; M. Halaška
Působiště autorů:
Gynekologicko-porodnická klinika 1. LF UK, Nemocnice Na Bulovce, Praha, přednosta prof. MUDr. M. Halaška, DrSc.
Vyšlo v časopise:
Ceska Gynekol 2016; 81(2): 140-146
Souhrn
Cíl studie:
Farmakologickou terapií ektopické gravidity (ectopic pregnancy, EP) nebo perzistentního těhotenství neznámé lokalizace (pregnancy of unknown location, PUL) se v České republice zabývá jen malá část gynekologických pracovišť. Na naší klinice tuto možnost léčby používáme od roku 2008. Cílem studie bylo stanovit úspěšnost konzervativní medikamentózní terapie metotrexátem (MTX) v dávce 1 mg/kg intramuskulárně u pacientek s ektopickou graviditou a perzistentním těhotenstvím neznámé lokalizace a dále porovnat skupinu pacientek s úspěšnou a neúspěšnou medikamentózní terapií na základě anamnestických dat, klinického a laboratorního nálezu.
Typ studie:
Retrospektivní analýza.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce, Praha.
Metodika:
Do studie byly zařazeny pacientky vyšetřené na ambulanci naší kliniky v období od ledna 2008 do srpna 2014 s diagnózou EP nebo PUL, které splňovaly indikace k medikamentózní terapii a byly hemodynamicky stabilní. Za úspěšnost terapie jsme považovali pokles hodnoty volné podjednotky β-hCG (dále jen β-hCG) < 5 IU/l nezávisle na počtu podaných dávek MTX.
Výsledky:
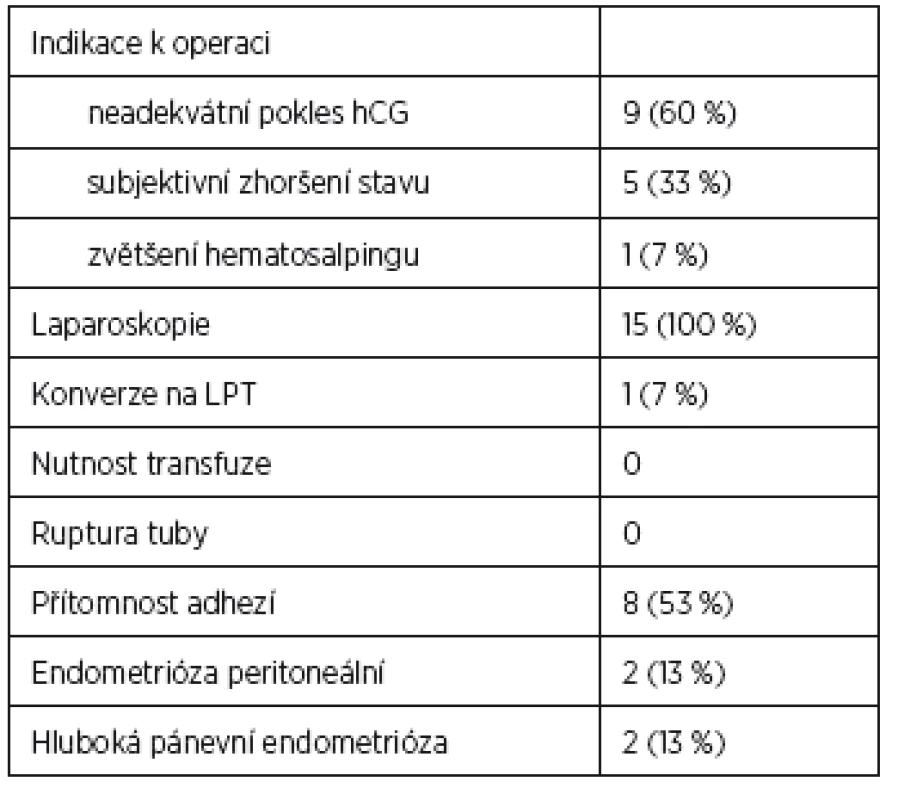
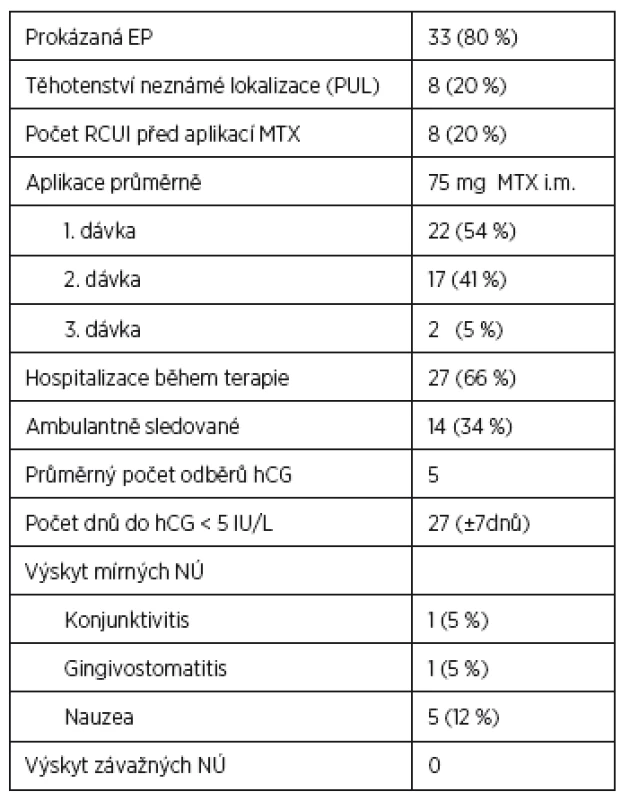
Celkem bylo vyšetřeno 211 pacientek s ektopickou graviditou nebo perzistentním těhotenstvím neznámé lokalizace za sledované období, z toho 63 splňovalo kritéria k terapii metotrexátem. Nakonec bylo analyzováno 56 žen, sedm pacientek bylo ze souboru vyloučeno (u dvou neprobíhalo sledování až do negativní hodnoty β-hCG, pět pacientek odmítlo pokračovat v medikamentózní terapii z časových důvodů a vyžádalo si operaci). Z tohoto souboru 48 (86 %) mělo klinicky i laboratorně potvrzenou diagnózu EP a 8 (14 %) pacientek PUL. U celkem 41 (73 %) pacientek byla terapie MTX úspěšná, hodnoty β-hCG <5 IU/l bylo dosaženo v průměru za 27 dnů. Při hodnocení pacientek s úspěšnou (skupina I) a neúspěšnou (skupina II) terapií byl shledán nesignifikantní rozdíl v iniciální hodnotě β-hCG při aplikaci první dávky MTX. Ve skupině I byl medián β-hCG 538 IU/l (100–3852 IU/l), vyšší počet nulipar a žen s již prodělanou EP v anamnéze. Ve skupině II s neúspěšnou terapií MTX byl medián β-hCG 1100 IU/l (300–3240 IU/l), více těžkých kuřaček, větší průměrná velikost hematosalpingu při vstupním transvaginálním ultrazvukovém hodnocení a vyšší zastoupení pacientek s endometriózou v anamnéze nebo s hlubokou pánevní endometriózou verifikovanou následně při laparoskopii v porovnání se skupinou s úspěšnou terapií. Ani v jednom případě nebyla peroperačně zjištěna ruptura tuby.
Závěr:
Výsledky naší studie jsou srovnatelné s publikacemi v zahraniční literatuře. Při dodržení všech podmínek pokládáme farmakologickou terapii EP nebo perzistující PUL za efektivní a relativně bezpečnou s podobnými důsledky pro fertilitu ženy jako při laparoskopické salpingektomii.
Klíčová slova:
ektopická gravidita, těhotenství neznámé lokalizace, farmakologická terapie, metotrexát
ÚVOD
Ektopická gravidita (ectopic pregnancy, EP) je výsledkem poruchy lidské reprodukční fyziologie, kdy blastocysta implantuje mimo svou eutopickou lokalizaci, kterou je sekrečně transformované endometrium v děložní dutině. Vyskytuje se téměř výhradně u člověka, proto neexistují validní animální modely k jejímu studiu. Lidský ovidukt nejspíše postrádá specifický faktor bránící ektopické nidaci jako u jiných savců [22] a ke vzniku EP přispívá také řada multifaktoriálních rizikových faktorů. Představuje častou gynekologickou diagnózu, u které se během posledních let prevalence zvýšila, ale mortalita výrazně snížila díky časné diagnostice a intervenci. V rozvojových zemích zůstává nejčastější příčinou mateřské mortality v I. trimestru těhotenství, kdy způsobuje až 10 % všech mateřských úmrtí a 6–16 % hemoragií v I. trimestru je v důsledku EP [24]. Při možnostech detekce nízkých hodnot β-hCG a vysoce senzitivní transvaginální sonografie (TVS) lze provést diagnózu EP před rupturou tuby s hemoperitoneem a rozvojem život ohrožujících komplikací [16]. Proto se v posledních dvou dekádách ve většině vyspělých zemích změnil management EP z chirurgické intervence ke konzervativnímu přístupu.
Odhaduje se, že až 1–2 % všech lidských těhotenství je ektopických [3]. V České republice byla podle Ústavu zdravotnických informací a statistiky (ÚZIS) v roce 2012 incidence 1,09 % na 100 živě narozených, z toho nejvíce ve skupině žen ve věku 35–45 let. Ze samovolně ukončených gravidit v I. trimestru bylo ve stejném roce 3,1 % mimoděložních těhotenství. Od roku 2012 je v ČR znatelný mírný sestupný trend v počtu EP, kdy bylo hlášeno 1125 případů (oproti roku 2006 s udávaným počtem 1226 případů mimoděložního těhotentsví) [29].
Rizikové faktory pro vznik EP jsou multifaktoriální, mezi statisticky významné patří prodělaný pánevní zánět (pelvic inflammatory disease, PID), chirurgické zákroky na tubách, kouření více než 10 cigaret denně, věk pacientky v době otěhotnění vyšší než 35 let, anamnéza spontánního potratu, indukovaného potratu, terapie neplodnosti [1] a nitroděložní tělísko [6]. Ženy s EP v anamnéze mají až pětkrát zvýšené riziko rekurence [20]. Dále je riziko zvýšeno po předchozí pánevní a abdominální chirurgii [27] nebo expozici diethilstilbestrolu in utero [13]. Podle recentní dánské studie anamnéza císařského řezu také zvyšuje riziko EP [25]. Pacientky s endometriózou v anamnéze mají dvakrát zvýšené riziko EP oproti ženám bez endometriózy [12].
Pro přesnou diagnózu EP zatím neexistuje specifický marker. Historicky byla zlatým standardem vizualizace při chirurgickém zákroku často prováděným pro náhlou příhodu břišní a jeho následné histologické potvrzení. S vývojem laboratorních metod a využitím možností imunoanalýzy je možno detekovat z krevního séra již velmi nízké hodnoty volné podjednotky β-hCG > 5 IU/l, jeho hodnoty jsou udávány podle standardu 75/537 WHO v mezinárodní jednotce na litr – IU/l. Elevace β-hCG v kombinaci s TVS vykazuje vysokou senzitivitu i specifitu pro stanovení diagnózy EP [16]. Proto se ruptura tuby s následným hemoperitoneem a úmrtím ženy stala v ČR vzácností. Na druhou stranu neadekvátně rostoucí titr β-hCG a nejasný UZ nález může ztížit diagnostiku časného intrauterinního těhotenství. Každá pacientka ve fertilním věku s abnormálním děložním krvácením nebo amenoreou by měla být sledována jako suspektní EP. Pokud hodnoty β-hCG přesahují 1500–2500 IU/L, měl by být při TVS přítomen viditelný gestační váček intrauterinně [21]. K jasnému průkazu nitroděložního těhotenství je nutný průkaz embryonálních struktur – žloutkového váčku nebo embrya se srdeční akcí. Diagnostické obtíže v časné graviditě mohou způsobit kolísajících hodnotyβ-hCG, kdy při TVS nevizualizujeme intrauterinní těhotenství a zároveň nejsou ani známky EP, jako přítomnost nehomogenní masy v oblasti adnex nejevící souhyb s ovariem (blob-sign), prázdný gestační váček mimoděložně s hyperechogenním lemem (bagel-sign), extrauterinní gestační váček s nebo bez žloutkového váčku a akce srdeční, dále pokud se hodnota β-hCG zvyšuje po děložní kyretáži. Tento stav nazýváme těhotenstvím neznámé lokalizace a nemělo by se jednat o definitivní diagnózu. Pokud ani při expektativním režimu nedochází k poklesu β-hCG, můžeme stanovit diagnózu perzistentního těhotenství neznámé lokalizace (persistent pregnancy of unknown location, PUL) a je vhodná terapie metotrexátem (MTX) [5]. Jako minimální hodnota zvýšení β-hCG u potenciálně viabilní intrauterinní gravidity byl stanoven nárůst o 53 % za dva dny i při současných klinických známkách bolestí v podbřišku a/nebo vaginálního krvácení [14].
MTX je metylový derivát aminopterinu, má podobnou strukturu jako kyselina listová a řadí se mezi antifoláty. Je silným inhibitorem enzymu dihydrofolátreduktázy, zabraňuje tak tvorbě purinů. Pokud jsou v buňce vysoké koncentrace MTX, dochází k depleci substrátů nutných pro syntézu a reparaci DNA, RNA i proteinů a inhibuje proliferaci rychle se dělících buněk, jako je trofoblast. Váže se z 50 % na plazmatické bílkoviny, distribuuje se do všech tkání organismu a akumuluje se v tělních tekutinách. Eliminaci z organismu zajišťují téměř výhradně ledviny. Koncentrace MTX v plazmě a jeho toxické účinky jsou dobře známé, mezi mírné nežádoucí účinky se řadí gastrointestinální symptomy, jako je nauzea, vomitus, pobolívání v podbřišku, gingivostomatitis, konjunktivitis. Závažné nežádoucí účinky se vyskytují především u onkologických pacientů s mnohonásobně vyššími dávkami a zahrnují alopecii, hematologické abnormality, elevaci jaterních transamináz, hepatitidu, osteopatii, hypersenzitivní pneumonitidu. Při léčbě MTX je kontraindikováno kojení, působí teratogenně, nesmí být použit u pacientů s onemocněním jater, ledvin, plic, ascitem nebo gastroduodenálními vředy [23]. Po aplikaci MTX se ženě nedoporučuje 3–6 měsíců otěhotnět pro prodlouženou clearance s potenciální teratogenitou [19]. MTX se kromě systémové aplikace dá využít i pomocí místní aplikace přímo do plodového vejce, zejména při lokalizaci intersticiální, cervikální, ovariální nebo graviditě v jizvě po předchozím císařském řezu, také v kombinaci s embolizací uterinní arterie [18]. Úspěšně se používá při terapii perzistentní trofoblastické nemoci a choriokarcinomu [11].
METODIKA
Do studie byly zařazeny pacientky vyšetřené na ambulanci Gynekologicko-porodnické kliniky Nemocnice Na Bulovce v období od ledna 2008 do srpna 2014 z nemocniční databáze, s diagnózou EP nebo PUL. U všech žen byla odebrána a analyzována podrobná anamnéza se zaměřením na rizikové faktory EP. Krevní obraz, krevní skupina, Rh faktor, hodnota β-hCG byly vyšetřeny při vstupním vyšetření. Pacientky podepsaly informovaný souhlas s medikamentózní terapií a s aplikací cytostatika. Souhlas obsahoval základní vysvětlení mechanismu účinku, poučení o interakcích během užívání MTX. Byly poučeny o nutnosti sledování až do negativní hodnoty β-hCG.
Specializovaným ultrasonografistou byla provedena TVS. V případě nálezu vysokého endometria na UZ byla k vyloučení neprosperující intrauterinní gravidity nejprve uskutečněna instrumentální revize dutiny děložní se statimovým histopatologickým zpracováním materiálu.
Kritéria pro parenterální podání MTX byla: hemodynamicky stabilní pacientka ve věku více než 18 let s podepsaným informovaným souhlasem, bez viditelného gestačního váčku intrauterinně, s kolísajícími hodnotami β-hCG maximálně do 5000 IU/l, anebo přítomností hematosalpingu. Kontraindikací k podání MTX byl nesouhlas pacientky s terapií, hemodynamická nestabilita, hemoragický šok, přítomnost masivního hemoperitonea, známky peritoneálního dráždění, aktivně probíhající jaterní, renální, hematologické nebo plicní onemocnění, možná „non-compliance“ pacientky, cizinky nehovořící česky, přítomnost viabilní extrauterinní gravidity, jako přítomnost žloutkového váčku nebo akce srdeční embrya při TVS. Při splnění všech indikačních podmínek byl aplikován MTX v dávce 1 mg/ kg intramuskulárně (i. m.). Při Rh negativitě pacientky byl aplikován imunoglobulin anti-D i. m. Hodnoty β-hCG byly vyšetřovány à 48 hodin, při jednoznačně klesající tendenci později v 7 denních intervalech do negativity. Pokud nebyl pokles dostatečný (o 15 % mezi 4. a 6. dnem od aplikace MTX) nebo pacientka udávala subjektivní obtíže, bylo opět provedeno gynekologické vyšetření včetně TVS a posouzen další postup, eventuálně aplikována 2. dávka MTX. Při neadekvátně klesající hodnotě β-hCG, subjektivním nebo objektivním zhoršení stavu, podezření na rupturu tuby a přítomnost hemoperitonea nebo přání pacientky odstoupit od další aplikace MTX byla indikována laparoskopie.
VÝSLEDKY
V období od ledna 2008 do srpna 2014 bylo na naší klinice evidováno 211 pacientek s diagnózou EP nebo PUL. Celkem 169 pacientek podstoupilo chirurgický zákrok, z nich 162 podstoupilo salpingektomii laparoskopicky, dvě pacientky laparotomicky pro masivní hemoperitoneum s rozvojem šokového stavu. U pěti pacientek byl proveden konzervativní chirurgický zákrok na tubě – lineární laparoskopická salpingotomie s následnou aplikací MTX k prevenci perzistujícího trofoblastu, které byly sledovány až do negativní hodnoty β-hCG. U dvou žen s intersticiální graviditou byl po laparoskopické operaci taktéž úspěšně aplikován MTX.
Náš soubor zahrnuje celkem 63 pacientek, které splňovaly kritéria k medikamentózní terapii. Sedm pacientek bylo ze souboru vyloučeno, protože u dvou z nich neprobíhalo sledování až do negativní hodnoty β-hCG a pět pacientek odmítlo pokračovat v medikamentózní terapii a z časových důvodů si vyžádaly operaci. Z 56 pacientek bylo 22 (40 %) odesláno ambulantním specialistou pro suspektní EP, 21 (38 %) vyšetřeno pro metroragii, 7 (12 %) udávalo bolesti břicha, šest (11 %) s diagnózou spontánního abortu, v tomto případě byla diagnóza stanovena na základě histologického vyšetření obsahu dutiny děložní bez nálezu choriových klků a stagnujích hodnot β-hCG. Z celkem 56 žen léčených MTX mělo 48 (86 %) klinicky i laboratorně potvrzenou diagnózu EP a osm (14 %) pacientek PUL. Za úspěšnost terapie jsme považovali pokles hodnoty β-hCG < 5 IU/L nezávisle na počtu podaných dávek MTX. U celkem 41 (73 %) pacientek byla terapie MTX úspěšná s poklesem β-hCG do negativity. Hodnoty β-hCG < 5 IU/L bylo dosaženo v průměru za 27 dnů od aplikace první dávky MTX. Při hodnocení pacientek s úspěšnou (skupina I) a neúspěšnou (skupina II) terapií nebyly ve sledovaných parametrech shledány signifikantní rozdíly ve věku a výskytu některých rizikových faktorů (tab. 4). Rozdíl byl shledán v iniciální hodnotě β-hCG před aplikací první dávky MTX, kdy ve skupině I byl mediánβ-hCG 538 (100–3652 IU/L), ve II skupině byl medián β-hCG 1100 (300–3240 IU/L). Ve skupině I bylo 60 % nulipar oproti skupině II se 47 %, také bylo více pacientek s již prodělanou EP v anamnéze oproti skupině II. Ve skupině s neúspěšnou terapií MTX bylo více kuřaček a pacientek s endometriózou v anamnéze nebo s hlubokou pánevní endometriózou verifikovanou následně při laparoskopii. Také při vstupním ultrazvukovém vyšetření byla naměřena větší průměrná velikost hematosalpingu. Výskyt mírných nežádoucích účinků mělo celkem sedm pacientek léčených farmakologicky, z toho jedna (5 %) pacientka měla následně po ukončení terapie gingivostomatitidu, jedna (5 %) pacientka byla sledována a léčena na oftalmologii pro konjunktivitidu a pět (12 %) pacientek udávalo při terapii nauzeu. Se závažnými nežádoucími účinky jsme se v našem souboru nesetkali.
Peroperační nález u pacientek se selháním MTX terapie ukazuje tabulka 2 a management pacientek s úspěšnou terapií MTX obsahuje tabulka 3.
DISKUSE
V našem souboru byla 73% úspěšnost terapie EP a PUL pomocí MTX, což je srovnatelné s výsledky nedávné holandské studie, která dosáhla 76 % [30]. Některé zahraniční práce ale uvádějí podstatně vyšší podíl úspěšných medikamentózně řešených EP až v 87 % [4], což může být výsledkem dlouhodobého používání, zkušeností s terapií MTX a důrazem na poměr náklady-výsledek metody. V České republice se s medikamentózní terapií setkáváme zatím spíše ojediněle.
Diagnóza EP pro ženu znamená stav ohrožující její budoucí fertilitu a vzácně i život. Tubární mimoděložní těhotenství lze řešit expektativně, medikamentózně, konzervativním chirurgickým výkonem (salpingotomie/salpingostomie) nebo odstraněním postiženého vejcovodu (salpingektomie). Od roku 1982, kdy Tanaka referoval o úspěšném použití MTX při terapii intersticiální gravidity, se tato modalita terapie stala celosvětově uznávanou [28]. K použití parenterálního MTX bylo navrženo několik protokolů, které se většinou shodují velikostí dávky (50 mg/m2 i.m. nebo 1 mg/kg i. m.) [4]. Zkoušela se i jiná chemoterapeutika nebo abortiva, MTX však vykazuje nejvyšší úspěšnost a významnou roli hraje také jeho nízká cena. Finanční náklady (tzv. cost effectiveness ) jsou při použití MTX v porovnání s laparoskopií nebo laparotomií výrazně nižší [31, 17]. Další zdravotní a socioekonomické výhody tohoto postupu jsou eliminace operačního řešení a s ním spojených rizik při celkové anestezii.
Na naší klinice jsme poprvé preparát použili v roce 2008 u perzistentní PUL s kolísajícími hodnotami β-hCG, kdy ani při diagnostické laparoskopii nebylo nalezeno plodové vejce. Při kolísajících nízkých hodnotách β-hCG musíme před podáním MTX vždy vyloučit počínající intrauterinní těhotenství. V literatuře byl popsán případ, kdy po podání pacientce s intrauterinní graviditou byl plod postižen metotrexátovou embryopatií [2]. Interakce MTX s jinými léčivy jsou rovněž dobře známé: nesmí se užívat alkohol, nesteroidní antirevmatika, acylpyrin, kotrimoxazol, sulfazalasin, trimetoprim, je nutné vysadit substituci kyselinou listovou a vitaminové suplementy, které ji mohou obsahovat, nevystavovat se slunci. Literatura udává závažné alergické reakce na MTX, pneumonitidy, podání ženě s onemocněním ledvin, které vedlo k jejímu úmrtí [15].
Před doporučením nebo podáním MTX musíme pečlivě uvážit okolnosti, za nichž bude terapie úspěšná a iatrogenně neohrozí pacientku. Všichni lékaři indikující terapii MTX by měli znát jeho základní mechanismus účinku, fakta o distribuci a eliminaci k minimalizování jeho nežádoucích účinků. Po aplikaci MTX dochází k tzv. resolution pain, které se projevuje bolestmi v podbřišku při vstřebávání EP. Některé studie se zabývají faktory, které mohou předvídat selhání terapie a hrozící rupturu tuby. Riziko ruptury tuby při terapii MTX se odhaduje na 7–14 %. Mezi rizikové faktory neúspěchu medikamentózní terapie se řadí zvýšení koncentrace β-hCG o nejméně 66 % během 48 hodin před podáním MTX a perzistující nárůst hodnoty β-hCG po aplikaci MTX. Podání by mělo být kontraindikováno u pacientek s viditelnou akcí srdeční plodu nebo žloutkovým váčkem v adnextumoru při TVS [7]. Kontraindikace k podání MTX viz v tabulce 4.
![Kontraindikace terapie MTX
Practice Commitee. Medical treatment of ectopic pregnancy. Fertil Steril 2013 [14]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/f595b7860da7a9dcc8f970534f74aadf.png)
Naopak při TVS nálezu adnexální masy nebo přítomnosti malého množství tekutiny v cavum Douglasi není podání MTX kontraindikováno. V izraelské studii bylo zjištěno, že v prvním týdnu po podání MTX se objem sledovaného adnextumoru ve více než polovině případů signifikantně zvětší, u 71 % je pozorována volná tekutina v Douglasově prostoru. Tento nález však neznamenal snížení úspěchu terapie MTX [9]. Pro konzervativní terapii EP byly navrženy různé postupy, včetně možnosti expektace. Podle recentní holandské randomizované multicentrické studie u pacientek s viditelnou adnexální masou nebo při přítomnosti volné tekutiny v peritoneální dutině a při hodnotách β-hCG < 1500 IU/l nebo u perzistentní PUL s kolísající hodnotou β-hCG < 2000 IU/l byla úspěšnost expektativního přístupu 60 %, u pacientek léčených MTX 76 %. Autoři proto doporučují pečlivé zvážení nutnosti podání MTX [30]. The Royal College Of Obstetricians and Gynaecologists doporučuje aktivní intervenci, pokud hodnota β-hCG převýší 1000 IU/l.
Fertilita po farmakologické terapii EP byla ve srovnání s úspěšností otěhotnět po konzervativní chirurgické terapii (salpingektomií a salpingostomií) sledována v recentní multicentrické randomizované studii DEMETER. Nebyl prokázán signifikantní rozdíl mezi jednotlivými léčebnými přístupy. Během dvouletého sledování bylo intrauterinní gravidity dosaženo u 70 % párů po konzervativní chirurgii a u 68 % párů po radikální chirurgii, 67 % párů otěhotnělo po medikamentózní terapii [8]. Navíc nebyl prokázán negativní vliv medikamentózní terapie MTX na celkový počet antrálních folikulů (ovariální rezervu) a následná fertilita nebyla zásadně ovlivněna [26]. Rozhodující byla úspěšnost otěhotnění již před manifestací EP, a ne až po chirurgické inspekci dutiny břišní.
S pokrokem v laboratorní a ultrazvukové diagnostice EP došlo také ke změně jejího managementu. U terapeutické rozvahy je vždy nutné individuálně zvážit budoucí reprodukční požadavky ženy a nabídnout postup, který má nejméně rizik [10, 20]. Cílem všech vyšetření během diagnózy raného těhotenství by mělo být vyloučení nebo potvrzení EP a zvážení možnosti použití konzervativní terapie. Vzhledem k různým možnostem terapie EP postupujeme podle symptomatického stavu, přání budoucí fertility a musíme pečlivě zvážit přínos a rizika medikamentózní terapie. Nezanedbatelnou výhodou jsou i nižší ekonomické náklady. MTX se v ČR používá v této indikaci teprve v posledních letech a jedná se převážně o ojedinělá kazuistická sdělení.
ZÁVĚR
Výsledky naší studie jsou srovnatelné s publikacemi v zahraniční literatuře. Při dodržení všech podmínek pokládáme farmakologickou terapii EP nebo perzistující PUL za efektivní a relativně bezpečnou s podobnými důsledky pro fertilitu ženy jako při laparoskopické salpingektomii.
MUDr. Jana Racková
Gynekologicko-porodnická klinika
Nemocnice Na Bulovce
Budínova 67/2
180 81 Praha 8
e-mail: jana.syko@gmail.com
Zdroje
1. Abusheikha, N., Salha, O., Brinsden, P. Extra-uterine pregnancy following assisted conception treatment. Hum Reprod Update, 2000, 6(1), p. 80–92.
2. Adam, MP., Manning, MA., Beck, AE., et al. Methotrexate/misoprostol embryopathy: report of four cases resulting from failed medical abortion. Am J Med Genet A, 2003, 123A(1), p. 72–78.
3. Barnhart, K. Clinical practice. Ectopic pregnancy. N Engl J Med, 2009, 361(4), p. 379–387.
4. Barnhart, K., Hummel, AC., Sammel, MD., et al. Use of „2-dose“ regimen of methotrexate to treat ectopic pregnancy. Fertil Steril, 2007, 87(2), p. 250–256.
5. Barnhart, K., van Mello, NM., Bourne, T., et al. Pregnancy of unknown location: a consensus statement of nomenclature, definitions, and outcome. Fertil Steril, 2011, 95(3), p. 857–866.
6. Bouyer, J. [Epidemiology of ectopic pregnancy: incidence, risk factors and outcomes]. J Gynecol Obstet Biol Reprod (Paris), 2003, 32(7), Suppl, p. S8–S17.
7. Dudley, PS., Heard, MJ., Sangi-haghpeykar, H., et al. Characterizing ectopic pregnancies that rupture despite treatment with methotrexate. Fertil Steril, 2004, 82(5), p. 1374–1378.
8. Fernandez, H., Capmas, P., Lucot, JP., et al. Fertility after ectopic pregnancy: the DEMETER randomized trial. Hum Reprod, 2013, 28(5), p. 1247–1253.
9. Gamzu, R., Almog, B., Levin, Y., et al. The ultrasonographic appearance of tubal pregnancy in patients treated with methotrexate. Hum Reprod, 2002, 17(10), p. 2585–2587.
10. Gervaise, A., Masson, L., de Tayrac, R., et al.. Reproductive outcome after methotrexate treatment of tubal pregnancies. Fertil Steril, 2004, 82(2), p. 304–308.
11. Gilani, MM., Fariba, B., Behtash, N., et al. The WHO score predicts treatment outcome in low risk gestational trophoblastic neoplasia patients treated with weekly intramuscular methotrexate. J Cancer Res Ther, 2013, 9(1), p. 38–43.
12. Hjordt Hansen, MV., Dalsgaard, T., Hartwell, D., et al. Reproductive prognosis in endometriosis. A national cohort study. Acta Obstet Gynecol Scand, 2014, 93(5), p. 483–489.
13. Hoover, RN., Hyer, M., Pfeiffer, RM., et al. Adverse health outcomes in women exposed in utero to diethylstilbestrol. N Engl J Med, 2011, 365(14), p. 1304–1314.
14. Chung, K., Sammel, MD., Coutifaris, C., et al. Defining the rise of serum HCG in viable pregnancies achieved through use of IVF. Hum Reprod, 2006, 21(3), p. 823–828.
15. Kelly, H., Harvey, D., Moll, S. A cautionary tale: fatal outcome of methotrexate therapy given for management of ectopic pregnancy. Obstet Gynecol, 2006, 107(2 Pt 2), p. 439–441.
16. Kirk, E., Papageorghiou, AT., Condous, G., et al. The diagnostic effectiveness of an initial transvaginal scan in detecting ectopic pregnancy. Hum Reprod, 2007, 22(11), p. 2824–2828.
17. Lecuru, F., Robin, F., Chasset, S., et al. Direct cost of single dose methotrexate for unruptured ectopic pregnancy. Prospective comparison with laparoscopy. Eur J Obstet Gynecol Reprod Biol, 2000, 88(1), p. 1–6.
18. Lian, F., Wang, Y., Chen, W., et al. Uterine artery embolization combined with local methotrexate and systemic methotrexate for treatment of caesarean scar pregnancy with different ultrasonographic pattern. Cardiovasc Intervent Radiol, 2012, 35(2), p. 286–291.
19. Lloyd, ME., Carr, M., Mcelhatton, P., et al. The effects of methotrexate on pregnancy, fertility and lactation. QJM, 1999, 92(10), p. 551–563.
20. Lund Kårhus, L., Egerup, P., Wessel Skovlund, C., Lidegaard, O. Long-term reproductive outcomes in women whose first pregnancy is ectopic: a national controlled follow-up study. Hum Reprod, 2013, 28(1), p. 241–246.
21. Medical treatment of ectopic pregnancy: a committee opinion. Fertil Steril, 2013, 100(3), p. 638–644.
22. Moore, GD., Eddy, CA., Pauerstein, CJ. Rabbit endosalpinx inhibits implantation in vitro. Fertil Steril, 1992, 57(4), p. 902–907.
23. Murakami, T., Mori, N. Involvement of multiple transporters-mediated transports in mizoribine and methotrexate pharmacokinetics. Pharmaceuticals (Basel), 2012, 5(8), p. 802–836.
24. Murray, Hm, Baakdah, H., Bardell, T., Tulandi, T. Diagnosis and treatment of ectopic pregnancy. CMAJ, 2005, 173(8), p. 905–912.
25. O‘Neill, SM., Agerbo, E., Kenny, LC., et al. Cesarean section and rate of subsequent stillbirth, miscarriage, and ectopic pregnancy: a Danish register-based cohort study. PLoS Med, 2014, 11(7), p. 1001670.
26. Oriol, B., Barrio, A., Pacheco, A., et al. Systemic methotrexate to treat ectopic pregnancy does not affect ovarian reserve. Fertil Steril, 2008, 90(5), p. 1579–1582.
27. Parashi, S., Moukhah, S., Ashrafi, M. Main risk factors for ectopic pregnancy: a case-control study in a sample of Iranian women. Int J Fertil Steril, 2014, 8(2), p. 147–154.
28. Tanaka, T., Hayashi, H., Kutsuzawa, T., et al. Treatment of interstitial ectopic pregnancy with methotrexate: report of a successful case. Fertil Steril, 1982, 37(6), p. 851–852.
29. ÚZIS. http://www.uzis.cz/katalog/zdravotnicka-statistika/potraty
30. van Mello, NM., Mol, F., Verhoeve, HR., et al. Methotrexate or expectant management in women with an ectopic pregnancy or pregnancy of unknown location and low serum hCG concentrations? A randomized comparison. Hum Reprod, 2013, 28(1), p. 60–67.
31. Yao, M., Tulandi, T., Kaplow, M., Smith, AP. A comparison of methotrexate versus laparoscopic surgery for the treatment of ectopic pregnancy: a cost analysis. Hum Reprod, 1996, 11(12), p. 2762–2766.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2016 Číslo 2
-
Všechny články tohoto čísla
- Indukce porodu
- Současné možnosti a doporučení pro intrapartální monitorování ozev plodu
- Porod velkého plodu
- Operační vaginální porod
- Mezioborový doporučený postup – diagnostika a léčba sepse v souvislosti s těhotenstvím
- Použití metotrexátu u ektopické gravidity a těhotenství neznámé lokalizace
- Diagnostika komplexu tuberózní sklerózy se zaměřením na prenatální období
- Česká nemocnice v Ugandě a kvalita porodnické péče
-
Informace o knize
Imunologie a imunopatologie lidské reprodukce (vybrané kapitoly) - Editorial
- POTERMÍNOVÉ TĚHOTENSTVÍ
- PREINDUKCE A INDUKCE PORODU
- INTERPRETACE INTRAPARTÁLNÍHO FETÁLNÍHO KARDIOTOKOGRAMU – FIGO 2015
- POROD VELKÉHO PLODU
- OPERAČNÍ VAGINÁLNÍ POROD
- DIAGNOSTIKA A LÉČBA SEPSE V SOUVISLOSTI S TĚHOTENSTVÍM
- Potermínové těhotenství
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Současné možnosti a doporučení pro intrapartální monitorování ozev plodu
- Indukce porodu
- Potermínové těhotenství
- Porod velkého plodu
