Kryokonzervace ovariální tkáně u onkologických pacientek – 6 let klinických zkušeností
Ovarian tissue cryopreservation in cancer patients – six years of clinical experience
Objective:
Presentation of clinical results and experience with this technique during past six years.
Design:
Original paper.
Settings:
Gynekologicko-porodnická klinika LF MU a FN Brno, Interní hemato-onkologická klinika LF MU a FN Brno, Department of Obstetrics and Gynecology. Hadassah University Hospital Ein-Karem, Jerusalem, Izrael.
Introduction:
Ovarian tissue cryopreservation (OTC) and its future auto-transplantation becomes an alternative for patients to prevent serious damage of ovarian function by oncology treatment.
Methods:
Patient is indicated to OTC in case of high risk of ovarian failure due to planned chemotherapy and impossibility to use other oncofertility techniques. Ovarian tissue harvesting is done by laparoscopy in short-term general anesthesia. After tissue processing the samples are cryopreserved in programmable automatic freezer or by vitrification. The auto-transplantation of ovarian tissue is planned after the complete cure of patient’s malignancy. Our workplace doesn’t have own experience with tissue transplantation – until now cryopreserved tissue has not yet been utilized by the patients. Clinical experience with this technique gained by our team during academic stay in abroad Israeli clinic is presented.
Results:
During the years of 2005–2011 the OTC was performed in 19 cancer patients before chemotherapy. In majority of cases, patients suffered from blood or lymph node systemic malignancy (84%). Average age of women was 26 years. The patient set consisted of mostly nulliparous women (88%). Patient’s average body mass index was 23,9 kg/m2. The length of systemic chemotherapy averaged 7.1 months. Time from fertility preservation counseling to chemotherapy was not exceeding one week (7.2 days on average). Ovarian tissue harvesting was conducted by laparoscopic surgery in all cases. The length of surgery did not exceed 60 minutes and no surgical complications were observed. The case of ovarian tissue transplantation performed on abroad university settings is discussed.
Conclusion:
In the consensus of with international guidelines OTC is offered to patients with high risk of ovarian failure doe to cytotoxic oncology treatment. Research in the field of oncofertility is focused on the techniques of in-vitro folliculogenesis in retrieved ovarian tissue.
Key words:
cancer, infertility, fertility preservation, ovarian tissue cryopreservation, oncofertility.
Autoři:
Martin Huser 1
; J. Žáková 1; I. Crha 1
; L. Šmardová 2; Z. Král 2; A. Revel 3; P. Ventruba 1
Působiště autorů:
Gynekologicko-porodnická klinika LF MU a Fakultní nemocnice Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA
1; Interní hemato-onkologická klinika LF MU a Fakultní nemocnice Brno, přednosta prof. MUDr. J. Mayer, CSc.
2; Department of Obstetrics and Gynecology, Hadassah University Hospital Ein-Karem, Jerusalem, Izrael, Head prof. N. Laufer
3
Vyšlo v časopise:
Ceska Gynekol 2012; 77(2): 118-126
Kategorie:
Původní práce
Souhrn
Cíl studie:
Prezentace výsledků kryokonzervace ovariální tkáně u pacientek podstupujících onkologickou léčbu.
Typ studie:
Původní práce.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF MU a FN Brno, Interní hemato--onkologická klinika LF MU a FN Brno, Department of Obstetrics and Gynecology. Hadassah University Hospital Ein-Karem, Jerusalem, Izrael.
Úvod:
Jednou z možností prevence poškození ovaria onkologickou léčbou je kryokonzervace ovariální tkáně (KOT) s možností její autotransplantace po vyléčení nádorového onemocnění. Cílem této práce je prezentace klinických zkušeností s touto technikou za šestileté období na univerzitním pracovišti v rámci Centra ochrany reprodukce.
Metodika:
V případě vysokého rizika ovariálního selhání v důsledku plánované onkologické léčby a nemožnosti využití jiných technik reprodukční ochrany je pacientka indikována ke KOT. Odběr ovariální tkáně se provádí laparoskopicky za krátkodobé hospitalizace. Po zpracování vzorku je vlastní kryokonzervace realizována s použitím programovatelného mrazicího zařízení nebo pomocí vitrifikace. K autotransplantaci ovariální tkáně přistupujeme v období po vyléčení zhoubného nádoru. Na vlastním pracovišti nemáme dosud vlastní zkušenosti s transplantací ovariální tkáně. Dosud kryokonzervovaná ovariální tkáň zatím nebyla k transplantaci použita. Jsou popsány klinické zkušenosti autora s touto technikou během akademické stáže na zahraničním pracovišti v Izraeli.
Výsledky:
V období leden 2005 – leden 2011 byla provedena KOT u 19 pacientek před onkologickou léčbou. Ve většině případů (84 %) šlo o pacientky s hematologickými malignitami. Průměrný věk pacientek byl 26 let. V souboru dominovaly nulipary (88 %). Průměrný věk pacientek byl 26,7 let. Průměrný index tělesné hmotnosti (BMI) pacientek ve sledovaném souboru byl 23,9 kg/m2. Délka systémové léčby činila průměrně 7,1 měsíců. Průměrný čas do zahájení chemoterapie nepřesahoval jeden týden (průměr 7,2 dnů). Odběr ovariální tkáně byl prováděn ve všech případech laparoskopickou metodou. Délka operačního výkonu nepřesáhla dobu 60 minut. Nebyly zaznamenány žádné významné operační komplikace. Autoři dokumentují případ autotransplantace kryokonzervované ovariální tkáně uskutečněný na zahraničním univerzitním pracovišti.
Závěr:
Ve shodě s mezinárodními doporučeními je KOT nabízena pacientkám s významným rizikem ovariálního poškození v důsledku chemoterapie. Výzkum v oblasti onkofertility se zaměřuje na možnosti zajištění folikulogeneze v odebrané ovariální tkáni v prostředí in vitro.
Klíčová slova:
nádorové onemocnění, neplodnost, ochrana reprodukce, kryokonzervace ovariální tkáně, onkofertilita.
ÚVOD
Souvislost mezi poškozením reprodukčních funkcí a onkologickou léčbou je známa již několik desetiletí. S narůstající úspěšností onkologické léčby roste význam těchto negativních dopadů na fertilitu ženy. Trvalá ztráta reprodukčního potenciálu patří mezi nejčastější nežádoucí účinky onkologické léčby. Jednou z možností prevence poškození ovaria onkologickou léčbou je kryokonzervace ovariální tkáně (KOT) s možností její autotransplantace po vyléčení nádorového onemocnění [14]. Hlavním cílem této strategie je zachovat tkáň ovariálního kortexu obsahující primordiální folikuly k autotransplantaci v době, kdy bude pacientka trvale vyléčena z onkologického onemocnění [6, 8,19]. V literatuře byla popsána úspěšná autotransplatace ovariálně tkáně zatím u několika desítek pacientů na světě [2, 7, 9, 24]. První porod zdravého dítěte po transplantaci zamražené ovariální tkáně popsal Belgičan Donnez v roce 2004 u 25leté ženy dříve léčené chemoradioterapií pro Hodgkinův lymfom v pokročilém IV. stadiu [8].
První pokusy o kryokonzervaci a transplantaci ovariální tkáně se datují do roku 1950. Bohužel pro nedostatek účinných kryokonzervačních metod a technického vybavení byly jejich výsledky nevalné a málo povzbudivé. S rozvojem kryobiologie v 90. letech minulého století přichází rozvoj této metody také v humánní medicíně. Na rozdíl od kryokonzervace embryí či oocytů je ovariální tkáň daleko komplexnější a obsahuje více druhů buněk – stromální buňky, folikulární buňky a oocyty. Standardní metodou kryokonzervace ovariální tkáně je technika pomalého mražení v médiu obsahujícím lidský sérový albumin a sucrósu s využitím propandiolu, dimethylsulphoxidu či ethylenglykolu jako kryoprotektantů [12]. Využití těchto kryokonzervačních technik vede k přežití až 70 % všech primordiálních folikulů v zamrazovaném vzorku ovariální tkáně [20].
Ovariální tkáň obsahující gamety může být zpracována několika způsoby. Největší klinické zkušenosti existují s kryokonzervací fragmentů (proužků) ovariálního kortexu. Jsou také popsány klinické zkušenosti s odběrem a kryokonzervací celého ovaria s vaskulární stopkou. Autotransplantaci celého lidského ovaria s mikroanastomózou v roce 2004 úspěšně realizoval Martinez-Madrid. Problémem této metody u větších savců je nedostatečná difuze kryoprotektantu do celého orgánu a poškození kapilár ledovými krystaly. Dalším technickým úskalím je vysoké riziko trombózy v reanastomozovaném vaskulárním pelikulu [15]. Jinou možnou strategii zpracování ovariální tkáně představuje izolace primordiálních folikulů obsahujících oocyty a jejich kryokonzervace samostatně bez doprovodných ovariálních buněk. Primordiální folikuly (PMF) jsou velmi rezistentní k poškození nízkými teplotami – mají energeticky nenáročný metabolismus, malou velikost (30–40 mikrometrů) a absenci cytoskeletu.
U pacientek s předčasným ovariálním selháním v důsledku onkologické léčby, může být kryokonzervovaná ovariální tkáň využita buď k transplantaci zpět do těla pacientky, nebo může sloužit k in vitro maturaci PMF s cílem získat haploidní oocyt schopný fertilizace pomocí běžných metod asistované reprodukce. Ortotopickou transplantací označujeme vložení ovariální tkáně zpět do funkčně inaktivního ovaria či jeho bezprostředního okolí v malé pánvi. Heterotopická transplantace znamená umístění štěpu do jiné, většinou lépe přístupné oblasti těla ženy. V případě ortotopické transplantace je teoreticky možné dosažení gravidity spontánní koncepcí za předpokladu nepoškozených vejcovodů a dělohy. V ostatních případech je možné dosáhnout těhotenství pouze pomocí ovariální stimulace a cyklu in vitro fertilizace (IVF). K minimalizaci rizika rekurence nádorového onemocnění se jako efektivnější jeví technika in vitro kultivace PMF izolovaných z ovariální tkáně. Již dnes je technicky možné in vitro kultivovat lidské PMF až do stadia folikulogeneze, které je pro fertilizaci dostatečné. Je pravděpodobně jen otázkou času, kdy takto vzniklý oocyt bude použit k oplodnění a k narození zdravého dítěte [26]. Zajímavá je také myšlenka využití laboratorních zvířat jako inkubačních médií k dlouhodobému uchovávání a také maturaci lidské ovariální tkáně. Imunodeficientní myši jsou nejčastěji využívány jako recipientní organismy při xenotransplantaci lidské ovariální tkáně. Nejlepší výsledky byly popsány při transplantaci lidské ovariální tkáně do peritoneální dutiny a kapsuly myší ledviny. Po transplantaci byly pomocí ovariální stimulace myší získány maturované (MII) lidské ovocyty [10, 11].
MATERIÁL A METODY
Centrum ochrany reprodukce (COR) na Gynekologicko porodnické klinice LF MU a FN Brno nabízí podpůrnou léčbu zaměřenou na zachování reprodukčního potenciálu u pacientů s nově diagnostickým onkologickým či imunologickým onemocněním. Během konzultace je provedeno zhodnocení rizika ovariálního poškození či selhání v důsledku plánované onkologické léčby a pacientce je navržena optimální strategie reprodukční ochrany. Pacientce je popsán podrobně celý postup podpůrné léčby. Při rozhovoru je vhodná také přítomnost partnera či manžela pacientky. Velmi důležitý je zejména čas, který zbývá do zahájení onkologické léčby, či možnost odsunutí začátku léčby.
Metoda kryokonzervace ovariální tkáně byla implementována na našem pracovišti na podkladě dříve publikovaných prací a zkušeností jiných autorů [1, 8, 16, 19]. Před realizací je vyžadován podpis písemného informovaného souhlasu schváleného etickou komisí Fakultní nemocnice Brno. V souladu s evropskou direktivou 2004/23/EC o skladování orgánů a tkání je dále u pacienta nutný odběr krve k vyloučení sexuálně přenosných nemocí pomocí následujících sérologických vyšetření – HIV 1, HIV 2, HBsAg, anti-HBc, anti-HCV.
Odběr ovariální tkáně se provádí laparoskopicky za krátkodobé hospitalizace pacientky. Před operací je vyžadováno standardní předoperační vyšetření. Vlastní operační výkon se provádí v celkové anestezii. Při operaci zavádíme do dutiny břišní transumbilikálně kamerový systém a do oblasti podbřišku další dva až tři operační porty. Množství ovariální tkáně odebírané pro účely kryokonzervace je předem dohodnuto s pacientkou. Na našem pracovišti odebíráme nejčastěji vzorek ovariální kůry z obou ovarií o rozměrech asi 10 x 20 mm a tloušťce 1–2 mm. V případě velkého rizika trvalého ovariálního selhání navrhujeme pacientce odběr celého jednoho vaječníku, tedy unilaterální ovarektomii. K odběru tkáně ovariálního kortexu používáme nůžky a grasper (obr. 1). Tkáň extrahujeme opatrně laparoskopickým portem a ukládáme do kryokonzervačního média G-Fert (Vitrolife). Vzorek ovariální tkáně určený ke kryokonzervaci je transportován do embryologické laboratoře ve speciálním boxu, který udržuje tělní teplotu. Během operace dále provádíme náhodnou (random) biopsii ze tří míst na obou ovariích k vyloučení infiltrace ovarií maligními buňkami základního nádorového nemocnění.
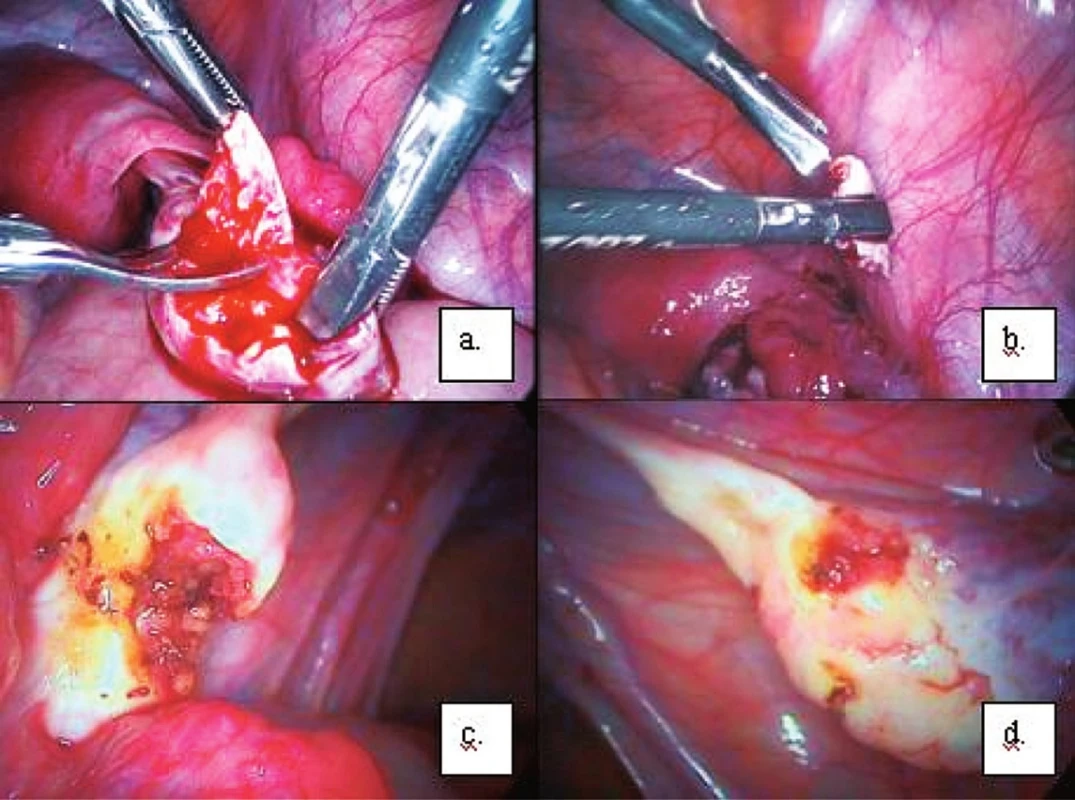
V laminárním boxu embryologické laboratoře je získaná ovariální tkáň vyjmuta z transportní komůrky na Petriho misku a přelita stejným kryokonzervačním médiem. V ovariálním kortexu pátráme po rostoucích folikulech o průměru asi 2–5 mm, které odsáváme pomocí jehly a injekční stříkačky. Folikuly mohou obsahovat oocyty, které je možné využít rovněž ke kryokonzervaci, pokud s tímto postupem pacientka při vstupním pohovoru vyjádřila souhlas. Získané vzorky ovariálního kortexu jsou poté skalpelem podélně rozřezány na úzké pásky o velikosti přibližně 5 x 1 mm a o tloušťce 1–2 mm. V případě odběru celého ovaria je nutné nejdříve oddělit ovariální kortex od stromatu vaječníku. Oddělení je poměrně jednoduché, provádíme jej většinou tupě, digitálně, popřípadě ostře, pomocí nůžek. Ovariální stroma se ke kryokonzervaci nevyužívá, protože neobsahuje primordiální folikuly. Tkáň stromatu je odeslána na patologicko-anatomické vyšetření, abychom vyloučili infiltraci stromatu ovaria nádorovým onemocněním.
Vlastní kryokonzervaci zpracované ovariální tkáně provádíme dvěma metodami – technikou pomalého zmrazování za použití automatického mrazicího zařízení, nebo metodou vitrifikace. Po inkubaci v kryokonzervačním médiu EFS2 Freezing Kit (Vitrolife) vkládáme proužky ovariální tkáně do kryotub (Nunc) po 4–6 kusech. Kryotuby jsou pečlivě označeny a zamraženy pomocí kryokonzervačního přístroje Planer Kryo 10. K vitrifikaci používáme komerční vitrifikační kity Rapid Vit Cleave (Vitrolife, Švédsko) nebo Vitrification Cooling (MediCult, Dánsko). Vždy postupujeme podle instrukcí výrobce příslušného vitrifikačního kitu. Během procedury nepoužíváme žádné kryokonzervační zařízení, kryotuby s proužky ovariální tkáně jsou ponořeny přímo do tekutého dusíku.
K transplantaci ovariální tkáně přistupujeme po domluvě s pacientkou a se svolením klinického onkologa, který ji dispenzarizuje v období po léčbě zhoubného nádoru. Nezbytnou podmínkou k provedení tohoto postupu je kompletní remise dříve léčeného nádorového onemocnění a dobrý zdravotní stav pacientky. Na našem pracovišti nemáme dosud vlastní zkušenosti s transplantací ovariální tkáně. Kryokonzervovaná ovariální tkáň všech našich pacientek zatím nebyla k transplantaci použita. Níže popsaný postup ortotopické transplantace a sledování transplantátu byl uskutečněn týmem dr. Ariela Revela během pobytu autora článku na akademické stáži v Hadassah Medical Center v Jeruzalemě na jaře roku 2009.
K rozmrazení ovariální tkáně se používají komerční sety, např. ThawKit (Vitrolife). Celý proces je potřeba synchronizovat s operací pacientky tak, aby ovariální tkáň byla transplantována do malé pánve co nejdříve po dokončení rozmrazování. Vlastní transplantace byla v Hadassah Medical Center provedena laparotomicky z malého Pfannenstielova řezu do oblasti v ligamentum latum uteri pod ovariem. Cílovou oblast je vhodné lépe vizualizovat tamponádou Douglasova prostoru rouškami. Proužky ovariální tkáně byly vloženy do předem připravené peritoneální duplikatury v ligamentum latum uteri a také přímo do hormonálně inaktivního ovaria. Byly vytvořeny dvě peritoneální kapsy v levém i pravém širokém vazu. Do každé z nich bylo vloženo 3–6 proužků ovariální tkáně. Zbylé proužky byly transplantovány přímo do ponechaného ovaria do hloubky 2–3 milimetrů v ovariálním kortexu. Umístění vzorků a techniku transplantace blíže ozřejmuje fotodokumentace (obr. 2, 3).
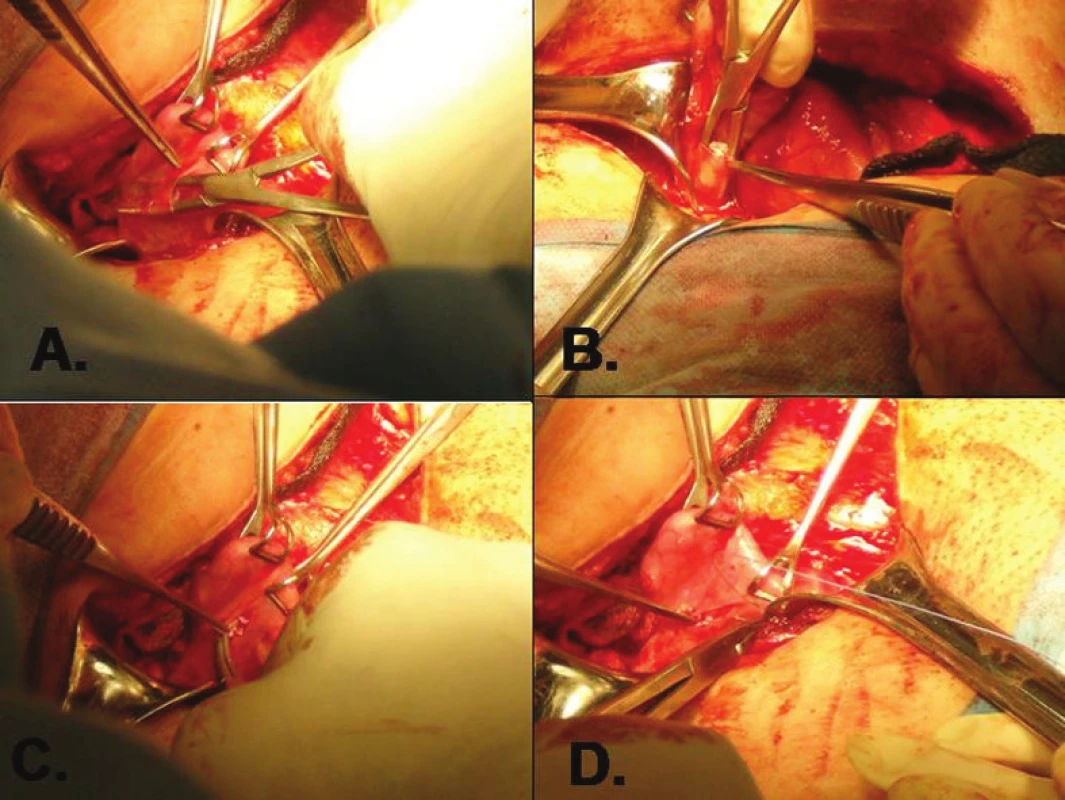
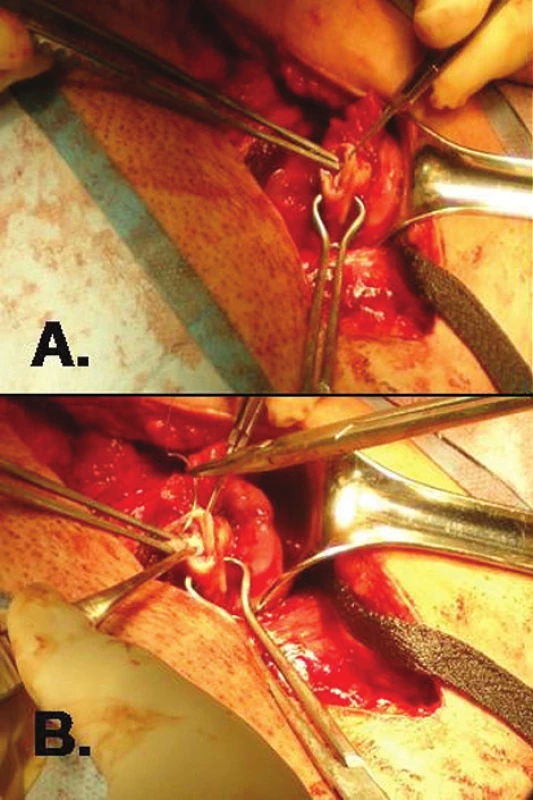
Klinickým důkazem dobré funkce transplantátu je obnovení menstruačního cyklu u pacientky s iatrogenní amenoreou po chemoterapii. Podle dosud publikovaných prací dochází ke spontánnímu nástupu menstruace většinou do 6 měsíců po transplantaci. Přesnější možnost sledování funkce transplantovaného ovariálního štěpu představuje monitoring hladin gonadotropinů v krvi pacientky. Tato laboratorní metoda je běžně dostupná a levná. Pokud dojde k přihojení štěpu ovariální tkáně, dochází k poklesu hladin gonadotropinů, zejména folikulostimulačního hormonu (FSH). Doporučený interval sledování hladin těchto hormonů v krvi je jednou týdně do poklesu FSH pod 20 IU/l či do obnovy spontánního menstruačního cyklu. Poté je možné sledovat tyto parametry méně často a individuálně v závislosti na fázi menstruačního cyklu a podle plánování další léčby neplodnosti. Perspektivní a citlivější se jeví sledování nových ukazatelů ovariální rezervy – inhibinů (INH A, INH B) a anti-mülleriánského hormonu (AMH) [13]. Jejich hladiny začnou v krvi stoupat o několik týdnů dříve, než je detekován signifikantní pokles FSH. Rutinnímu zavedení do praxe zatím brání vysoká cena biochemických metod detekce těchto látek v krvi. Neinvazivní možností je také sledování funkce transplantátu pomocí vaginální sonografie. Již několik dnů po autotransplantaci je možné detekovat pomocí dopplerovského barevného mapování zvýšený průtok krve při neovaskularizaci v oblasti uložení transplantátu v ligamentum latum uteri. Po několika měsících, většinou až po obnovení menstruačního cyklu, je možné vaginálním ultrazvukem pozorovat růst a vývoj folikulů v transplantované tkáni. Po obnovení funkce štěpu je žádoucí co nejdříve uvažovat o využití autotransplantátu k získání zralých oocytů s jeho následným oplozením a vznikem embrya. V případě ortotopické transplantace je teoreticky možná i spontánní koncepce, ale s poměrně nízkou šancí na úspěch. Jako účinnější se ukazuje využití ovariální stimulace gonadotropiny a standardních technik IVF.
VÝSLEDKY
Technika KOT je rozvíjena na našem pracovišti postupně od začátku roku 2005. V prvních letech po zavedení metody jsme využívali zejména metodu pomalého mražení pomocí programovatelného zařízení Planner Kryo 10. Od roku 2007 jsme začali kryokonzervovat ovariální tkáň také pomocí metody vitrifikace. Jednotlivé případy kryokonzervace provedené na našem pracovišti podrobně charakterizuje tabulka 1. Podrobnější charakteristiku souboru pacientek a výsledky odběru a kryokonzervace ovariální tkáně shrnuje tabulka 2.
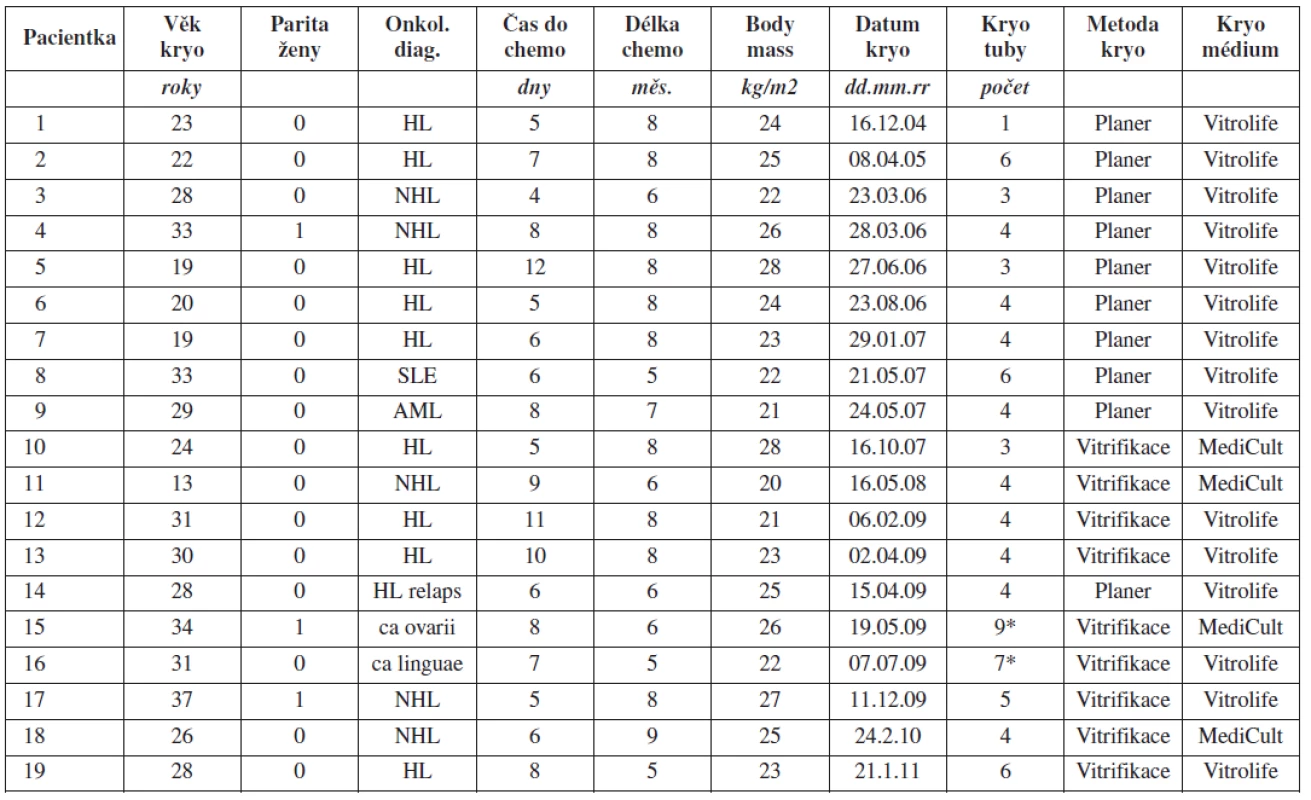
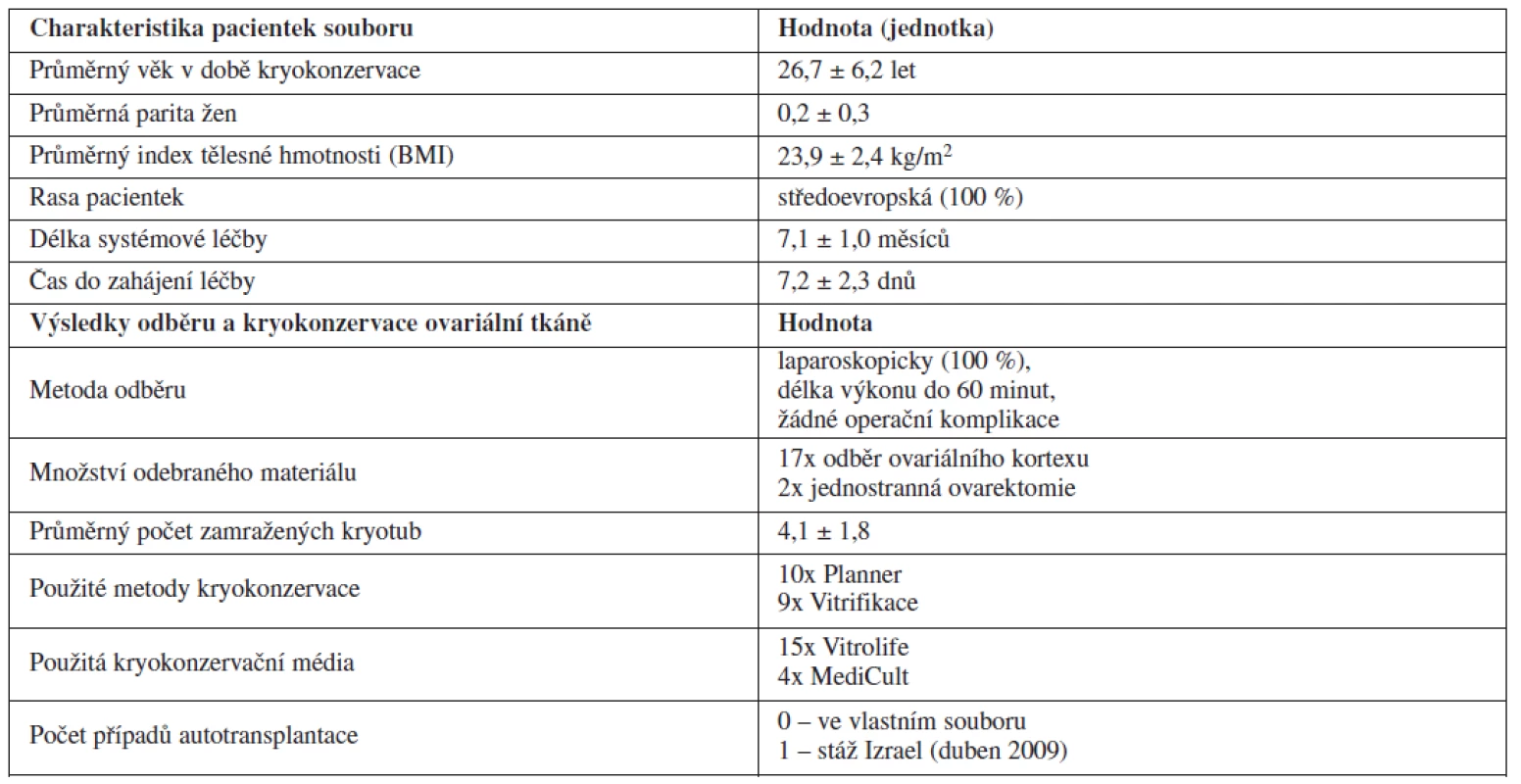
Metoda KOT byla na Gynekologicko-porodnické klinice LF MU a FN Brno využita v období leden 2005 až leden 2011 celkem u 19 pacientek před plánovanou gonadotoxickou léčbou. Ve většině případů šlo o pacientky s primární diagnózou hematologické malignity (84 %) – Hodgkinův lymfom (10krát), non-hodgkinský lymfom (5krát) a akutní myeloidní leukémie (jednou). Dále byla metoda využita v jednom případě u pacientky s karcinomem ovaria, jednou u karcinomu jazyka a v jednom případě u ženy se systémovým lupus erythematodes s orgánovým postižením. Průměrný věk pacientek, které využily metody kryokonzervace ovariální tkáně, byl 26,7 let. Nejmladší pacientka, která se na základně dohody s rodiči rozhodla metodu využít, měla 13 let. V souboru žen dominovaly nulipary (88 %). Průměrná parita v souboru byla 0,1 dítěte v anamnéze. Ve všech případech šlo o ženy středoevropské rasy. Průměrný index tělesné hmotnosti (BMI) pacientek ve sledovaném souboru byl 23,9 kg/m2. Délka systémové chemoterapie či imunoterapie činila průměrně 7,1 měsíců. Průměrný čas do zahájení chemoterapie byl v případě kryokonzervace ovariální tkáně velmi krátký a nepřesahoval jeden týden (průměr 7,2 dnů).
Odběr ovariální tkáně byl prováděn ve všech případech laparoskopickou metodou v celkové anestezii. Délka operačního výkonu nepřesáhla dobu 60 minut. Ve sledovaném souboru pacientek jsme nezaznamenali žádné peroperační ani pooperační komplikace. Pacientky byly hospitalizovány maximálně 2 dny. Podle našich zkušeností je možné zahájit systémovou léčbu onkologického onemocnění již za 2 až 3 dny od odběru ovariální tkáně, pokud byl odběr proveden námi popsanou technikou. Ve většině případů (89,5 %) jsme ženě pro účely kryokonzervace odebrali vzorek ovariální kůry o rozměrech asi 10 x 20 mm a tloušťce 1–2 mm z obou ovarií. Ve dvou případech byl pro velmi vysoké riziko trvalého ovariálního selhání v důsledku chemoterapie proveden odběr celého jednoho vaječníku – unilaterální ovarektomie.
Na našem pracovišti nemáme zatím vlastní zkušenost s transplantací ovariální tkáně. Postup ortotopické transplantace a sledování transplantátu, uskutečněný týmem dr. Ariela Revela během pobytu autora na akademické stáži v Hadassah Medical Center v Jeruzalémě na jaře roku 2009, byl popsán v kapitole materiál a metody. Následující informace o této kazuistice jsou uveřejněny s jeho souhlasem. Šlo o 29letou nuligravidu s indexem tělesné hmotnosti 28 kg/m2. Její základní onkologická diagnóza byla alfa thalassemia major. Jde o autozomálně recesivně dědičné onemocnění s poruchou syntézy alfa řetězce molekuly hemoglobinu: onemocnění se projevuje anémií s nemožností syntézy funkčního hemoglobinu a postupně vede ke smrti pacienta, nejčastěji na srdeční selhání. Jedinou kauzální terapií je alogenní transplantace hematopoetických buněk kostní dřeně (hematopoetic stem cell transplantation, HSCT), která může eliminovat trvalou závislost pacienta na opakovaných transfuzích. Součástí procedury je myeloablační chemoradioterapie, která téměř vždy vede k předčasnému ovariálnímu selhání v důsledku destrukce ovariálních folikulů. Pacientka podstoupila HSCT v roce 2001, ve svých 19 letech. Před léčbou jí byla provedena unilaterální ovarektomie se zamražením ovariální tkáně technikou pomalého zamražování. Dne 24. dubna 2009 byla rozmražena část její kryokonzervované ovariální tkáně – celkem 5 kryotub obsahujících dohromady 26 proužků ovariální tkáně velikosti asi 5 x 1 mm a tloušťce 1–2 mm. Do 1 hodiny po rozmražení ovariální tkáně byla pacientce provedena v celkové anestezii z laparotomického přístupu autotransplantace této ovariální tkáně. Operační výkon trval celkem 70 minut. Během operace ani v průběhu pooperačního období nebyly zaznamenány žádné závažné komplikace. Laparotomie byla zcela zhojena po 7 dnech. Během časného pooperačního sledování byl již šestý pooperační den pomocí ultrazvukového dopplerovského barevného mapování detekován zvýšený průtok krve v oblasti uložení transplantátu v ligamentum latum uteri v důsledku neovaskularizace vloženého štěpu ovariální tkáně. Ke spontánní obnově menstruačního cyklu došlo u pacientky koncem srpna 2009, tedy 4 měsíce po transplantaci. Bazální hodnoty gonadotropinů po obnovení menstruace byly následující: FSH 7,4 IU/l, LH 6,7 IU/l, estradiol (E2) 0,2 mmol/l.
DISKUSE
Výhodou techniky KOT je její rychlost. Před odběrem ovariální tkáně není nutná ovariální stimulace gonadotropiny, což významným způsobem zkracuje dobu její realizace ve srovnání s metodami kryokonzervace oocytů či embryí. Nedochází tak k žádnému prodlení či odsunu zahájení vlastní onkologické léčby a nezvyšuje se riziko progrese či diseminace primárního nádorového ložiska. V našem souboru pacientek nepřesáhla doba realizace této techniky jeden týden. Doba nutná ke kryokonzervaci oocytů či embryí se běžně pohybuje mezi 3–5 týdny.
Relativní nevýhodou metody KOT může být její invazivita. Ovaria jsou na rozdíl od testes u mužů uložena intraperitoneálně v malé pánvi, tedy na poměrně obtížně přístupném místě. Odběr ovariální tkáně se provádí většinou laparoskopicky. Tato minimálně invazivní technika organismus pacientky zbytečně nezatěžuje. Celá procedura vyžaduje zpravidla jednodenní hospitalizaci. Procento komplikací je při rutinním užití této metody rovněž velmi nízké. V našem souboru pacientek jsme žádné závažné peroperační ani pooperační komplikace nezaznamenali. Rekonvalescence bývá velmi rychlá, zpravidla netrvá dále než několik dnů. Onkologickou léčbu není nutné nějak zdržovat, celou proceduru se daří realizovat v průběhu nutných stagingových vyšetření časně po stanovení základní onkologické diagnózy. Před zákrokem je vyžadováno základní předoperační vyšetření. Zákrok je kontraindikován pouze v případě neuspokojivého zdravotního stavu pacienta, většinou na podkladě základního onkologického onemocnění.
Velmi zajímavým příkladem kombinace dvou technik reprodukční ochrany je postup navržený Revelem. Po odběru ovariální tkáně je možné nalézt ve zpracovávaném vzorku také oocyty v různých stadiích folikulogenze [23]. Tyto oocyty je možné následně maturovat in vitro a zamrazit s využitím klasické techniky pomalého mražení nebo vitrifikace. Autoři této originální metody dokázali získat při zpracování ovariální tkáně průměrně 9 oocytů (rozptyl od 0 do 37 oocytů). Podmínkou získání dostatečného počtu oocytů je odebrání maximálně možného množství tkáně. Ve většině případu byla prováděna unilaterální ovarektomie.
Přestože většina nádorů nemetastazuje do ovaria, některé systémové druhy nádorového onemocnění, jako například leukémie, mají nezanedbatelné riziko výskytu metastáz také v ovariální tkáni. Ovariální metastázy jsou v 20–50 % popisovány také u neuroblastomu. U karcinomu prsu je riziko metastáz do ovaria nízké u klinických stadií I–III. Ovariální metastázy jsou extrémně vzácné také u lymfomů (s výjimkou Burkittova lymfomu) a většiny sarkomů (například Wilmům tumor ledviny, osteosarkom či Ewingův sarkom) [22]. Při absenci makroskopických či radiologických známek ovariálních metastáz je riziko poškození vaječníku tímto procesem velmi malé. Již během vstupního pohovoru o technice KOT je potřeba na teoretickou možnost reimplantace nádorových buněk při transplantaci pacientku upozornit. K minimalizaci tohoto rizika v našem soboru pacientek byly z každého ovaria odebrány minimálně 2 histologické vzorky ovariálního kortexu z náhodně vybraných míst. Tyto vzorky byly podrobně vyšetřeny patologem na přítomnost nádorových buněk v ovariu. V žádném z vyšetřovaných vzorků v prezentovaném souboru pacientek nebyly nádorové buňky nalezeny. V případě pozitivního nálezu maligních buněk ve vyšetřovaném vzorku, je samozřejmě KOT kontraindikována a takový vzorek není možné v budoucnu využít k autotransplantaci. Pacientce je vhodné vysvětlit, že riziko rekurence základního nádorového onemocnění není možné nikdy zcela vyloučit a transplantace histologicky negativních vzorků ovariální tkáně toto riziko významným způsobem nezvyšuje. Písemný souhlas pacientky s provedením KOT i její případné transplantace vždy zaznamenáváme do zdravotní dokumentace. U pacientů s diagnózou vysoce agresivní hemato-onkologické malignity, jako je např. akutní leukémie, kde je riziko ovariálního postižení poměrně vysoké, musíme uvažovat také o jiných možnostech reprodukční ochrany. V budoucnu by problém rekurence onkologického onemocnění v důsledku transplantace ovariální tkáně mohla řešit metoda transplantace izolovaných primordiálních folikulů či techniky jejich maturace v podmínkách in vitro [26].
Rychlost zpracování ovariální tkáně od okamžiku odběru do vlastní kryokonzervace má pravděpodobně vliv na počet a kvalitu uchovávaných PMF. Experimentální studie prokázaly výrazný pokles počtu primordiálních folikulů v rozmražených vzorcích ovariální tkáně v důsledku ischemického inzultu. Ve většině studií je pokles počtu primordiálních folikulů ve vzorku po autotransplantaci odhadován na 50–65 % původního počtu [3, 21]. Ovariální kortex dobře toleruje ischemii po dobu asi 3 hodin a riziko poškození je možné snížit přidáním antioxidantů do inkubačního média (např. kyselina askorbová). Navíc bylo také prokázáno, že stromální buňky ovaria jsou významně více senzitivní k ischemickému traumatu než buňky folikulární [17].
Před použitím zamražené ovariální tkáně nutně vyvstane otázka, jak brzy po úspěšném ukončení onkologické léčby je vhodné ženě nabídnout její transplantaci. Rozhodnutí závisí zejména na prognóze základního onkologického onemocnění, zdravotním stavu ženy, negativitě výsledků restagingových vyšetření během dispenzarizace a v neposlední řadě také na názorech a přáních pacientky a jejího partnera. Stanovení období, kdy je pacient v dlouhodobé remisi onkologického onemocnění, je plně v kompetenci klinického onkologa. Na základě vlastních zkušeností doporučujeme u vyléčených onkologických pacientů před zahájením léčby metodami reprodukční medicíny vyžádat si písemný souhlas dispenzarizujícího onkologického pracoviště s navrhovaným postupem léčby neplodnosti. Mezioborová spolupráce mezi klinickým onkologem a specialistou v oboru reprodukční medicíny by tedy neměla končit při stanovení onkologické diagnózy u pacienta v reprodukčním věku, ale naopak musí pokračovat v průběhu celého jeho dalšího reprodukčního období. Převážně technickým problémem po rozhodnutí o provedení transplantace je volba nejoptimálnějšího operačního postupu. Transplantační techniky se zjednodušeně dělí na dvě skupiny – ortotopické (do oblasti infundibulopelvického vazu v malé pánvi) a heterotopické (např. do podkoží břicha či předloktí). Po heterotopické transplantaci je oplození dozrávajících oocytů možné pouze za použití metod in vitro fertilizace. Nicméně heterotopická lokalizace má i své výhody – malou invazivitu bez nutnosti celkové anestezie, přesnější monitoring štěpu nebo možnost jednoduchého odstranění v případě potřeby (např. při recidivě nádorového bujení). Ortotopická transplantace vyžaduje ve většině případů laparotomii. Při dobrých zkušenostech operatéra a pracoviště je jistě možné výkon provést i laparoskopicky. Dosažení porodu zdravého dítěte se zatím podařilo pouze v případě ortotopické transplantace, proto je tato metoda i přes její větší invazivitu v klinické praxi zatím stále preferována. Pokud máme k dispozici dostatečné množství zamrazené ovariální tkáně, rozmrazujeme a transplantujeme pouze její část. Tento postup je většinou možný pouze u žen, u nichž ke kryokonzervaci odebíráme a uchováváme celé jedno ovarium. Minimální množství ovariální tkáně vhodné k transplantaci není určeno. Ze zkušeností zahraničních pracovišť se ukazuje, že k úspěšné implantaci transplantované tkáně je potřeba minimálně 15–20 proužků ovariálního kortexu.
Zajímavá je otázka délky fungování transplantátu ovariální tkáně. Dosavadní zkušenosti ze sledovaní pacientek, které tento zákrok podstoupily, ukazují, že funkce transplantované tkáně je časově omezená. K obnovení menstruačního cyklu dochází průměrně za 4–8 měsíců od transplantace. Přestože došlo k obnově menstruace, perzistují u většiny pacientek vysoké hladiny gonadotropinů, zejména FSH. Hodnoty se běžně pohybují nad hranicí 25 IU/l. Tyto vysoké hodnoty FSH mohou být důsledkem poměrně malého počtu přeživších primordiálních folikulů v transplantátu. Po transplantaci pacientka průměrně získá 500–1000 primordiálních folikulů, z nichž zhruba polovina je zničena ischemií v časném období po transplantaci [8]. Bedaivy a spol. v roce 2008 podrobněji analyzoval 23 případů úspěšné transplantace ovariální tkáně u člověka. Průměrný čas nutný k obnově funkce ovariálního štěpu byl 120 dní, s minimem 60 dní a maximem 244 dnů. Funkčnost transplantátu se odvíjí od počtu přeživších ovariálních folikulů. Studie hodnotící dobu funkčnosti transplantátu prokázaly jeho funkčnost průměrně 210 dní, tedy přibližně 7 měsíců. Minimální doba fungování štěpu byla 30 dní a maximální doba 845 dní (téměř dva a půl roku). Výsledky uvedených pozorování jsou limitovány zejména krátkým obdobím sledování funkčnosti štěpu v ojedinělých klinických případech. Délka fungování štěpu, podobně jako rychlost obnovení jeho funkce, závisí zejména na míře ischemického inzultu tkáně procesem kryokonzervace, velikosti transplantovaného vzorku a také na věku ženy [4]. Na základě těchto limitovaných pozorování je nutné každého pacienta po úspěšné transplantaci ovariální tkáně upozornit na riziko opakovaného ovariálního selhání a na pravděpodobně omezenou dobu fungování transplantátu. Právě v období fungování transplantátu je nutné v maximálně možné míře využít metod asistované reprodukce k dosažení klinického těhotenství. Pacientka a její partner by si měli být dobře vědomi tohoto faktu a vlastní proces transplantace ovariální tkáně by měl jít ruku v ruce s plánováním následné léčby metodami IVF. Transplantace ovariální tkáně je prováděna s cílem zajistit fertilitu ženy po onkologické léčbě, nemůže zatím sloužit k dlouhodobému zajištění produkce ovariálních steroidů u žen s předčasným ovariálním selháním po chemoterapii.
Důležitou otázkou pro klinickou praxi je efektivita techniky kryokonzervace ovariální tkáně z hlediska vynaložených nákladů a reálné šance pacientky na dosažení gravidity a porodu zdravého potomka. K vyhodnocení těchto dat je nutné dostatečně dlouhé časové období. Základem je pečlivý monitoring reprodukčních funkcí pacientky před zahájením léčby, v jejím průběhu a zejména v pravidelných intervalech po jejím ukončení. Tato dispenzarizace může být komplikována nezanedbatelnou mírou mortality na základní nádorové onemocnění. V případě existence více pracovišť se stejným zaměřením je velmi žádoucí vytvoření společného (národního či evropského) registru pacientů, již některé z metod reprodukční ochrany využili. Jistě nezanedbatelným aspektem techniky KOT je jejich cena. Její výše je determinována zejména náklady na materiál a na média nutná ke zpracování odebraných biologických vzorků. Laboratoř IVF, která rutinně provádí techniku kryokonzervace embryí, je dostatečně vybavena i k realizaci techniky KOT. Na našem pracovišti byla realizace těchto technik v prvních letech projektu možná také díky grantové podpoře Interní grantové agentury Ministerstva zdravotnictví ČR (projekt NR8469-3/2005-2007). Po vyčerpání grantových prostředků jsme nyní nuceni po pacientce požadovat alespoň část finančních prostředků k pokrytí nákladů laboratoře. Jednání o zajištění alespoň částečné úhrady vynaložených nákladů z prostředků veřejného zdravotního pojištění zatím nebyla úspěšná. Náklady na anestezii, krátkodobý pobyt v lůžkovém zařízení a na vlastní odběr ovariální tkáně u žen pomocí laparoskopické operace jsou v současné době plně hrazeny z prostředků veřejného zdravotního pojištění. Výše finančních prostředků požadovaných po pacientovi samozřejmě ovlivňuje jeho rozhodování. Část žen, u nichž je plně indikován odběr ovariální tkáně a její zamrazení pro budoucí použití, často nakonec tyto techniky nevyužije z důvodů vysoké finanční spoluúčasti ze strany pacienta. V zahraničí je míra spoluúčasti pacienta také vysoká, nicméně je zde možnost využít komerčního pojištění či obrátit se s požadavkem na úhradu těchto technik na různé nadační instituce.
ZÁVĚR
Léčba nádorového onemocnění má jednoznačně prioritu před šancí na zachování reprodukce. Na druhé straně tato nabídka ze strany gynekologa může významným způsobem zlepšit kvalitu života mladé onkologické pacientky. V současnosti existuje již více než 10 let klinických zkušeností s technikami kryokonzervace ovariální tkáně u člověka. Narození již desítek zdravých dětí s použitím této techniky dává šanci pacientkám do budoucna, ale stále je nutné považovat tuto techniku za experimentální. Po schválení etickou komisí příslušné instituce je tento postup eticky akceptovatelný u správně indikovaných mladých žen či adolescentek. Ve shodě s mezinárodními doporučeními zabývajícími se touto problematikou nabízíme na našem pracovišti možnost KOT všem pacientkám mladším 35 let, u nichž je významné riziko trvalého poškození funkce vaječníku chemoterapií a není dostatek času na provedení cyklu in vitro fertilizace s kryokonzervací oocytů či embryí [5, 18, 25]. Písemný souhlas pacientky, popřípadě zákonných zástupců, by měl být získán po podrobné konzultaci, aby se předešlo riziku nepochopení či naopak přílišné opatrnosti. Výzkum v této oblasti je nutné nyní soustředit směrem k vývoji vhodných postupů využití ovariální tkáně po jejím rozmrazení. Budoucnost pravděpodobně leží v možnostech zajištění folikulogeneze v prostředí in vitro.
Doc. MUDr. Martin Huser, Ph.D.
Gynekologicko-porodnická klinika
LF MU a FN Brno
Jihlavská 20
602 00 Brno
e-mail: martin.huser@gmail.com
Zdroje
1. Amorim, CA., Van Langendonckt, A., David, A., et al. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod, 2009, 24, p. 92-99.
2. Anderson, RA., Weddell, A., Spoudeas, HA., et al. Do doctors discuss fertility issues before they treat young patients with cancer? Hum Reprod, 2008, 23, p. 2246-2251.
3. Baier, DT., Webb, R., Campbell, BK., et al. Long-term ovarian function in sheep after ovariectomy and transplantation of autografts stored at -196 C. Endokrinology, 1999, 140, p. 462‑471.
4. Bedaiwy, MA., El-Nashar, SA., El Saman, AM., et al. Reproductive outcome after transplantation of ovarian tissue: a systematic review. Hum Reprod, 2008, 23, p. 2709-2717.
5. Danforth, H. Ethics Committee of the American Society for Reproductive Medicine. Fertility preservation and reproduction in cancer patients. Fertil Steril, 2005, 83, p. 1622-1628.
6. Demeestere, I., Simon, P., Buxant, F., et al. Ovarian function and spontaneous pregnancy after combined heterotopic and orthotopic cryopreserved ovarian tissue transplantation in a patient previously treated with bone marrow transplantation: case report. Hum Reprod, 2006, 21, p. 2010-2014.
7. Demeestere, I., Simon, P., Emiliani, S., et al. Fertility preservation: successful transplantation of cryopreserved ovarian tissue in a young patient previously treated for Hodgkin’s disease. Oncologist, 2007, 12, p. 1437-1442.
8. Donnez, J., Dolmans, MM., Demylle, D., et al. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue. Lancet, 2004, 364, p. 1405-1410.
9. Donnez, J., Squifflet, J., Van Rycl, AS., et al. Restoration of ovarian function in orthotopically transplanted cryopreserved ovarian tissue: a pilot experience. Reprod Biomed Online, 2008, 16, p. 694-704.
10. Gook, DA., Edgar, DH., Borg, J., et al. Diagnostic assessment of the developmental potential of human cryopreserved ovarian tissue from multiple patients using xenografting. Hum Reprod, 2005, 20, p. 72-78.
11. Hernandez-Fonseca, H., Bosch, P., Sirisathien, S., et al. Effect of site of transplantation on follicular development of human ovarian tissue transplanted into intact or castrated immunodeficient mice. Fertil Steril, 2004, 81, p. 888-892.
12. Hovatta, O. Methods for cryopreservation of human ovarian tissue. Reprod Biomed Online, 2005, 10, p. 729-734.
13. Huser, M., Crha, I., Žákova, J., Ventruba, P. Proces reprodukčního stárnutí ženy – příčiny, stanovení a možnosti užití v praxi. Čes Gynek, 2010, 75, p. 353-358.
14. Huser, M., Crha, I., Žákova, J., Ventruba, P. Onkofertilita – nový směr reprodukční medicíny. Čes Gynek, 2011, 76, s. 91-99.
15. Imhof, M., Bergmeister, H., Lipovec, M., et al. Orthotopic microvascular reanastomosis of whole cryopreserved ovine ovaries resulting in pregnancy and live birth. Fertil Steril, 2006, 85, p. 1208-1215.
16. Isachenko, V., Isachenko, E., Reinsberg, J., et al. Cryopreservation of human ovarian tissue: effect of spontaneous and initiated ice formation. Reprod Biomed Online, 2008, 16, p. 336-345.
17. Kim, SS., Yang, HW., Kang, HG., et al. Quantitative assessment of ischemic tissue damage in ovarian cortical tissue with or without antioxidant (ascorbic acid) treatment. Fertil Steril, 2004, 82, p. 679-685.
18. Lee, SJ., Schovej, LR., Partridge, AH., et al. American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol, 2006, 24, p. 2917-2931.
19. Meirow, D., Levron, J., Eldar-Geva, T., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med, 2005, 353, p. 318-321.
20. Newton, H., Aubard, Y., Rutherford, A., et al. Low temperature storage and grafting of human ovarian tissue. Hum Reprod, 1996, 11, p. 1487-1491.
21. Nisolle, M., Casanas-Roux, F., Qu, J., et al. Histologic and ultrastructural evaluation of fresh and frozen-thawed human ovarian xenografts in nude mice. Fertil Steril, 2000, 74, p. 122‑129.
22. Oktay, K. Ovarian tissue cryopreservation and transplantation: preliminary findings and implications for cancer patients. Hum Reprod Update, 2001, 7, p. 526-534.
23. Revel, A., Revel-Vilk, S., Aizenman, E., et al. At what age can human oocytes be obtained? Fertil Steril, 2009, 92, p. 458-463.
24. Silber, SJ., DeRosa, M., Pineda, J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Hum Reprod, 2008, 23, p. 1531-1537.
25. Wallace, WH., Anderson, RA., Irvine, DS. Fertility preservation for young patients with cancer: who is at risk and what can be offered? Lancet Oncol, 2005, 6, p. 209-218.
26. Xu, M., Barrett, SL., West-Farrell, E.,et al. In vitro grown human ovarian follicles from cancer patients support oocyte growth. Hum Reprod, 2009, 24, p. 2531-2540.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2012 Číslo 2
-
Všechny články tohoto čísla
- Laparoskopicky asistovaná neoplastika pochvy podle Vecchiettiho
- Vliv aplikace GnRH analog na peroperační a postoperační výsledky myomektomie u žen v reprodukčním věku
- Kryokonzervace ovariální tkáně u onkologických pacientek – 6 let klinických zkušeností
- Vedení porodu po předchozím císařském řezu, analýza výsledků z let 2007–2010
- Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit
- Nové metody zvyšující úspěšnost asistované reprodukce
- Kortikotropin-releasing hormon a adrenokortikotropní hormon – možné markery některých těhotenských patologií
- Imunoterapie karcinomu ovaria
- Těhotenství a porod zdravého dítěte komplikované koincidencí heterotopické gravidity po IVF a placenty perkrety s následnou hysterektomií
- Fetomaternální hemoragie při porodu císařským řezem
- Medicínské, právní a etické aspekty zachování fertility u onkologických pacientek
- Uroinfekce v graviditě – kdy léčit, jak léčit a čím léčit
- Výskyt trombofilních mutací u žen se závažnými těhotenskými komplikacemi
- Možnosti IVF v nativním cyklu
- Editorial
- Historie a současnost Gynekologicko-porodnické kliniky v Brně
- Screening v 11.–13.+6 týdnu těhotenství
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit
- Možnosti IVF v nativním cyklu
- Uroinfekce v graviditě – kdy léčit, jak léčit a čím léčit
- Vedení porodu po předchozím císařském řezu, analýza výsledků z let 2007–2010
