Výskyt trombofilních mutací u žen se závažnými těhotenskými komplikacemi
Thrombophilic mutation by women with serious pregnancy complications
Objective:
The purpose of this study was to determine whether maternal or fetal genotype frequencies of the inherited thrombophilic gene mutation (F V Leiden, F II) are altered in adverse pregnancy outcomes – severe preeclampsia, IUGR, abruption of placenta and stillbirth.
Design of the study:
Retrospective study.
Setting:
Department of Gynecology and Obstetrics of the Teaching Hospital and the 2nd Medical Faculty of the Charles University in Prague.
Methods:
We studied 232 women who had pregnancy complications. All women were tested postpartum for mutation of factor V Leiden and G20210A prothrombine gene. At the same time were tested the newborns of those women.
Results:
In the group of women with preeklampsia (n=141) we have demonstrated 5 women with mutation encoding for F V, 5 women with mutation encoding for F II and 1 combination of both. In the group of IUGR 2 women with mutation F V, 1 with mutation F II a 1 combination of both were found. In women after stillbirth occure two mutation of F V, one mutation of F II and one combination of both. In the group with abruptio of placenta was 1 case of mutation F V and 3 cases of mutation F II. When we tested a newborn we found 4 cases of mutation F V and 3 cases of F II in the group with preeclampsia, 4 cases of mutation F V 3 cases od mutation of F II in the group with IUGR, no case in the group with abruptio of placenta and 1 case in a death fetus. There was no assotiation between any severe pregnancy complications and any of the maternal or fetal inherited thrombophilia.
Conclusion:
Factor V Leiden and prothrombin gene mutations did not seem play a significant role in adverse pregnancy outcome in our population.
Key words:
thrombophilia, mutation, Leiden, prothrombin, preeclampsia, IUGR, abruption, stillbirth.
Autoři:
B. Vavřinková 1; T. Binder 1; I. Hadačová 2; I. Hrachovinová 3; P. Salaj 3; Martin Hruda 1
Působiště autorů:
Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha, přednosta prof. L. Rob, CSc.
1; Oddělení klinické hematologie FN Motol, Praha, prim. I. Hochová
2; Ústav hematologie a krevní transfúze, Praha, ředitel prof. MUDr. M. Trněný, CSc.
3
Vyšlo v časopise:
Ceska Gynekol 2012; 77(2): 171-174
Kategorie:
Původní práce
Souhrn
Cíl studie:
Cílem naší studie bylo prokázat souvislost mezi výskytem závažných těhotenských komplikací (těžká preeklampsie, IUGR, abrupce placenty, intrauterinní úmrtí plodu) a výskytem trombofilních mutací se zaměřením na mutaci F V Leiden a F II.
Typ studie:
Retrospektivní studie
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha 5.
Metodika:
Do studie bylo zařazeno 232 žen, jejichž gravidita byla komplikována těžkou preeklampsií, IUGR, abrupcí placenty nebo intrauterinním odumřením plodu. U všech těchto žen jsme provedli genetickou analýzu s ohledem na přítomnost trombofilních mutací. Rovněž jsme provedli vyšetření trombofilních mutací u novorozence.
Výsledky:
Ze 141 žen s preeklampsií mělo jen 5 žen mutaci F V, 5 žen mutaci F II a 1 žena kombinaci obou mutací. V případě IUGR to byly 4 ženy s mutací F V, 5 žen s mutací F II a 1 žena s kombinací obou mutací. U žen s intauterinním úmrtím plodu jsme prokázali 2krát mutaci F V, 1 mutaci F II a v 1 případě kombinaci obou mutací. U žen s abrupcí placenty se mutace F V vyskytovala v 1 případě, ve 3 případech šlo o mutaci F II a nezaznamenali jsme výskyt kombinace obou mutací.
Při vyšetření plodu jsme diagnostikovali v případě preeklampsie 4 případy mutace F V a 3 případy mutace F II, u IUGR 4 případy mutace F V a 3 případy mutace F II, u abrupce placenty žádnou mutaci F V a 1 mutaci F II, v případě mrtvého plodu to byla 1 mutace F II.
Závěr:
Neprokázali jsme statisticky významně vyšší incidenci výskytu trombofilních mutací u žen se závažnými těhotenskými komplikacemi.
Klíčová slova:
trombofilie, mutace, Leiden, protrombin, preeklampsie, IUGR, abrupce placenty, intrauterinní úmrtí plodu.
ÚVOD
V posledních letech se objevilo mnoho studií zkoumajících vliv trombofilie na průběh těhotenství. Nejčastější těhotenské komplikace dávané do souvislosti s mateřskou trombofilií jsou těžká preeklampsie, abrupce placenty, růstová retardace plodu (IUGR) a intrauterinní smrt plodu. Za nejzávažnější jsou považovány mutace faktoru V Leiden, mutace methylentetrahydrofolátreduktázy (MTHFR) a mutace protrombinového genu. Mutace F V Leiden je způsobena záměnou nukleotidu guaninu za adenin na pozici 1691 exonu 10 v genu pro faktor V. Následkem této nukleotidové substituce je substituce aminokyseliny argininu za glutamin v peptidickém řetězci na místě 506. To zapříčiňuje rezistenci faktoru V k antikoagulační aktivitě APC (aktivovaný protein C), tzv. APC rezistenci. Frekvence mutované alely v genu pro faktor V byla v České republice u neselektované populace českých novorozenců stanovena na 5 % [10]. Tato frekvence odpovídá evropskému etniku. Výskyt heterozygotů je 3–8 %, zatímco četnost homozygotů je 0,1 %. Výskyt leidenské mutace vykazuje závislost na rase a zeměpisných faktorech. Nejčastěji byla prokázána u kavkazské populace severských zemí, naproti tomu v asijské a černošské populaci se prakticky nevyskytuje. Další důležitou mutací je mutace v genu pro protrombin nebo také mutace pro faktor II. V evropské populaci je výskyt asi 1 : 300. Výskyt heterozygotů je 1–2 % a četnost homozygotů je méně než 1 %. Jedná se o druhý nejčastější trombofilní stav. Jako příčina byla identifikována záměna glutaminu za arginin v pozici 20210, přítomnost mutovaného genu je spojena se zvýšenou hladinou protrombinu. Tato mutace je rovněž vzácná u barevných ras. Mutace protrombinu je rizikem nezávislým na přítomnosti mutace V. faktoru, nicméně současný výskyt obou zvyšuje riziko vzniku tromboembolické příhody.
Poslední nejčastěji se vyskytující mutací, avšak s nejnižší závažností, je mutace v genu pro MTHFR. Výskyt v evropské populaci je 1 : 3. Změny v genu pro MTHFR proto mohou způsobit hyperhomocysteinémii. Tu může ovšem způsobit i nedostatek vitaminů (kyseliny listové, B6 a B12) v potravě. Homocystein působí cytotoxicky na endoteliální buňky, inhibuje buněčnou proliferaci a stimuluje proliferaci buněk hladkého svalstva v cévách. Dále podporuje protrombotické aktivity v cévní stěně, což může mít za následek vznik aterosklerózy a trombózy. Homocystein na endotelu inhibuje expresi trombomodulinu, a tím aktivaci proteinu C. Hyperhomocysteinémie je také doprovázena zvýšením aktivity F XII a F V v krevní plazmě [6]. Byly popsány dva polymorfismy genu pro MTHFR snižující jeho aktivitu. Polymorfismus A1298C spočívá v záměně adeninu za cytosin v 1298 nukleotidu. Nejčastější mutací tohoto genu je záměna cytosinu za tymin v pozici 677, což má za následek substituci aminokyseliny alaninu za valin na místě 223 v peptidickém řetězci. Výskyt heterozygotů v evropské, severoamerické a australské populaci je 31 % až 39 % a frekvence homozygotů je 9 % až 17 %. I tady se uplatňuje kodominantní způsob dědičnosti.
Jako rizikový faktor pro vznik defektů neurální trubice se považuje termolabilní polymorfismus C677T. Plody homozygotních matek mají relativní riziko vzniku defektů neurální trubice zvýšené asi 2krát oproti plodům matek s normálním genotypem. Jde o autozomálně recesivní typ dědičnosti.
Těhotenství se považuje za rizikový faktor trombofilie. Při těhotenství dochází ke stavu fyziologické hyperkoagulace. Vlivem těhotenských hormonů, především estrogenů, dojde ke zvýšení fibrinogenu a dalších koagulačních faktorů – V, VII, VIII a von Willenbrandova faktoru. K trombofilii dále přispívá i pokles proteinu S, druhotná rezistence vůči aktivovanému proteinu C a zvýšení hladiny inhibitorů fibrinolýzy [4].
SOUBOR PACIENTEK A METODIKA
V letech 2009–2011 jsme zařadili do studie 232 žen, jejichž gravidita byla komplikována těžkou preeklampsií, IUGR, abrupcí placenty nebo intrauterinním odumřením plodu. Tyto ženy byly sledovány a porodily na Gynekologicko-porodnické klinice 2. LF UK a Fakultní nemocnice Motol. Ze studie byly vyřazeny ženy s anamnézou hluboké žilní trombózy, embolie a cévní mozkové příhody. Rovněž byly vyřazeny ženy s podezřením na vrozenou vývojovou vadu plodu.
Všechny pacientky byly podrobně informovány o povaze a cílech práce a podepsaly informovaný souhlas se zařazením do studie.
U všech žen byla provedena genetická analýza plné krve a byl stanoven genotyp pomocí polymerázové řetězové reakce a gelové elektroforézy. Po porodu byla rovněž odebrána pupečníková krev novorozence a stanoven genotyp novorozence s ohledem na přítomnost trombofilních mutací. Zaměřili jsme se především na klinicky nejzávažnější trombofilní mutace, tedy mutaci F V a F II.
Současně jsme prospektivně sledovali 485 žen s prokázanou trombofilní mutací a sledovali jsme výskyt jednotlivých pozdních těhotenských komplikací v jednotlivých skupinách.
Všechny výsledky byly podrobeny statistické analýze. K testování rozdílů v procentuálním zastoupení jsme použili χ2 v kontingenčních tabulkách doplněný metodou adjustovaných standardizovaných odchylek pozorovaných a očekávaných hodnot. Použili jsme dvoustranné testy a hladinu významnosti menší než 5 % jsme považovali za statisticky významnou.
VÝSLEDKY
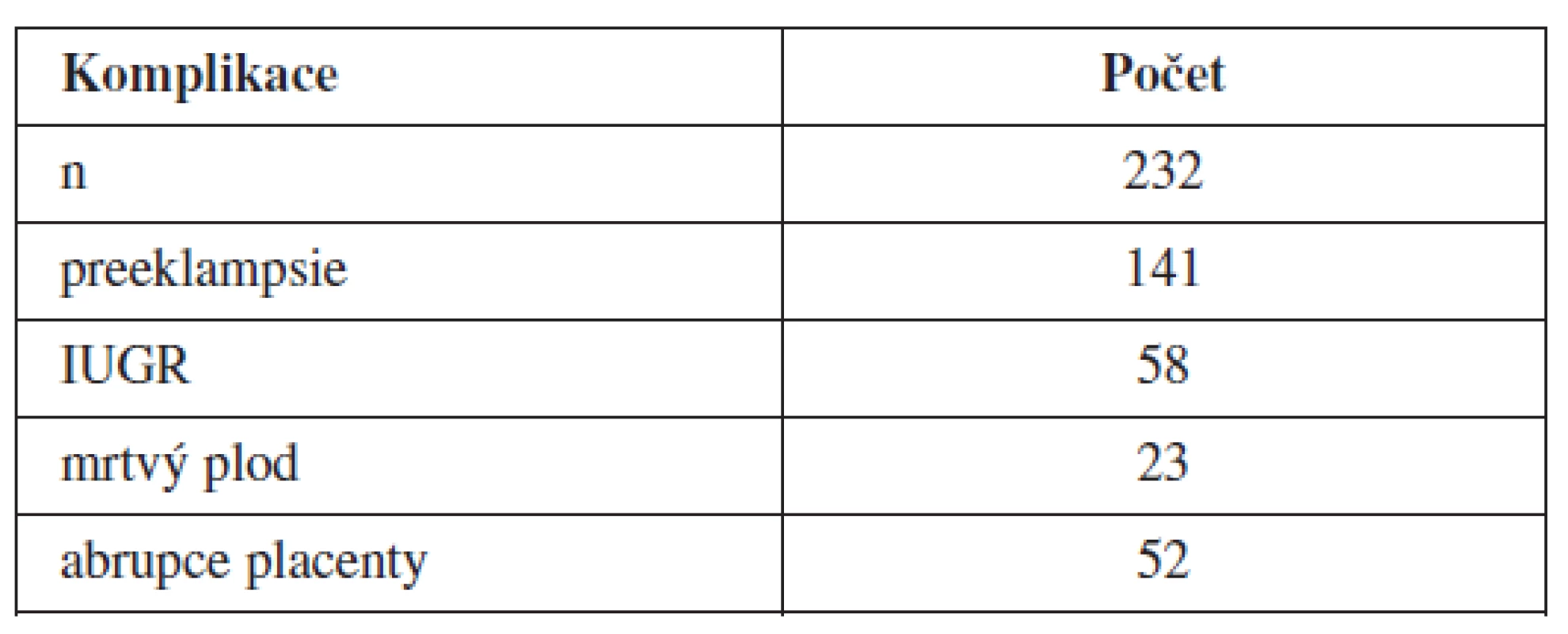
Od ledna 2009 do ledna 2011 bylo na naší klinice vyšetřeno 232 žen s vážnými těhotenskými komplikacemi. Bylo zařazeno 141 žen s těžkou preeklampsií, 58 žen s IUGR, 23 žen s abrupcí placenty a 52 žen s intrauterinně odumřelým plodem (tab. 1). U všech těchto žen jsme provedli genetickou analýzu s ohledem na přítomnost trombofilních mutací. Rovněž jsme provedli vyšetření trombofilních mutací u novorozence (tab. 2 a 3).
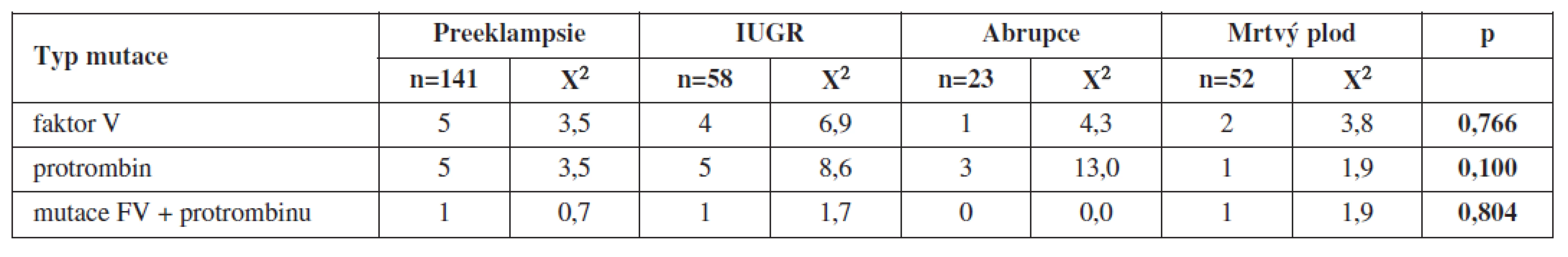
Celkem 42 žen mělo více než jednu těhotenskou komplikaci. Ze 141 žen s preeklampsií mělo jen 5 žen mutaci F V, 5 žen mutaci F II a 1 žena kombinaci obou mutací. V případě IUGR to byly 4 ženy s mutací F V, 5 žen s mutací F II a 1 žena s kombinací obou mutací. U žen s intauterinním úmrtím plodu jsme prokázali 2 mutace F V, 1 mutaci F II a v 1 případě kombinaci obou mutací. U žen s abrupcí placenty se mutace F V vyskytovala v 1 případě, ve 3 případech šlo o mutaci F II a nezaznamenali jsme výskyt kombinace obou mutací.
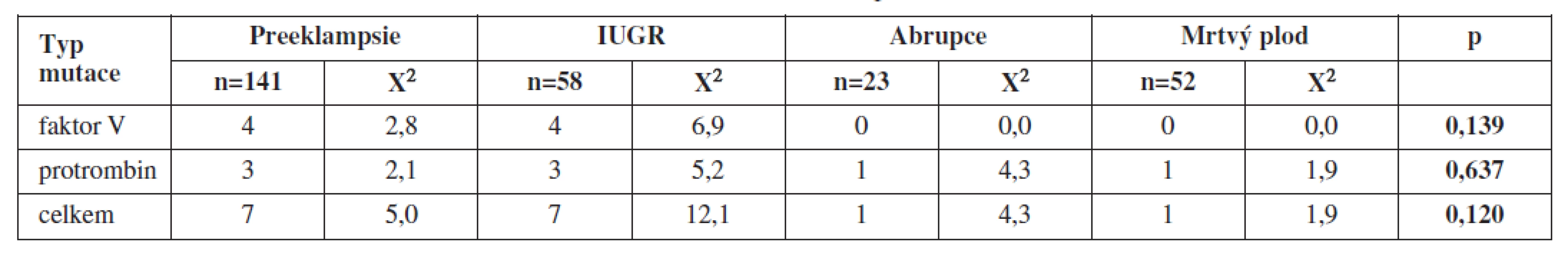
Při vyšetření plodu jsme diagnostikovali v případě preeklampsie 4 případy mutace F V a 3 případy mutace F II, u IUGR 4 případy mutace F V a 3 případy mutace F II, u abrupce placenty žádnou mutaci F V a 1 mutaci F II, v případě mrtvého plodu to byla 1 mutace F II (tab. 2 a 3).
Při statistickém zpracování jsme neprokázali statisticky významnou souvislost s jednotlivými typy trombofilních mutací a uvedenými těhotenskými komplikacemi (tab. 2 a 3).
Rovněž nebyla prokázána statisticky významná souvislost mezi výskytem těhotenských komplikací a vrozených trombofilních mutací u plodu.
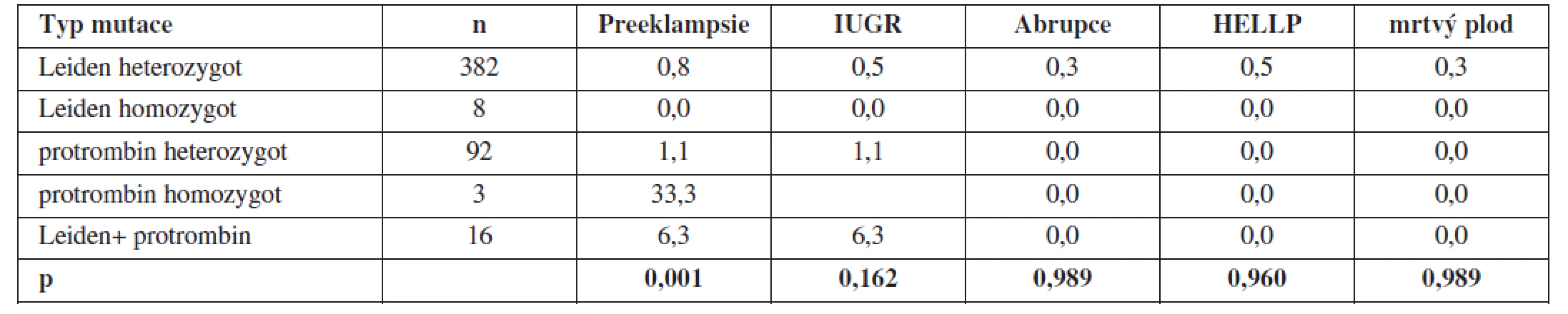
Při prospektivním sledování nositelek trombofilních mutací nebyla prokázána statisticky významná souvislost mezi výskytem trombofilní mutace a pozdní těhotenskou komplikací. Jedinou výjimkou byl výskyt preeklampsie u nositelek mutace pro F II v homozygotní konstituci (tab. 4).
DISKUSE
V naší studii jsme se snažili vyšetřit výskyt trombofilních mutací u matky i novorozence v souvislosti s výskytem závažných těhotenských komplikací. Zaměřili jsme se zejména na dvě nejzávažnější trombofilní mutace, a to na mutaci F V Leiden a protrombinovou mutaci.
Ve srovnání s některými dřívějšími pracemi [5, 9, 11] jsme neprokázali souvislost výskytu závažné těhotenské patologie s přítomností trombofilních mutací. Dizon–Townsend a kol. prokázali zvýšenou incidenci mutace F V Leiden u 158 žen s těžkou preeklampsií z Utahu (4,2 % vs. 8,9 %, p = 0,03) [2]. Kupferminc a kol. zjistili zvýšený výskyt mutace F V Leden a protrombinové mutace u žen s pozdními těhotenskými komplikacemi v Izraeli [5]. Grandone a kol. prokázali zvýšenou incidenci mutace F V Leiden a MTHFR v italské populaci žen se závažnými těhotenskými komplikacemi [3].
Na druhou stranu řada prací neprokázala zvýšenou incidenci vrozených trombofilních mutací u závažných těhotenských komplikací [1, 7, 8, 12]. Ve velké studii z východní Anglie [8] nebyl zvýšený výskyt trombofilních mutací u 238 žen se závažnými komplikacemi ve srovnání s kontrolním souborem. Murphy a kol. nenašli souvislost pozdních těhotenských komplikací s výskytem trombofilních mutací vyšetřovaných při první návštěvě v těhotenské poradně v irské populaci. Jednalo se o prospektivní studii [7]. Ani De Groot a kol. neprokázali souvislost mezi mutacemi F V Leiden a protrombinu u 163 žen s těžkými těhotenskými komplikacemi, které sledovali na Leiden University v Holandsku. Validita závěrů této práce byla ovšem omezená vzhledem k zařazení žen s lehkou preeklampsií a žen s hypertenzí bez proteinurie [1].
Naše výsledky se shodují s druhou ze jmenovaných skupin prací. Jak mutace F V Leiden, tak mutace F II vykazují závislost na rase, v našem souboru se téměř výhradně vyskytovaly ženy europoidní rasy. V tomto směru byl náš soubor výrazně homogenní na rozdíl od prací pocházejících např. z USA, kde je populace rasově pestřejší, což může ovlivnit výskyt trombofilních mutací i u žen s těhotenskými komplikacemi.
Klinická manifestace trombofilie může být výsledkem souhry genetické predispozice s celou řadou zevních faktorů (kouření, hormonální kontracepce, obezita apod.). Do hry může vstupovat i specifické genetické pozadí konkrétní populace.
ZÁVĚR
Naše výsledky nepodporují rutinní nákladný screening trombofilních mutací u žen s anamnézou závažných těhotenských komplikací. V současné době neexistují přesvědčivé důkazy podporující profylaktickou léčbu heparinem nebo kyselinou acetylosalicylovou u žen s prokázanou trombofilní mutací bez výskytu hluboké žilní trombózy v anamnéze.
Rovněž doporučení profylaktického podávání antikoagulační léčby jako prevence závažných těhotenských komplikací (preeklampsie, IUGR, abrupce placenty nebo intrauterinní smrti plodu) musí být ještě podpořeno výsledky velkých prospektivních studií.
Každodenní subkutánní aplikace nízkomolekulárního heparinu je pro ženu nepříjemná a stresující a v neposlední řadě jde o velmi nákladnou terapii. Měli bychom k ní tedy přistupovat jen pokud jsme přesvědčeni o benefitu pro těhotnou ženu a její plod.
Práce vznikla za podpory grantu IGA MZ CR NS9905-3
MUDr. Blanka Vavřinková
Gynekologicko-porodnická klinika
2. LF UK a FN Motol
V Úvalu 85
150 00 Praha 5
Zdroje
1. De Groot, CJ., Bloemenkamp, KW., Duvekot, EJ., et al. Preeclampsia and genetic risk factors for thrombosis: a case-control study. Am J Obstet Gynekol, 1999, 181, p. 975–980.
2. Diazon-Towsend, DS., Nelson, LM., Easton, K., Ward, K. The factor V Leiden mutation may predispose women to severe preeclampsia. Am J Obstet Gynecol, 1996, 175, p. 902–905.
3. Grandone, E., Margaglione, M., Collaizzo, D., et al. Factor V Leiden, C>T MTHFR polymorphism and genetic susceptibility to preeclampsia. Tromb Haemost, 1997, 77, p. 1052–1054.
4. Hájek, Z. Rizikové a patologické těhotenství. 1. vyd. Praha: Grada, 2004, s. 176–177.
5. Kupferminc, MJ., Eldor, A., Steinman, N., et al. Increased frequency of genetic trombophilia in women with complication of pregnancy. N Engl J Med, 1997, 340, p. 9–13.
6. Kvasnička, J. Trombofilie a trombotické stavy v klinické praxi. Praha: Grada, 2003, s. 57.
7. Murphy, RP., Donoghue, C., Nallen, RJ., et al. Prospective evaluation of the risk conferred by factor V Leiden and thermolabile MTHFR polymorphism in pregnancy. Arterioscler Tromb BASF Biol, 2000, 20, p. 266–270.
8. O’Shaughnessy, KM., Fu, B., Ferraro, F., et al. Factor V Leiden and thermolabile MTHFR gene variants in an East Anglian preeclampsia cohort. Hypertension, 1999, 33, p. 1338–1341.
9. Preston, FE., Rosendaal, FR., Walker, ID., et al. Increased fetal loss in women with heritable thrombophilia. Lancet, 1996, 348, p. 913–916.
10. Raušová, E., Hadačová, I., Macek, M. Hereditární trombofilie – jeden z modelů molekulární medicíny. Klin Biochem Metab, 2005, 13 (34), 2, p. 68–76.
11. Van der Molen, EF., Verbuggen, B., Novakova, I., et al. Hyperhomocysteinemia and other thrombotic risk factors in women with placenta vaskulopathy. Br J Obstet Gynaecol, 2000, 107, p. 785–791.
12. Van Pampus, MG., Dekker, GA., Wolf, H., et al. High prevalence of haemostatic abnormalities in women with a history of severe preeclampsia. Am J Obstet Gynecol, 1999, 180, p. 1146–1150.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2012 Číslo 2
-
Všechny články tohoto čísla
- Laparoskopicky asistovaná neoplastika pochvy podle Vecchiettiho
- Vliv aplikace GnRH analog na peroperační a postoperační výsledky myomektomie u žen v reprodukčním věku
- Kryokonzervace ovariální tkáně u onkologických pacientek – 6 let klinických zkušeností
- Vedení porodu po předchozím císařském řezu, analýza výsledků z let 2007–2010
- Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit
- Nové metody zvyšující úspěšnost asistované reprodukce
- Kortikotropin-releasing hormon a adrenokortikotropní hormon – možné markery některých těhotenských patologií
- Imunoterapie karcinomu ovaria
- Těhotenství a porod zdravého dítěte komplikované koincidencí heterotopické gravidity po IVF a placenty perkrety s následnou hysterektomií
- Fetomaternální hemoragie při porodu císařským řezem
- Medicínské, právní a etické aspekty zachování fertility u onkologických pacientek
- Uroinfekce v graviditě – kdy léčit, jak léčit a čím léčit
- Výskyt trombofilních mutací u žen se závažnými těhotenskými komplikacemi
- Možnosti IVF v nativním cyklu
- Editorial
- Historie a současnost Gynekologicko-porodnické kliniky v Brně
- Screening v 11.–13.+6 týdnu těhotenství
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Triple negativní karcinom prsu – prognosticky vysoce závažná skupina mamárních malignit
- Možnosti IVF v nativním cyklu
- Uroinfekce v graviditě – kdy léčit, jak léčit a čím léčit
- Vedení porodu po předchozím císařském řezu, analýza výsledků z let 2007–2010