Karcinom cervixu – možnosti detekce lidského papilomaviru
Cervical cancer – possibilities of detection of human papillomavirus
Objective:
To describe the possibility of detection of HPV DNA in cervical cancer.
Design:
Review.
Setting:
Institute of Molecular and Translational Medicine, Laboratory of Experimental Medicine, Palacky University and University Hospital Olomouc.
Methods:
Human papillomavirus (HPV) is the cause of many cancers, especially cervical cancer. Current cervical cancer screening is based on cytological examination, which is followed by HPV DNA diagnostics only in cases with abnormal results of uncertain significance. Methods used for HPV detection are often based on PCR reaction followed by genotyping (complete or partial). HPV DNA diagnostics isn´t currently included into the primary cervical cancer screening in the Czech Republic although it has higher sensitivity than cytology.
Conclusion:
Inclusion of HPV DNA testing into the primary cervical cancer screening would significantly increase its sensitivity and thus would help to reduce the morbidity and mortality of this disease in Czech population.
Keywords:
human papillomavirus – HPV – cervical carcinoma – cervical cancer screening – cytology – LBC – PCR
Autoři:
H. Ondryášová; V. Koudelakova; M. Hajdúch
Působiště autorů:
Laboratoř experimentální medicíny, Ústav molekulární a translační medicíny, LF UP a FN, Olomouc, vedoucí doc. MUDr. M. Hajdúch. Ph. D.
Vyšlo v časopise:
Ceska Gynekol 2013; 78(3): 289-294
Souhrn
Cíle studie:
Popsat možnosti detekce HPV DNA u cer-vikálního karcinomu.
Typ studie:
Přehledový článek.
Název a sídlo pracoviště:
Ústav molekulární a translační medicíny, Laboratoř experimentální medicíny, LF UP a FN Olomouc.
Metodika a výsledky:
Lidský papilomavirus (HPV) je příčinou řady nádorových onemocnění, především karcinomu cervixu. Současný screening karcinomu cervixu je založen na cytologickém vyšetření, které je v případech s abnormálním výsledkem nejistého významu doplněno HPV DNA diagnostikou. HPV detekující metody jsou nejčastěji založeny na PCR reakci s následnou genotypizací (úplnou či částečnou). Přestože má HPV DNA diagnostika vyšší senzitivitu v porovnání s cytologií, není v současné době v České republice zařazena do primárního screeningu cervikálního karcinomu.
Závěr:
Zařazení HPV DNA testů do primárního scree-ningu karcinomu cervixu by významně zvýšilo jeho senzitivitu, a napomohlo by tak ke snížení morbidity i mortality tohoto onemocnění v české populaci.
Klíčová slova:
lidský papilomavirus – HPV – karcinom cervixu – screening cervikálního karcinomu – cytologie – LBC – PCR
PREVALENCE HPV INFEKCE
Infekce lidským papilomavirem (HPV) patří mezi nejrozšířenější pohlavně přenosné choroby. HPV je vysoce infekční, často bezpříznakové onemocnění s inkubační dobou 1–8 měsíců. Prevalence HPV infekce se v jednotlivých studiích značně liší v závislosti na geografii, věku zkoumané populace a citlivosti použitých detekčních metod. Vyhodnocení celoživotní prevalence ukazuje, že s HPV infekcí se během svého života setká přibližně 80 % sexuálně aktivních jedinců. Nejčastěji k tomu dochází krátce po začátku sexuálního života. Nejvyšší prevalence je ve věkové skupině do 25 let a je výrazně vyšší u skupiny jedinců se 3 a více sexuálními partnery. Ve většině případů je HPV infekce během 12–18 měsíců eliminována imunitním systémem (clearance virové DNA). Přibližně u 10 % HPV pozitivních jedinců dochází k perzistenci HPV infekce a u méně než 1 % z nich k vývoji cervikálního karcinomu [6, 9, 11]. HPV se podle míry onkogenního potenciálu dělí na high risk (hrHPV) a low risk (lrHPV). HPV subtypy jednotlivých skupin jsou uvedeny v tabulce 1. Pro vznik karcinomu cervixu je nezbytná infekce alespoň jedním onkogenním podtypem hrHPV [7]. V HPV indukované kancerogenezi je zásadním krokem integrace HPV DNA do lidského genomu, která vede k chromozomální instabilitě, fragmentaci HPV DNA v oblasti E2 genu (v některých případech rovněž E1 nebo L1 genu), nadměrné expresi E6 a E7 onkogenů a progresi onemocnění. K časté integraci dochází u HPV16 a 18, které jsou zároveň nejvíce onkogenní a zodpovědné za většinu případů karcinomu cervixu [17, 23, 24].
![Rozdělení HPV podle míry onkogenního vlivu na vznik karcinomu cervixu [18]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/6735d20d33bf9a2359e71e7168dccef1.png)
KARCINOM CERVIXU
Celosvětově je karcinom cervixu u žen třetím nejčastějším nádorovým onemocněním a čtvrtou nejčastější příčinou jejich úmrtí na nádorová onemocnění. K 85 % případů karcinomu cervixu a s ním spojených úmrtí dochází v rozvojových zemích, kde neexistuje screeningový program, který by umožnil včasnou detekci prekanceróz nebo časných stadií karcinomu [14, 19]. V České republice je každý rok nově diagnostikováno přes 1000 nových případů karcinomu cervixu a přibližně 400 pacientek s touto diagnózou ročně zemře. Věkově specifická incidence začíná výrazně růst od 29. roku života, vrcholu dosahuje ve věkové skupině 40–44 let [10]. Vztah mezi infekcí hrHPV podtypy a karcinomem cervixu je nezpochybnitelný, 99,7 % karcinomů cervixu je HPV pozitivních. Nejrozšířenější hrHPV podtypy jsou HPV16 a 18, vyskytující se u přibližně 70 % karcinomů cervixu [7, 24].
Globálně je infekce hrHPV příčinou přibližně 10 % karcinomů vyskytujících se u žen a více než 5 % všech nádorových onemocnění [14, 19]. Mimo karcinomu cervixu je infekce hrHPV spojená se vznikem karcinomu vulvy, vaginy, penisu, konečníku, kůže, dutiny ústní, orofarynxu a laryn-xu. HPV DNA byla také detekována v nádorech ezofagu, plic, tlustého střeva, vaječníků, prsu, prostaty, močového měchýře a nosní dutiny. Vliv hrHPV infekce na vznik těchto typů nádorů však není zcela objasněn [19].
SCREENING CERVIKÁLNÍHO KARCINOMU V ČESKÉ REPUBLICE
V České republice je screening karcinomu děložního hrdla upravován věstníkem ministerstva zdravotnictví č. 07/2007. Podle doporučení ministerstva zdravotnictví by mělo být cytologické scree-ningové vyšetření prováděno dospělým ženám při pravidelné gynekologické prohlídce jednou ročně. Pro screeningové vyšetření se používá cer-vikální cytologie (Pap test nebo jeho modifikace), kdy jsou buňky z odběrového kartáčku naneseny na sklo, obarveny a hodnoceny pod mikroskopem. Pro hodnocení nálezů cervikální cytologie je v současné době platný systém Bethesda 2001 [20]. Zdokonalením Pap testu je Liquid-based cytology (LBC), kdy jsou buňky stěru solubilizovány ve vhodném médiu a následně naneseny na mikroskopické sklo. LBC zvyšuje senzitivitu vyšetření díky odstranění rušivého vlivu krve či hlenu při klasickém Pap testu, test je navíc lépe hodnotitelný díky rovnoměrnému rozmístění buněk v jedné vrstvě a je použitelný k dalšímu testování, např. k HPV DNA diagnostice.
Problémem cervikální cytologie je vysoká míra falešné negativity, která je udávána u 15–35 % CINIII (cervical intraepithelial neoplasia, grade 3) a karcinomu cervixu [12]. Mnohem efektivnější jsou metody založené na detekci HPV DNA, které jsou schopné zachytit přes 99 % prekancerotických změn a nádorů [5].
HPV DNA SCREENING
Přínos HPV DNA diagnostiky byl jednoznačně potvrzen klinickou studií ATHENA (Addressing THE Need for Advanced HPV diagnostics). Do studie bylo zařazeno více než 47 000 žen starších 21 let, u nichž byly srovnávány výsledky LBC a HPV DNA diagnostiky. Tato studie ukázala na vyšší citlivost HPV DNA diagnostiky na úkor nižší specificity, která byla pravděpodobně ovlivněna zařazením žen nižších věkových skupin. Vzhledem k vysokému výskytu HPV infekce a následné clearance viru u mladších žen by měly být pomocí HPV DNA diagnostiky vyšetřovány pouze ženy nad 30 let. Ideální screening by měl zahrnovat jak LBC, tak HPV testování [4, 21]. HPV testování poskytuje velmi vysokou negativní prediktivní hodnotu (NPV), která při souběžném použití cytologie umožňuje prodloužit screeningový interval až na 6 let [8]. V současné době jsou v České republice k HPV DNA diagnostice zasílány pouze případy s abnormální cytologií s neznámým významem (atypical squamous cells of undetermined significance; ASC-US), vyskytující se přibližně u 4 % případů [1].
Zavedení celoplošného screeningu celosvětově výrazně snížilo incidenci i mortalitu cervikálního karcinomu. Česká republika bohužel stále patří mezi státy s nedostatečně funkčním screeningovým programem, kdy se screeningu účastní přibližně polovina cílové populace [16]. Řešením pro ženy, které z nějakého důvodu nenavštěvují gynekologa, by mohlo být použití samoodběrové sady v podobě tamponů, samoodběrových cervikovaginálních kartáčků nebo laváží. V několika studiích byla prokázaná vysoká shoda hrHPV detekce mezi vzorky získanými samoodběrem a cervikálním stěrem provedeným gynekologem [3, 22].
HPV DNA TESTY S IVD CERTIFIKACÍ
Při HPV DNA testu může být detekována pouze přítomnost některého z hrHPV nebo může docházet k částečné či úplné genotypizaci. Většina metod detekujících HPV DNA je založena na polymerázové řetězové reakci (PCR), která využívá primery detekující různé části HPV genomu, jako MY09/MY11, GP5+/6+, SPF10 (detekce HPV genu L1), CP primery (detekce HPV genu E1)[2,15] nebo pU primery (detekce HPV genů E6 a E7) [13]. Pomocí klasické PCR reakce se specifickými HPV primery je možné detekovat pouze přítomnost HPV DNA, nikoli odlišit jednotlivé podtypy. Pro genotypizaci jsou nejčastěji použity metody založené na značení primerů (biotin) a následné ELISA reakci (enzyme-linked immunosorbent assay), real-time PCR se značenými próbami, popř. hybridizaci PCR produktů se specifickými oligonukleotidovými próbami fixovanými na stripu (line blot) nebo čipu (microarray). Jednotlivé metodiky, které jsou certifikovány jako in vitro diagnostikum (CE-IVD) a schváleny pro detekci HPV u cervikálních buněk jsou shrnuty v tabulce 2.
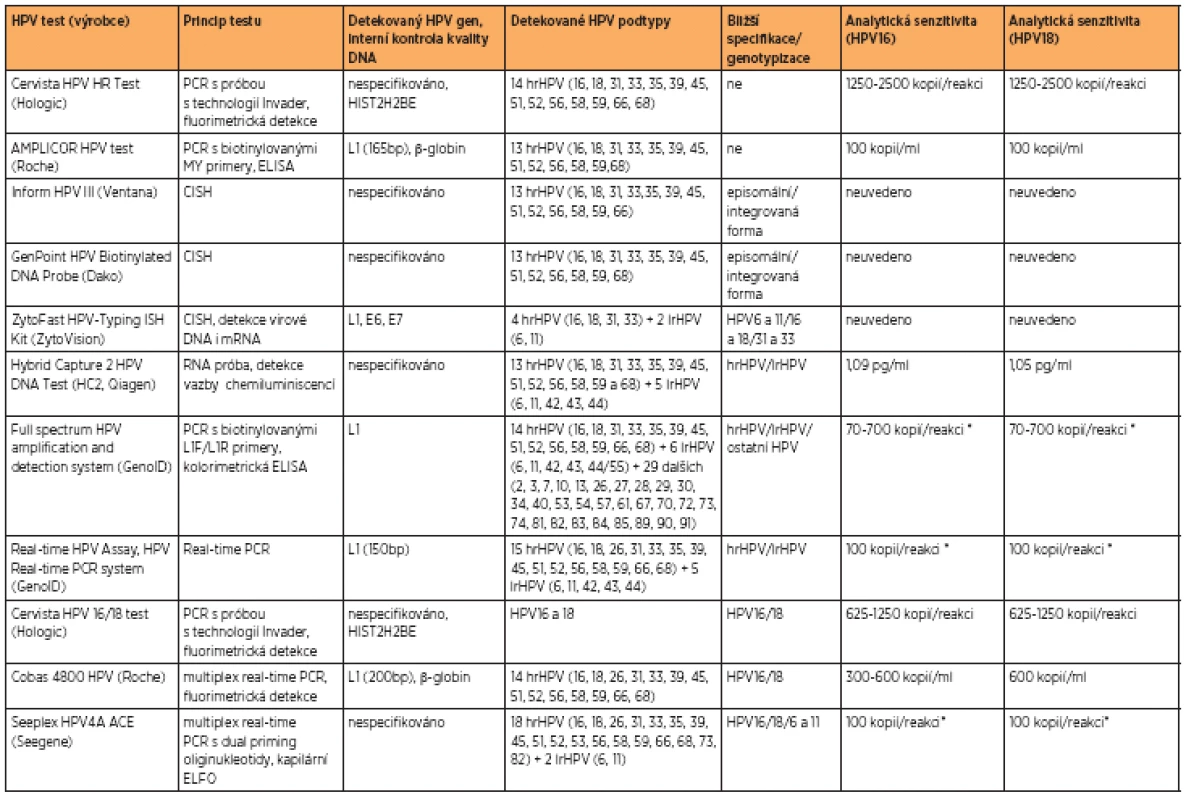

Mnoho metod umožňuje detekci přítomnosti hrHPV podtypů, některé z nich umožňují jejich úplnou genotypizaci. Z klinického hlediska je nejvýznamnější detekce hrHPV a genotypizace nejvíce onkogenních podtypů HPV16 a 18 [7]. Některé firmy (Roche, Seegene) proto uvedly na trh systémy určené k částečné genotypizaci HPV. Jde většinou o automatizované metody založené na real-time PCR s próbami specifickými pro HPV16 a 18 a próbou pro ostatní typy HPV. Tyto metody se zdají být pro klinickou praxi nejvhodnější, poskytují informaci o přítomnosti širokého spektra hrHPV, blíže specifikují přítomnost HPV16 a 18, jsou automatizované, tedy do značné míry eliminují chyby způsobené lidským faktorem a umožňují rychlou analýzu vysokého počtu vzorků v krátkém čase. Některé systémy jsou také spojené s automatickou izolací DNA ze vzorku (např. Cobas 4800, Roche). Téměř všechny HPV DNA testy jsou kompatibilní s odběrovými médii PreservCyt a SurePath.
Problémem většiny HPV DNA testů může být jejich cílení na HPV gen L1. Při integraci viru do lidského genomu v některých případech dochází k rozpadu fragmentu L1. V těchto případech je možnost falešné negativity výsledků, a může tak dojít k opominutí nejzávažnějších případů [17, 23, 24].
ZÁVĚR
HPV DNA testy jsou vhodné pro primární screening karcinomu cervixu, mají vyšší senzitivitu než cytologické vyšetření, nulovou subjektivitu a je možné je spolehlivě automatizovat. Zahrnutí HPV DNA diagnostických metod do rutinního screeningového programu by výrazně snížilo morbiditu i mortalitu karcinomu děložního čípku. HPV DNA diagnostika je ideální metodikou primárního cervikálního screeningu pro ženy nad 30 let, která však v současné době není v České republice hrazená z prostředků veřejného zdravotního pojištění. Velkým problémem screeningového programu je rovněž malá účast českých žen, se kterou souvisí vysoký výskyt karcinomu cervixu v porovnání se zeměmi západní Evropy. V současné době se nabízí dvě možnosti, a to adresné zvaní k vyšetření a zavedení kvalitního vyšetření vzorků získaných samoodběrem.
Práce byla podpořena granty IGA UP LF_2013_015 a Biomedreg CZ.1.05/2.1.00/01.0030.
Mgr. Hana Ondryášová
Laboratoř experimentální medicíny
Ústav molekulární a translační medicíny
LF UP a FN
Hněvotínská 5
779 00 Olomouc
e-mail: ondryasova.hana@gmail.com
Zdroje
1. Arbyn, M., Anttila, A., Jordan, J., et al. European Guidelines for Quality Assurance in Cervical Cancer Screening. Second ed. – summary document. Ann Oncol, 2010, 21, p. 448–458.
2. Baay, MF., Quint, WG., Koudstaal, J., et al. Comprehensive study of several general and type-specific primer pairs for detection of human papillomavirus DNA by PCR in paraffin-embedded cervical carcinomas. J Clin Microbiol, 1996, 34, p. 745–747.
3. Castle, PE., Gage, JC., Partridge, EE., et al. Human papillomavirus genotypes detected in clinician-collected and self-collected specimens from women living in the Mississippi Delta. BMC Infect Dis, 2013, 13, p. 5.
4. Castle, PE., Stoler, MH., Wright, TC., Jr., et al. Performance of carcinogenic human papillomavirus (HPV) testing and HPV16 or HPV18 genotyping for cervical cancer screening of women aged 25 years and older: a subanalysis of the ATHENA study. Lancet Oncol, 2011, 12, p. 880–890.
5. Chaiwongkot, A., Pientong, C., Ekalaksananan, T., et al. Evaluation of primers and PCR performance on HPV DNA screening in normal and low grade abnormal cervical cells. Asian Pac J Cancer Prev, 2007, 8, p. 279–282.
6. de Sanjose, S., Diaz, M., Castellsague, X., et al. Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology: a meta-analysis. Lancet Infect Dis, 2007, 7, p. 453–459.
7. de Sanjose, S., Quint, WG., Alemany, L., et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study. Lancet Oncol, 2010, 11, p. 1048–1056.
8. Dillner, J., Rebolj, M., Birembaut, P., et al. Long term predictive values of cytology and human papillomavirus testing in cer-vical cancer screening: joint European cohort study. BMJ, 2008, 337, p. 1754.
9. Dunne, EF., Nielson, CM., Stone, KM., et al. Prevalence of HPV infection among men: A systematic review of the literature.J Infect Dis, 2006, 194, p. 1044–1057.
10. Dušek, L., Mužík, J., Kubásek, M., et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [cit. 2013-3-18]. Dostupný z WWW: http://www.svod.cz. Verze 7.0 [2007], ISSN 1802 – 861.
11. Fernandes, JV., Araújo, JMG., Fernandes, TAAM. Biology and natural history of human papillomavirus infection. Open Access J Clin Trials, 2013, 5, p. 1–12.
12. Gibb, RK., Martens, M.G. The impact of liquid-based cytology in decreasing the incidence of cervical cancer. Rev Obstet Gynecol, 2011, 4, p. S2–S11.
13. Hermonat, PL., Han, L., Wendel, PJ., et al. Human papillomavirus is more prevalent in first trimester spontaneously aborted products of conception compared to elective specimens. Virus Genes, 1997, 14, p. 13–17.
14. Jemal, A., Bray, F., Center, MM., et al. Global cancer statistics. CA Cancer J Clin, 2011, 61, p. 69–90.
15. Jeney, C., Takacs, T., Sebe, A., et al. Detection and typing of 46 genital human papillomaviruses by the L1F/L1R primer system based multiplex PCR and hybridization. J Virol Methods, 2007, 140, p. 32–42.
16. Májek, O., Daneš, J., Zavoral, M., et al. Aktuální výsledky programů screeningu zhoubných nádorů. Lékařské listy – Příloha Zdravotnických novin, 2011, 60, p. 5–8.
17. Morris, BJ. Cervical human papillomavirus screening by PCR: advantages of targeting the E6/E7 region. Clin Chem Lab Med, 2005, 43, p. 1171–1177.
18. Munoz, N., Bosch, FX. de, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer.N Engl J Med, 2003, 348, p. 518–527.
19. Parkin, DM. The global health burden of infection-associated cancers in the year 2002. Int J Cancer, 2006, 118, p. 3030–3044.
20. Solomon, D., Davey, D., Kurman, R., et al. The 2001 Bethesda System: terminology for reporting results of cervical cytology. JAMA, 2002, 287, p. 2114–2119.
21. Stoler, MH., Wright, TC. Jr., Sharma, A., et al. High-risk human papillomavirus testing in women with ASC-US cytology: results from the ATHENA HPV study. Am J Clin Pathol, 2011, 135, p. 468–475.
22. van Baars, R., Bosgraaf, RP., ter Harmsel, BW., et al. Dry storage and transport of a cervicovaginal self-sample by use of the evalyn brush, providing reliable human papillomavirus detection combined with comfort for women. J Clin Microbiol, 2012, 50, p. 3937–3943.
23. Vinokurova, S., Wentzensen, N., Kraus, I., et al. Type-dependent integration frequency of human papillomavirus genomes in cervical lesions. Cancer Res, 2008, 68, p. 307–313.
24. Walboomers, JM., Jacobs, MV., Manos, MM., et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol, 1999, 189, p. 12–19.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2013 Číslo 3
-
Všechny články tohoto čísla
- Oznámení
- Dysfunkce endotelu u těhotných s chronickou formou hypertenze
- Vliv ohřátých infuzních roztoků při plánovaném císařském řezu na matku a plod – pilotní randomizovaná prospektivní studie
- Chirurgická léčba gynekologických onemocnění u Svědkyň Jehovových
- Výskyt latentní asymptomatické celiakie u žen se sníženou plodností
- Perzistence užívání léčby hyperaktivního močového měchýře v České republice
- Radioterapie v léčbě karcinomu vulvy
- Expresia karbonickej anhydrázy IX v karcinómoch prsníka
-
Psychosociální klima porodnice očima rodiček II.
Prediktory spokojenosti s perinatální péčí v České republice - Intrahepatální cholestáza v těhotenství
- Stanovení anti-Müllerova hormonu u žen
- Karcinom cervixu – možnosti detekce lidského papilomaviru
- Profylaktické užití antiinfekčních léčiv v porodnictví
- Solitární fibrózní tumor endometria – kazuistika
- Peripartální kardiomyopatie po císařském řezu – kazuistika
- Vzpomínka na profesora MUDr. et RNDr. Miloslava Talaše, DrSc.
- Prof. MUDr. Milan Kudela, CSc. – sedmdesátiletý
-
Olomouc course, autumn 2013
Publishing a scientific medical article
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Intrahepatální cholestáza v těhotenství
- Stanovení anti-Müllerova hormonu u žen
- Prof. MUDr. Milan Kudela, CSc. – sedmdesátiletý
- Profylaktické užití antiinfekčních léčiv v porodnictví
