Genetické aspekty defektov panvového dna a stresovej močovej inkontinencie u žien
Genetic aspects of pelvic floor defects and stress urinary incontinence in women
Objective:
An overwiev of the genetic aspects of pelvic floor defects and stress urinary incontinence in women.
Design:
A review article.
Setting:
Department of Gynecology and Obstetrics, Jessenius Faculty of Medicine in Martin, Comenius University in Bratislava, Slovak Republic.
Methods:
An analysis of the literature using database search engines PubMed, BLAST and Ensembl in field of POP and SUI.
Results:
Pelvic organ prolapse (POP) and stress urinary incontinence (SUI) affect a large number of women and often requires surgical correction. Moreover, these diseases are not only individual health but also social and economic burden on patients and society. It is possible to prevent or at least timely intervene these pathologies by screening of risk patients. The incidence of these disorders leads to find possible genetic factors. In ethiopathogenetic studies of pelvic floor defects and stress urinary incontinence it is looking for genes associated with these diseases and optimization of molecular biology methods is necessary to determine the possible gene mutations or polymorphism site. Selection of relevant genetic factors tend to clarify the pathomechanism of SUI and POP that can greatly affect their current diagnostics and therapeutics.
Keywords:
prolapse, stress urinary incontinence, polymorphism, gene expression
Autoři:
P. Lukáč 1; K. Biringer 1; J. Siváková 1; M. Hrtánková 1; Z. Lasabová 2; J. Danko 1
Působiště autorů:
Gynekologicko-pôrodnícka klinika JLF UK a UNM, Martin, Slovenská republika, prednosta prof. MUDr. J. Danko, CSc.
1; Ústav molekulovej biológie JLF UK a UNM, Martin, Slovenská republika, vedúca doc. RNDr. Z. Lasabová, PhD.
2
Vyšlo v časopise:
Ceska Gynekol 2014; 79(5): 382-387
Souhrn
Cieľ práce:
Prehľad publikácií o genetických aspektoch defektov panvového dna a stresovej močovej inkontinencie u žien.
Typ štúdie:
Prehľadový článok.
Názov a sídlo pracoviska:
Gynekologicko-pôrodnícka klinika Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Slovenská republika.
Metodika štúdie:
Analýza publikácií vyhľadaných v databázach PubMed, BLAST a Ensembl zameraných na POP a SUI.
Záver:
Prolaps panvových orgánov (POP) a stresová močová inkontinencia (SUI) postihujú značné množstvo žien a často vyžadujú chirurgickú korekciu. Navyše, tieto ochorenia predstavujú nie len indivi-duálnu zdravotnú, ale aj sociálnu a ekonomickú záťaž pacientky a celej spoločnosti. Cieleným vyhľadávaním rizikových pacientok je možné predchádzať, alebo aspoň včasne intervenovať pri uvedených patologických stavoch. Výskyt týchto porúch vedie k nájdeniu možných genetických faktorov. V štúdiu etiopatogenézy defektov panvového dna a stresovej močovej inkontinencie sa hľadajú gény spojené s týmito ochoreniami a optimalizujú sa metódy molekulovej biológie potrebné pre určenie možných génových mutácií a polymorfizmov. Výber relevantných genetických faktorov slúži k objasneniu patomechanizmov POP a SUI, môže významne ovplyvniť aj ich aktuálne diagnostické a terapeutické využitie.
Kľúčové slová:
prolaps, stresová močová inkontinencia, polymorfizmus, génová expresia
Úvod
Stresová močová inkontinencia a prolaps panvových orgánov u žien postihujú asi 20 % žien vo veku okolo 45 rokov a až 50 % vo veku 60 rokov a často vyžadujú chirurgickú korekciu. Tieto ochorenia predstavujú nie len individuálnu zdravotnú, ale aj sociálnu a ekonomickú záťaž pacientky a celej spoločnosti. Cieleným vyhľadávaním rizikových pa-cientok je možné predchádzať, alebo aspoň včasne intervenovať pri uvedených patologických stavoch. Na základe súčasných poznatkov sa zdá, že existuje genetická predispozícia pre tieto ochorenia. V štúdiu etiopatogenézy defektov panvového dna a stresovej močovej inkontinencie sa hľadajú gény spojené s týmito ochoreniami a optimalizujú sa metódy molekulovej biológie potrebné pre určenie možných génových mutácií a polymorfizmov [5].
Etiopatogenéza SUI a POP
Medzi doposiaľ známe predisponujúce faktory SUI a POP patria: familiárna predispozícia, pohlavie, rasa (zvýšený výskyt POP u európskej a latinskoamerickej populácie žien oproti nižšiemu výskytu u ázijskej a afroamerickej populácie), anatomické poruchy, neuromuskulárne abnormity. Podporujúcimi faktormi sú obezita, obstipácia, pľúcne ochorenia, fajčenie, uroinfekcie, neurologické ochorenia, stres, menopauza. Za podnecujúce faktory v súčasnosti považujeme graviditu a pôrod. Dekompenzujúcimi faktormi sú vek, demencia, farmakoterapia, polymorbidita a zmeny životného prostredia [4].
Dôvodmi pre hľadanie genetických faktorov SUI a POP sú signifikantne významný výskyt týchto ochorení u matiek postihnutých žien a tiež znalosť, že cisársky rez ako alternatíva vaginálneho pôrodu nemá úplný protektívny účinok voči SUI a POP [12]. Zdá sa, že kľúčovou je porucha extracelulárnej matrix – najmä produkcie a degradácie kolagénových a elastínových vlákien a zmena aktivity metaloproteináz.
Genomika
Ak chceme chápať hlbšie súvislosti medzi genomikou, POP a SUI, musíme objasniť niektoré časti molekulovej biológie, ktoré bezprostredne súvisia a sú potrebné k ďalšiemu štúdiu daného ochorenia, najmä génovú expresiu a transkripčné faktory.
Génová expresia je proces, pri ktorom je genetická informácia uložená v géne prevedená (najčastejšie) do štruktúry proteínu. Regulovaná je na mnohých úrovniach: chromatínová štruktúra, iniciácia transkripcie, posttranskripčné modifikácie, transport mRNA, stabilizácia mRNA,translácia, úpravy proteínov pomocou RNA interferencie. Tento proces je v každom prípade prísne regulovaný, lebo akékoľvek výkyvy v génovej expresii (silnejšia alebo slabšia expresia) môžu mať závažné klinické následky. Transkripčné faktory sú dôležité pre reguláciu génovej expresie. Počet transkripčných faktorov (TF) v organizme sa zvyšuje s veľkosťou genómu [11]. TF sú proteíny, ktoré sa spolupodieľajú na iniciácii transkripcie (prepis dedičnej informácie z génu – z DNA na RNA). Viažu sa na jednotlivé elementy promotora (úsek pred génom), čím uľahčujú väzbu príslušnej RNA-polymerázy. Ich prostredníctvom je génová expresia prispôsobená potrebám bunky či celého organizmu (napríklad hormóny, hypoxia, môžu stimulovať expresiu – transkripciu určitých génov). Toto prispôsobenie môže byť veľmi rýchle, počas hodiny môže vzniknúť až niekoľko tisíc transkriptov jedného úseku DNA. Niektoré TF musia byť najprv aktivované napr. fosforyláciou alebo odstránením inhibítora. Rozlišujeme všeobecné TF – výskyt vo všetkých typoch buniek, špeciálne TF – výskyt len v určitých bunkách, bazálne TF – faktory nutné pre navodenie bazálnej transkripcie (v bunkách s nízkou transkripčnou aktivitou) [14]. Transkripčné väzbové miesta (transcription binding site) v promótorovej oblasti sú špecifické väzbové body pre RNA-polymerázu, ktorá sa podieľa na regulácii expresie (napr. TATA box, CAT box). Transkripčné faktory väčšinou reagujú so svojimi väzobnými miestami za pomoci vodíkových mostíkov a Van der Waalsových síl. Vzhľadom k povahe týchto chemických interakcií sa väčšina TF viaže na DNA špecificky. Avšak nie všetky bázy väzbového miesta musia skutočne reagovať s TF. Niektoré z týchto interakcií môžu byť slabšie než iné. TF sú schopné viazať niekoľko príbuzných sekvencií, každú s inou silou (akokoľvek je hlavný väzbový úsek pre TATA binding protein (TBP) sekvencia TATAAAA, TBP sa môže viazať rovnako na TATATAT alebo TATATAA). Väzba na všetky tieto kompatibilné sekvencie je však nepravdepodobná, nakoľko tu spolupôsobia aj prístupnosť DNA a množstvo kofaktorov. Je teda stále ťažké odhadnúť, kam sa TF nakoniec naviaže [8].
Analýza jednonukleotidových polymorfizmov (SNP) sa stáva kľúčovým výskumom v genomike. Mnoho analýz bolo zameraných na funkčnosť polymorfizmov v kódujúcej oblasti, ktoré dokážu zmeniť význam proteínu a mRNA zostrih. Avšak SNP v nekódujúcej časti regulačného regiónu môžu tiež ovplyvniť dôležitú biologickú reguláciu. V súčasnosti existuje niekoľko databáz pre SNP v nekódujúcich regulačných oblastiach [7]. Na lepšie určenie väzbového miesta transkripčného faktoru môžeme použiť komerčne dostupné programy/databázy Transfac (http://www.biobase - international.com/products) a Jaspar matrix models (http://jaspar.genereg.net/).
Zložky spojivových tkanív a gény, ktoré ich kódujú
Kolagén je hlavnou zložkou spojivových tkanív. Pre jeho funkciu (priečne mostíky) je nevyhnutná lyzyloxidáza (gén LOX). Aminokyselinové zloženie kolagénu je tvorené hlavne aminokyselinami, glycínom, prolínom, hydroxyprolínom a hydroxylyzínom. Posledné dve vznikajú posttranslačnou modifikáciou prolínu a lyzínu za účasti kyseliny askorbovej – vitamínu C. Kolagén sa skladá z reťazca alfa 1 a alfa 2, ktoré sa len málo odlišujú poradím aminokyselín. Reťazce tvoria trojitú špirálu, ktorá sa označuje ako tropokolagén (proteínová trojitá helikálna štruktúra 2× α1 + 1× α2). Je to základná jednotka kolagénu dlhá približne 256 nm. Dodnes je známych 28 kolagénových typov (tabuľka 1), najdôležitejší je kolagén typu I, II, III, IV, a V. Najrozšírenejší je typ I, predstavuje 90 % kolagénu v organizmoch a je prítomný v pokožke, šľachách, kostiach a zuboch. Typ II sa vyskytuje v chrupavkách. Typ III je kolagén embryonálneho vývinu, neskôr je nahradený typom I. Typ IV sa vyskytuje v bazálnej membráne epitelu. Kolagén typu V je charakteristický pre stenu krvných ciev [1].
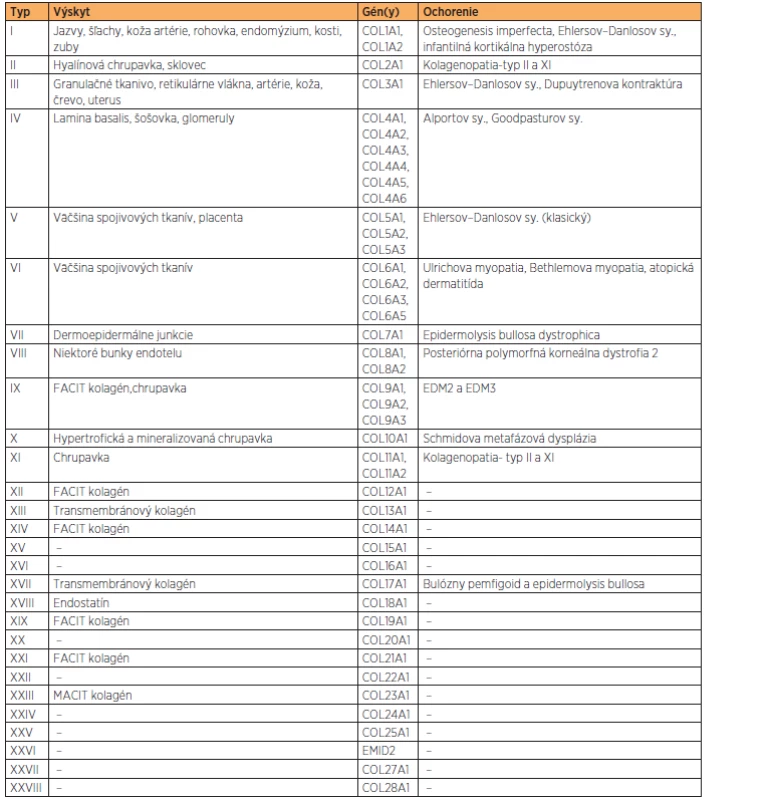
Kolagén je produkovaný predovšetkým väzivovými bunkami (fibroblasty), bunkami chrupavky (chondroblasty), kostnými bunkami (osteoblasty), ale i epitelovými bunkami. Syntéza z časti prebieha vnútri bunky, čiastočne extracelulárne. Polypeptidové reťazce sú syntetizované na hrubom endoplazmatickom retikule. Vzniknutý prokolagén je vylúčený do extracelulárneho priestoru, kde z neho enzým prokolagénpeptidáza odštiepi tropokolagén. Ten reaguje s ostatnými molekulami tropokolagénu a za prítomnosti katalyzátora, ktorým je enzým lyzyloxidáza, vytvára mikrofibrily. Následne po syntéze prechádzajú molekuly kolagénu posttranslačnou modifikáciou, ktorá bielkovine zaistí plnú funkčnosť. Medzi tieto modifikácie patrí aj hydroxylácia, kedy sa hydroxylová skupina viaže v pomere 1 : 1000 aminokyselinových molekúl. Preto je hydroxylácia pre správnu funkciu kolagénu nenahraditeľná [13].
V štúdii, ktorá skúma kolagénovú ultraštruktúru transmisným elektrónovým mikroskopom, bolo preukázané, že hladké svalové pletence sú tenšie u pacientok s POP a SUI, taktiež bola zjavná neusporiadanosť hladkej svaloviny. Stredný obsah kolagénu I a III bol nižší ako u kontrolnej skupiny [16].
V doterajších vedeckých prácach sú SUI a POP spájané s výskytom polymorfizmov génov pre kolagén typu COL1A1 (rs1800012, C>A, MAF: 0,11) a COL3A1 (rs1800255, exon 30, G>A, MAF: 0,21; rs1801184, exon 32, T>C, MAF: 0,23). Vo vybranej štúdii bolo analyzovaných 84 vzoriek od žien s POP a 147 vzoriek v kontrolnej skupine zdravých žien. Podľa analýzy odhadu genotypovej frekvencie bolo zistené, že AA genotyp pre COL3A1 rs1800255 bol častejší u žien s POP (9,5 %), ako u žien bez POP (2 %), preto by mohol byť jedným z rizikových faktorov POP. Mnohí lekári sú konfrontovaní so zvýšeným počtom žien žiadajúcich o cisársky rez ako možnosť prevencie poranenia panvového dna a perinea. Štúdia sa zaoberala jednonukleotidovými polymorfizmami. Výsledok naznačuje, že ženy so zmenou v tomto géne a vekom nad 54 rokov majú signifikantnú predispozíciu pre POP. V skupine s POP bolo 82 % žien po menopauze, z čoho v kontrolnej skupine to bola iba polovica. Študijná vzorka bola relatívne malá, štúdia charakterizovala genotypy a ich vzťahy s POP, okrem transkripčnej regulácie. Posttranslačné modifikácie môžu hrať úlohu v bioaktivite COL3A1 a tým ovplyvňovať citlivosť žien na POP [6].
So vznikom POP a SUI súvisí i funkcia matrixových metaloproteináz (MMP), ktoré sú skupinou enzýmov schopných štiepiť väčšinu komponentov medzibunkovej hmoty. Sú regulované na úrovni transkripcie, translácie alebo prítomnosťou prirodzených inhibítorov. MMP sa zúčastňujú tkanivovej remodelácie, hojenia rán, angiogenézy a nádorového bujnenia. Vysoká úroveň ich expresie alebo aktivácie je spájaná s hojením rán. Rovnako ako pri zápalových cytokínoch sa pri zápalových onemocneniach, akými sú napríklad chronické rany, nachádza aj vysoká aktivita MMP. Rôzne typy buniek (neutrofilné granulocyty, makrofágy, endotelové bunky, keratinocyty alebo fibroblasty) môžu produkovať MMP pri hojení rán, ale i bezprostredne po zranení. Bolo preukázané, že MMP umožňujú prienik a pohyb týchto buniek cez medzibunkovú hmotu [3].
Expresia mRNA matrixovej metaloproteinázy 1 (MMP-1, pozícia 1607 v promotorovej oblasti, rs11292517) je u žien so SUI zvýšená, čo môže viesť k degradácii kolagénu. Do štúdie bolo zahrnutých 137 žien s POP a 96 žien v kontrolnej skupine. Výskyt polymorfizmu v MMP-1 bol výrazne zvýšený u žien s POP v porovnaní s kontrolnou skupinou [4].
Matrixová metaloproteináza 9 (MMP-9) je proteináza spojená s degradáciou kolagénu a elastínu. Vzhľadom k tomu je zvýšená aktivita MMP-9 vo vaginálnom tkanive spájaná s POP. Z komplexných štúdií genetických variant pre riziko pokročilého POP sa preukázali hlavne: rs3918253 a rs3918256. Gén MMP-9 je biologicky prijateľným kandidátom pre POP [17].
Niektoré bunky, predovšetkým epitelové, vylučujú mimobunkový adhézny glykoproteín laminín, ktorý je jednou zo základných bielkovín všetkých bazálnych membrán. Laminín (laminín podjednotka gama-1) je proteín, ktorý je kódovaný génom LAMC1. Je príkladom veľkých adhezívnych glykoproteínov matrixu, nachádza sa najmä v bazálnej membráne, kde viaže epitelové bunky. Skladá sa z troch reťazcov: laminín alfa, beta a gama. Bazálna membrána je tenká vrstva špecializovaného mimobunkového matrixu, ktorý podstiela vrstvy epitelových buniek, obklopuje svalové vlákna, tukové bunky a Schwanove bunky neurónov. Vykonáva tiež úlohu vysoko účinného filtra pri prenose látok. Úloha bazálnej membrány je však oveľa významnejšia. Bazálne membrány sú schopné určovať polaritu buniek, vplývať na bunkový metabolizmus, vyvolávať diferenciáciu buniek a podobne ako v prípade fibropektínu, vytvárať špecifické dráhy pre bunkovú migráciu. Bazálna membrána sa skladá z kolagénu IV a doplnkových špecifických molekúl, ktoré na oboch jej stranách napomáhajú jej pripojeniu na bunky alebo matrix. Týmito špecifickými molekulami sú proteoglykány (obvykle heparan – sulfáty) a glykoproteíny laminín a entaktín. Laminín je veľký (850 kD) komplex z troch veľmi dlhých polypeptidových reťazcov, ktoré vytvárajú podobu kríža a sú udržiavané spolu disulfidovými väzbami. Tak ako fibropektín, aj laminín sa skladá z niekoľkých domén, jedna z ktorých sa pripája na kolagén IV, druhá na heparan – sulfát a ďalšia alebo niekoľko ďalších na bielkovinové receptory laminínu na bunkovom povrchu. Predpokladá sa, že s každou molekulou laminínu sa pevne viaže jedna molekula entaktínu v lokalite spojenia krátkych vetiev „kríža“ s dlhou vetvou. Laminín viaže plazmatickú membránu epitelových buniek k jednej strane bazálnej membrány, zatiaľ čo fibropektín viaže na druhej strane matrix a bunky spojovacích tkanív [2].
Pre gén LAMC1 bola vykonaná štúdia založená na metóde alelickej diskriminácie pre SNP (rs10911193, C>T, MAF: 0,12). SNP a haplotypovo špecifické testy boli použité pre skúmanie asociácie medzi POP, etnickým pôvodom a LAMC1. Celkovo bolo preskúmaných 411 subjektov, 146 Afroameričaniek (63 žien s POP, 83 žien v kontrolnej skupine) a 265 žien bielej rasy (102 žien s POP, 163 žien v kontrolnej skupine). Vekový priemer skúmanej skupiny žien s POP bol 65 rokov a kontrolnej skupiny 60 rokov. Pomer postmenopauzálnych žien s POP bol 90,3 % oproti 78,9 % postmenopauzálnych žienv kontrolnej skupine. Afroamerické ženy mali signifikantne vyšší body-mass-index (BMI) (31,6 ± 6,3 vs 27,9 ± 6,6, p < 0,0001) a tiež paritu (3,5 ± 2,5 vs 2,5 ± 1,2, p < 0,0001) ako ženy bielej rasy. Alelová frekvencia rs10911193, rs20563 a rs20558 bola preukázateľne odlišná pre všetky tri SNP, medzi afroamerickou a bielou rasou: rs10911193 „T“ (4,8 % vs 11,5 %, pomer šancí OR 0,39, 95% CI (0,21,0,71),p = 0,0014), promótor SNP; rs20563 „G“ (39,0 % vs 53,4 %, OR 0,56, 95% CI (0,42, 0,75), p < 0,0001), ktorá produkuje tzv. non-synonymous substitúciu (zmena, ktorá mení aminokyselinové sekvencie proteínu v kontraste so synonymom náhrady, nemá negatívny vplyv na aminokyselinové sekvencie) Ile458Val a rs20558 „C“ (38,4 % vs 53,6 %, OR 0,54, 95% CI (0,40, 0,72), p < 0,0001), čo je tiež v tzv. non-synonymous substitúcii Leu888Pro. Analýza haplotypov v géne LAMC1 neukázala žiaden súvis s pokročilým štádiom POP. „T“ alela LAMC1 (rs10911193) v promotorovej oblasti je spojená s familiárnou POP a môže byť užitočným markerom pre rozvoj choroby [5].
Degradácia elastínu a elafínu hlavne po menopauze má za následok zvýšené riziko vzniku SUI a POP. Elastín pozostáva z fibrilínu (gén FBN1). Je zložkou elastických spojivových tkanív (napr. močový mechúr, koža). Je pružný a umožňuje mnohým tkanivám v tele obnoviť svoj tvar po na-tiahnutí. Kóduje ho gén ELN. Tento gén kóduje proteín, ktorý je jedným z dvoch zložiek elastických vlákien. Kódovaný proteín je bohatý na hydrofóbne aminokyseliny, ako je glycín a prolín, sú to mobilné hydrofóbne oblasti ohraničené priečnymi väzbami medzi zvyškami lyzínu. Iný názov pre elastín je tropoelastín. Desmozín a izodesmozín zabezpečujú spojenie tropoelastínu [10]. Elafín je inhibítor serínovej proteázy zahrnutý v procese degradácie elastínu. Nachádza sa aj vo fibroblastoch panvových tkanív a jeho zvýšená expresia predstavuje zmenenú celulárnu odpoveď panvových tkanív u žien so SUI s výslednou degradáciou elastínu. Pri SUI dochádza k zníženiu expresie fibrilínu-1 [15]. Vzniknutá strata elasticity môže takto viesť k uretrálnej hypermobilite a následne k SUI. Ďalšia štúdia dokazuje zníženie expresie fibulínu-5 v korelácií s mierou POP, ktorá ukazuje, že elastín a fibulín-5 môžu hrať dôležitú úlohu v patogenéze POP [9]. Taktiež výsledky z Univerzity Shandong naznačujú, že znížená expresia elastínu a zvýšená expresia elafínu vo väzivách môžu pri-spieť k danému ochoreniu [18]. Ďalšie gény a ich produkty, ktoré sa môžu spolupodieľať na vzniku POP a SUI sú: dekorín, lumikan, fibromodulín. Narušenie ich metabolizmu môže viesť k poruche mechanických vlastností spojiva, zvýšenej fragilite spojiva (napr. pri pôrode, zvýšenom intraabdominálnom tlaku) [10].
Záver
Štúdium literárnych zdrojov poukazuje na význam kolagénu pri POP a SUI so zistenou spojitosťou polymorfizmu génu pre kolagén typu 1A1 (gén COL1A1) a 3A1 (gén COL3A1) a taktiež na zvýšenú expresiu mRNA génov MMP-1, MMP-2 a MMP-9 vo vaginálnom tkanive. Ďalšie gény a ich produkty, ktoré sa môžu spolupodieľať na vzniku POP a SUI sú fibrilín-1 (gén FBN1), laminín (gén LAMC1) a elastín (gén ELM). Selekcia relevantných genetických faktorov, ich laboratórna analýza a štatistické spracovanie výstupov z analýz, môžu pomôcť objasniť patomechanizmy SUI a POP u žien, čo môže v budúcnosti ovplyvniť diagnosticko-terapeutický manažment. Dôležitou časťou výskumu bude optimalizácia a zavedenie ďalších metód v molekulovej biológií zameraných na výskyt a popísanie zmieňovaných polymorfizmov, ako aj alelovo špecifickú génovú expresiu.
Táto práca bola podporená projektov VEGA 1/0283/12.
Mgr. Pavol Lukáč
Gynekologicko-pôrodnícka klinika
JLF UK a UNM
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: pavol.lukac@jfmed.uniba.sk
Zdroje
1. Cartailler, JP., Khoshnoodi, J., Alvares, K., et al. Molecular recognition in the assembly of collagens: Terminal noncollagenous domains are key recognition modules in the formation of triple-helical protomers. J Biol. Chem, 2006, 281(50), p. 38117–38121.
2. Čihak, R., et al. Anatomie. 2. vyd. Praha: Grada, 2011, s. 470.
3. Daniels, JT., Cambrey, AD., Occleston, NL., et al. Matrix metalloproteinase inhibition modulates fibroblasts – mediated matrix concentration and collagen production in vitro. Invest Ophthalmol Vis Sci, 2003, 44(3), p. 1104–1110.
4. Ferrari, MM., Rossi, G., Biondi, ML., et al. Type I collagen and matrix metalloproteinase 1, 3 and 9 gene polymorphisms in the predisposition to pelvic organ prolapse. Arch Gynecol Obstet, 2012, 285(6), p. 1581–1586.
5. Chen, C., Hill, LD., Schubert, CM., et al. Is laminin gamma-1 a candidate gene for advanced pelvic organ prolapse. Am J Gynaecol Obstet, 2010, 202(5), p. 505–510.
6. Chen, HY., Chung, YW., Lin, WY., et al. Collagen type 3 alpha 1 polymorphism and risk of pelvic organ prolapse. Am J Obstet Gynecol, 2008, 103(5), p. 55–58.
7. Kim, BC., Kim, W.Y., Park, D., et al. SNP@Promoter: a database of human SNPs (Single Nucleotide Polymorphisms) within the putative promoter regions. BMC BioInformation Center, 2008, 9, S2, p. 1186–1192 .
8. Latchman, DS. Transcription factors: an overview. Int J Biochem Cell Biology, 1997, ISSN 1357–2725.
9. Li, B., Zhang, QF., Lin, XY., et al. Expression and significance of elastin and fibulin-5 in anterior vaginal tissue of women with pelvic organ prolapse. Zhonghua Fu Chan Ke Za Zhi, 2009, 44(7), p. 514–517.
10. Muiznieks, L., Weiss, A., Keeley, F. Structural disorder and dynamics of elastin. Biochem Cell Biol, 2010.
11. Nimwegen, E. Scaling laws in the functional content of genomes. Trends Genet, 2003.
12. Nygaard, I., Turvey, C., Burns, TL., et al. Urinary incontinence and depression in middle-aged United States women. Obstet Gynecol, 2003, 101(1), p. 149–156.
13. Petr, J. Odhalen gen pro „křehké kosti“. (online) 10/2006 (cit . 2014.2.25 http://www.osel.cz/index.php?clanek=2203).
14. Silbernagel, S., Lang, F. Atlas patofyziologie člověka. 1. vyd. Praha: Grada Publishing, 2001, s. 404.
15. Söderberg, MW., Byström, B., Kalamajski, S., et al. Gene expressions of small leucine – rich repeat proteoglycans and fibulin-5 are decreased in pelvic organ prolapse. Mol Hum Reprod, 2009, 15(4), p. 251–257.
16. Wang, L., Han, LY., Li, HL. Etiological study of pelvic organ prolapse and stress urinary incontinence with collagen status and metabolism. Zhonghua Yi Xue Za Zh, 2013, 93(7), p. 500–503.
17. Wu, JM., Visco, AG., Grass, EA., et al. Matrix metalloproteinase-9 genetic polymorphisms and the risk for advanced pelvic organprolapse. Obstet Gynec, 2012, 120(3), p. 587–593.
18. Zhang, SQ., Zhang, LL., Yu, H. Expression of elastin, lysyl oxidase and elafin in the cardinal ligament of women with pelvic organ prolapse. Zhonghua Fu Chan Ke Za Zhi, 2008, 43(9), p. 675–679.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2014 Číslo 5
-
Všechny články tohoto čísla
- Vaginální vedení porodu koncem pánevním po ukončeném 36. týdnu gravidity u selektované skupiny těhotenství – analýza perinatálních výsledků let 2008–2011
- The influence of breach position of the second twinon perinatal outcomes in vaginal births of bichorial - biamniotic twins after 33rd week of gravidity
- Preeklampsie v těhotenství – predikce, prevence a další management
-
Zavedení systému léčby pooperační bolesti po císařském řezu v perinatologickém centru a jeho vyhodnocení:
retrospektivní observační studie - Individualizovaná chirurgická léčba cervikálních prekanceróz
- Psychosomatické aspekty a léčba psychofarmaky v etiopatogenezi karcinomu endometria
- Genetické aspekty defektov panvového dna a stresovej močovej inkontinencie u žien
- Incidence a terapie lymfocyst po provedené systematické pánevní a paraaortální lymfadenektomii – vlastní soubor
- Extramamární Pagetova choroba vulvy – kazuistika
- Předsednictvo ČLS JEP
- Condylomata acuminata (genitální bradavice)
- Herbal terapie v průběhu těhotenství – mýty a fakta
- Významní gynekologové a porodníci pocházející z Klatovska
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Condylomata acuminata (genitální bradavice)
- Preeklampsie v těhotenství – predikce, prevence a další management
- Vaginální vedení porodu koncem pánevním po ukončeném 36. týdnu gravidity u selektované skupiny těhotenství – analýza perinatálních výsledků let 2008–2011
- Extramamární Pagetova choroba vulvy – kazuistika
