Retroperitoneálna lymfangioleiomyomatóza – kazuistiky
Retroperitoneal lymphangioleiomyomatosis – a case reports
Lymphangioleiomyomatosis (LAM) is a rare progressive disease affecting women of childbearing age. The disease is characterised by an abnormal proliferation of immature smooth muscle cells predominantly in the lung. It gradually leads to respiratory failure, and it frequently result in death. Extrapulmonary LAM typically presents with abdominal mass, abdominal pain and chylous ascites. In the case reports we describe two cases of premenopausal females with extrapulmonary LAM. In both cases they occur in pelvic location in the obturator fossa and around the external iliac artery. After surgical procedures patients were primary treated with progesterone. Sirolimus was second-line drugs.
Keywords:
lymphangioleiomyomatosis – chylous ascites – sirolimus
Autoři:
E. Lajtman 1; Miloš Mlynček 1; M. Matejka 1; A. Sládeček 2; I. Langová 2
Působiště autorů:
Gynekologicko-pôrodnícka klinika FN a Univerzita Konštantína Filozofa, Nitra, prednosta prof. MUDr. M. Mlynček, CSc.
1; Ústav patológie FN, Nitra, primár MUDr. A. Sládeček
2
Vyšlo v časopise:
Ceska Gynekol 2013; 78(2): 206-210
Souhrn
Lymfangioleiomyomatóza (LAM) je zriedkavé ochorenie vyskytujúce sa u žien v reprodukčnom veku. LAM je charakterizovaná abnormálnou proliferáciou nezrelých buniek hladkého svalu. Progresívne ochorenie postihuje najmä pľúcny parenchým a môže mať až fatálny koniec. Mimopľúcna forma LAM sa najčastejšie prejavuje bolesťou brucha, nádormi v retroperitoneu a chylóznym ascitom. V kazuistikách opisujeme výskyt dvoch prípadov mimopľúcnej formy LAM. V obidvoch prípadoch išlo o pelvickú lokalizáciu nádorov v oblasti fossa obturatoria a vasa iliaca externa. Pacientky boli po operácii primárne liečené gestagénmi. Sirolimus bol liekom druhej línie.
Klíčová slova:
lymfangioleiomyomatóza – chylózny ascites – sirolimus
ÚVOD
Lymfangioleiomyomatóza (LAM) postihuje ženy najčastejšie v reprodukčnom veku. Ochorenie je typické proliferáciou nezrelých a atypických buniek hladkého svalu najmä v pľúcach [14]. Ide o nádory z perivaskulárnych epiteloidných buniek, tzv. PECómy (perivascular epitheloid cell), ktoré sa vyznačujú zároveň hladkosvalovou i melanocytárnou diferenciáciou [3]. Do tejto skupiny patrí angiomyolipóm (AML), svetlobunkový tumor pľúc („sugar“ tumor), svetlobunkový myomelanocytový nádor ligamentum falciforme a teres hepatis a lymfangioleiomyomatóza [8]. LAM prvýkrát opísali Cornog a Enterline v roku 1966 [4]. Väčšina pacientok má pľúcne príznaky (dyspnoe, hemoptýza, pneumotorax), ale u niektorých sa ochorenie prejavuje spočiatku mimopľúcnymi príznakmi (bolesť brucha, nádory v dutine brušnej a chylózny ascites) [10]. Incidencia LAM je 1–2,6 prípadov na 1 milión žien [18]. Priemerný vek žien v čase stanovenia diagnózy je 41 rokov a celosvetová incidencia je 100 nových prípadov ročne [8]. LAM sa vyskytuje ako samostatné ochorenie alebo v spojení s tuberóznou sklerózou (TSC). V tomto prípade ide o autozomálne dominantne dedičné ochorenie charakterizované epileptickými záchvatmi, mentálnou retardáciou a tumormi mozgu, srdca, kože, kostí, pľúc a obličiek [7]. Ani transplantácia pľúc ako posledná možnosť liečby pre pacientov s respiračnou insuficienciou nerieši pretrvávajúci problém s tvorbou chylózneho ascitu alebo pleurálnej efúzie [19]. Chylózna efúzia sa vyskytuje v 10 až 25 % prípadov LAM [19].
KAZUISTIKA 1
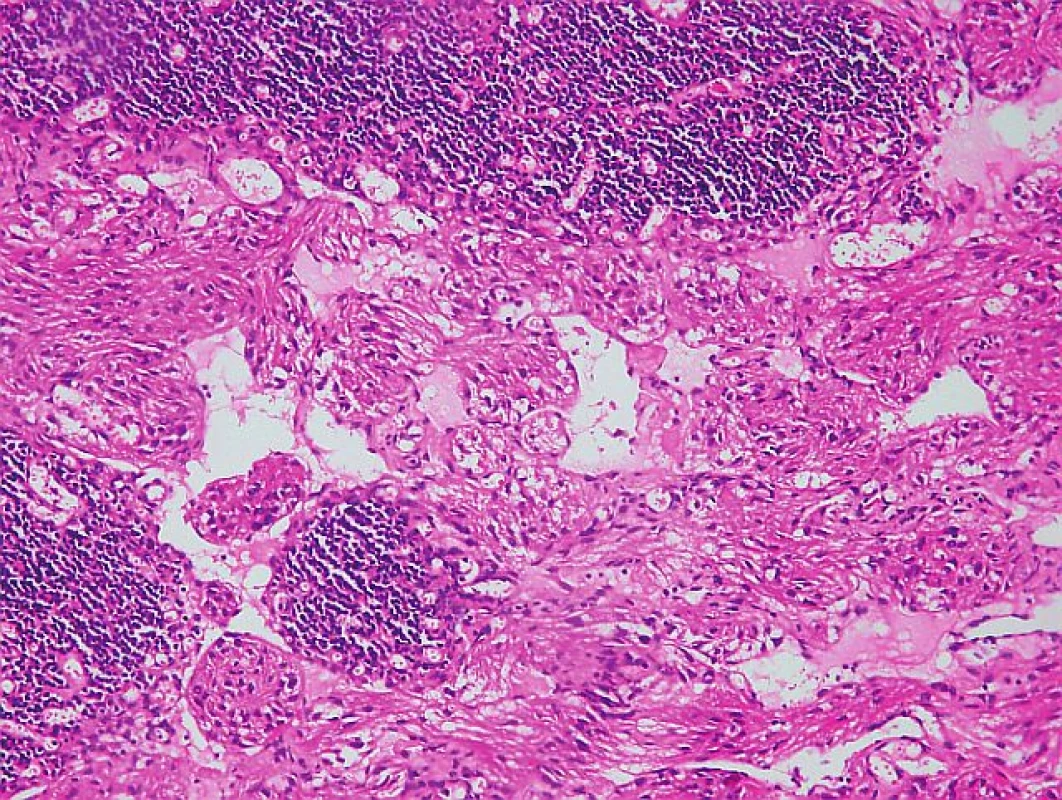
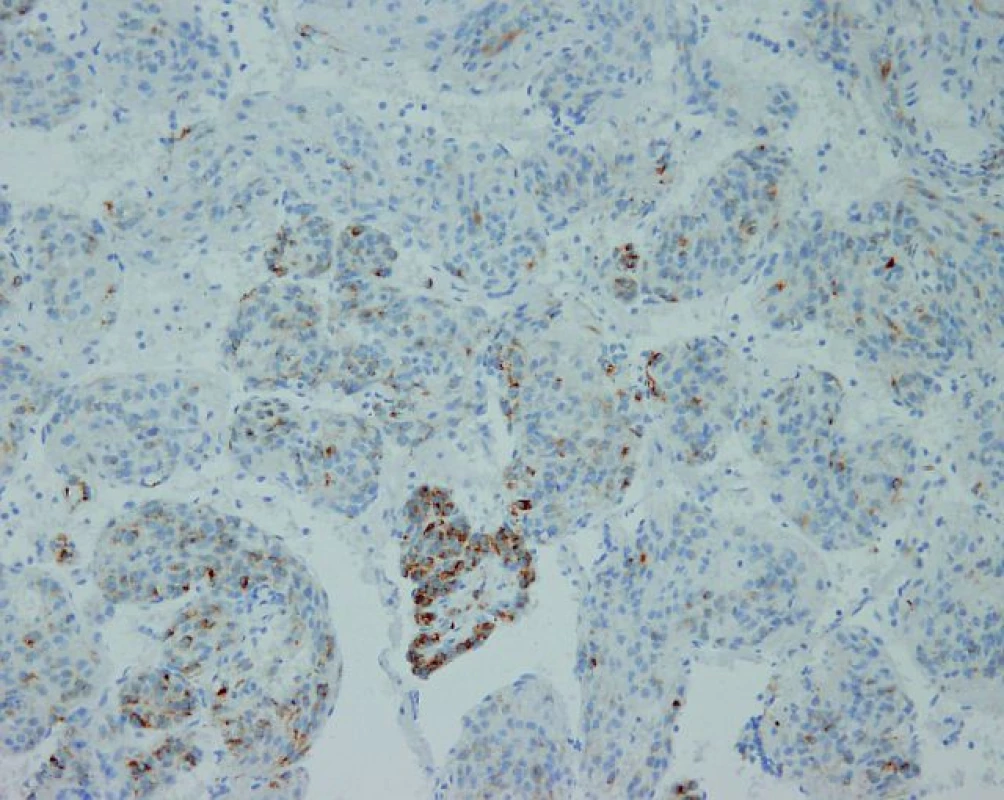
Na Gynekologicko-pôrodnícku kliniku FN Nitra bola 18. 8. 2009 prijatá 43-ročná pacientka s tumorom v malej panve. Počas gynekologického vyšetrenia pomocou sonografie sme zistili solídne nádory v mieste vaječníkov veľkosti 5, resp. 6 cm a ascites s vertikálnym stĺpcom tekutiny 8 cm. Gynekologická anamnéza bola bez pozoruhodností, v anamnéze 2 spontánne pôrody. Hladina CA125 bola 647 IU/ml, ostatné laboratórne parametre v norme. Pri laparotómii sa verifikoval chylózny ascites (peroperačne odsaté 1,5 l tekutiny), parailiakálne a paraaortálne vľavo boli zväčšené lymfatické uzliny (dve uzliny veľkosti 5 a 6 cm). Maternica bola zväčšená a deformovaná myomatóznymi uzlami. Na obidvoch vaječníkoch boli prítomné cysty veľkosti 3, resp. 4 cm. Vykonali sme odstránenie zväčšených lymfatických uzlín v okolí vasa iliaca externa vľavo, intrafasciálnu hysterektómiu spolu s obojstrannou adnexektómiou. Lymfatické uzliny neboli peroperačne vyšetrované. Indikáciou k hysterektómii s adnexektómiou bol uterus myomatosus a cysty na obidvoch vaječníkoch. Peroperačným histopatologickým vyšetrením vaječníkov neboli zistené malígne zmeny. Vo všetkých histopatologických rezoch lymfatických uzlín boli zistené fascikulárne usporiadané bunkové elementy s nízkym stupňom proliferácie (obr. 1). Bunková populácia imunohistochemicky exprimovala melanocytárny marker HMB-45 (human melanoma black-45), SMA (alpha-smooth muscle actin), vimentín, dezmín a S 100 proteín. Potvrdená pozitivita na HMB-45 je v prípade LAM kľúčová (obr. 2). Zároveň sa zistila 85% až 90% pozitivita na estrogénové a progesterónové receptory. Uvedený mikroskopický a imunohistochemický obraz je typický pre LAM. Histologické vyšetrenie maternice a vaječníkov dokázalo 4 leiomyómy v stene maternice a folikulárne cysty na obidvoch vaječníkoch. Pacientka následne 2 roky užívala megestrol acetát (Megace) v dávke 3×160 mg denne. Priebežne sa podrobovala paracentéze ascitu v 5 až 6 mesačných intervaloch. V roku 2011 bola hospitalizovaná pre kardiálnu dekompenzáciu a výraznú tvorbu chylózneho ascitu. Vzhľadom k jeho excesívnej produkcii bola zavedená trvalá drenáž dutiny brušnej. V súčasnosti je produkcia chylóznej tekutiny asi 4 litre za 24 hodín. Pacientka 5. mesiac užíva kombináciu sirolimus (Rapamun) 1 mg denne a hydrochlorochínsulfát (Plaquenil) 400 mg denne. Ide o izolovanú abdominálnu formu LAM, bez postihnutia iných orgánov, čo bolo preukázané ďalšími vyšetreniami (USG a CT vyšetrenie hrudníka a dutiny brušnej).
KAZUISTIKA 2
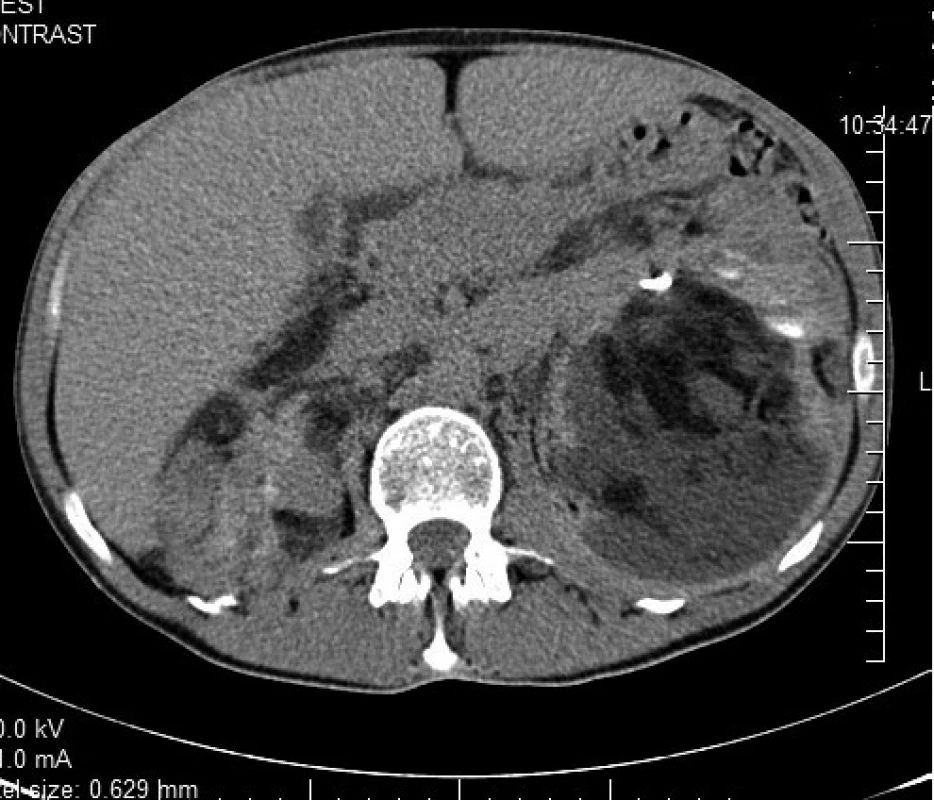
Pacientka vo veku 41 rokov bola prijatá 1. 1. 2012 na Gynekologicko-pôrodnícku kliniku FN Nitra na plánovanú operačnú liečbu pre početné tumory v malej panve nejasnej etiológie. Predoperačne bolo vykonané ultrazvukové vyšetrenie malej panvy s nálezom solídneho nádoru v oblasti pravých adnex veľkosti 6×8 cm. Nález na maternici a ľavých adnexách bol normálny. Pri laparotómii sme odstránili 3 uzliny veľkosti 4 až 5 cm z fossa obturatoria vpravo. Nález na vnútornom genitáli bol normálny. Zväčšené lymfatické uzliny imitovali adnexálny nádor. Spracovaná vzorka lymfatickej uzliny, histologická skladba ako aj imunohistochemické vyšetrenia zodpovedali morfologickej entite LAM. Z osobnej anamnézy je pozoruhodné, že ide o pacientku dlhodobo sledovanú na dermatologickej ambulancii pre Bournevilleho-Pringleho syndróm (tuberózna skleróza). Pacientka v minulosti opakovane podstúpila operácie kožných tumorov v kapilíciu ako aj dermabráziu tváre. Rovnaké ochorenie bolo zistené aj u dcéry. V pooperačnom období bolo vykonané CT vyšetrenie hrudníka s negatívnym nálezom. Iniciálne bol pacientke nasadený megestrol acetát (Megace) v dávke 3×160 mg denne. Napriek tomu došlo k zhoršeniu zdravotného stavu, objavili sa bolesti brucha s akcelerovanou tvorbou chylózneho ascitu. S odstupom 4 mesiacov od operačného výkonu CT vyšetrenie dutiny brušnej ukázalo v retroperitoneu dobre ohraničený nádor veľkosti 10×6 cm nasadajúci na ľavú obličku (obr. 3). Rádiologicky bol obraz lézie konzistentný s diagnózou LAM. Nakoľko tumor ultáčal ľavý ureter, bola zavedená prechodná endodrenáž ureteru. Následná spontánna dislokácia drénu po 2 týždňoch bola bez klinickej odozvy. Šesť mesiacov po operácii bol CT vyšetrením zistený fluidothorax a biopsia potvrdila pľúcnu formu LAM. Vzhľadom na rýchlo progredujúci stav ochorenia bola u pacientky indikovaná liečba sirolimom.
DISKUSIA
LAM je raritné ochorenie a izolovaná mimopľúcna forma je extrémne zriedkavá. Matsui a spol. uvádzajú, že v súbore 188 pacientok len 3 (2 %) mali izolovanú extrapulmonálnu formu [10]. LAM spravidla vzniká v reprodukčnom veku, hoci sú známe prípady aj u postmenopauzálnych žien užívajúcich hormonálnu substitučnú liečbu. Úloha estrogénových a progesterónových receptorov v patogenéze ochorenia nie je jasná. Ich pozitivita dáva predpoklad, že hormonálna liečba môže byť úspešná [8].
Patogenéza ochorenia nie je jasná. V prípade, ak LAM prebieha v spojení s tuberóznou sklerózou, ide o genetickú mutáciu lokalizovanú na choromozómoch 9q34 (TSC1 gén) a 16p13 (TSC2 gén). Tieto supresorové gény sú zodpovedné za kódovanie hamartínu (TSC1) a tuberínu (TSC2). Nedostatok týchto dvoch proteínov spôsobuje aktiváciu mTOR (mammalian target of rapamycín). Následkom procesu je zvýšenie proliferácie cieľových buniek hladkého svalu, ktoré pritom zároveň získavajú aj rysy melanocytu [17].
Úloha enviromentálnych faktorov v patogenéze LAM doteraz nebola objasnená, hoci ide o diskutovaný problém [10, 14].
Diagnostika LAM nie je jednoduchá. Ochorenie najčastejšie imituje karcinóm ovária, endometria alebo lymfóm, prípadne sarkóm, resp. leiomyosarkóm. Stanovenie diagnózy v prípade izolovanej mimopľúcnej formy je náročné. Matsui a spol. uvádzajú 12% výskyt chylózneho ascitu [10]. V prípadoch manifestujúcej sa kožnej formy TSC je vhodné myslieť aj na možný výskyt LAM. Definitívne potvrdenie je založené na histologickom a imunohistochemickom dôkaze hladkosvalového fenotypu s expresiou melanocytárnych markerov [3, 8]. Všetky ostatné laboratórne vyšetrenia (krvný obraz, biochemické vyšetrenie séra, analýza moču) vykazujú normálne hodnoty [2]. Pre pľúcnu formu je typický CT obraz [12].
Liečba LAM prešla v ostatných dekádach vývojom. Postupne boli v terapii využívané metódy rádioterapie, kortikosteroidy a chemoterapia. Všetky spomenuté modality priniesli len malý benefit [9]. Hormonálna liečba progesterónom, ooforektómiou, tamoxifénom alebo GnRH analógmi má diskutabilný efekt [9]. Eliasson a spol. referujú o 50% úspešnosti (stabilizácii) s použitím gestagénov [5].
Sirolimus (Rapamun) je imunosupresívum s potenciálom významne zlepšiť prognózu pacientok s LAM. Aj napriek tejto skutočnosti, ide o „off-label“ liečbu, pretože jedinou indikáciou jeho použitia je stav po transplantácii obličky [13]. Ide o inhibítor mTOR, ktorého efekt bol overený v štúdii MILES [11]. Sirolimus stabilizuje pľúcne funkcie, zlepšuje symptómy a kvalitu života. V jednej zo štúdií vplyvom sirolimu došlo k výraznej redukcii chylózneho ascitu a/alebo k redukcii nádorov [16]. Použitie lieku je rezervované pre pacientky, u ktorých nemala progesterónová liečba benefit a ktoré spĺňajú nasledujúce podmienky: rýchla progresia pľúcneho postihnutia, vrátane chylóznej efúzie, potreba drenáže chylotoraxu alebo pleurodézy a v prípadoch významnej symptomatológie abdominálnej alebo pľúcnej formy [17]. Sirolimus sa iniciálne podáva v dávke 2 mg/deň, pričom je potrebné sledovať jeho hladinu v sére, ktorá má byť v rozmedzí 5–15 ng/ml [17]. Neskôr je možná redukcia na 1 mg/deň. Výskyt vedľajších účinkov môže byť limitujúcim, najmä ak sa vyskytuje hypertenzia, hyperlipidémia, ulcerácie v dutine ústnej, recidivujúce infekcie, elevácia hladiny kreatinínu alebo intersticiálna pneumónia. Antimalarikum a antireumatikum hydrochlorochínsulfát (Plaquenil) má podobné účinky ako sirolimus, a to najmä vtedy, keď sú užívané súčasne. Opäť sa jedná o liek v indikácii „off-label“. Aktuálne sa začína prvá fáza intervenčnej štúdie, ktorá má overiť bezpečnosť užívania kombinácie sirolimu a hydrochlorochínu u žien s LAM [6].
Vzhľadom k tomu, že LAM je raritné ochorenie imitujúce gynekologickú malignitu, môže dôjsť k oddialeniu stanovenia diagnózy, zbytočne rozsiahlej operačnej intervencii či k nevhodnej liečbe. U prvej pacientky sme indikovali laparotómiu pre podozrenie na tumor ovária. V druhom prípade sme suponovali na LAM už pred operačným výkonom (tuberózna skleróza a lymfadenopatia v panve). Je namieste otázka väčšieho benefitu laparoskopického prístupu namiesto laparotomického. Pacientky s mimopľúcnou formou LAM zvyčajne podstúpia operačnú liečbu pre nádor v dutine brušnej. Peroperačné histologické vyšetrenie a definitívne overenie erudovaným patológom určí správnu diagnózu. Hysterektómia spolu s adnexektómiou nemá liečebný účinok. Úlohou operačného výkonu je histologické vyšetrenie cystických útvarov a potvrdenie diagnózy. Významným problémom je pretrvávajúca tvorba chylózneho ascitu a následná potreba drenáže dutiny brušnej. Obštrukcia lymfatických ciev môže viesť k úniku lymfy do brušnej alebo hrudnej dutiny. Následkom toho vzniká hypoproteinémia, lymfopénia, hypokalcémia, hyponatriémia, metabolická acidóza, hypovitaminóza A, D, E, K a imunodeficientný stav (hypoimunoglubilinémia a deficit T-lymfocytov). Liečba spočíva v diétnych opatreniach, pričom je indikovaná beztuková alebo nízkotuková diéta a triglyceridy so stredne dlhým reťazcom (MCT). Totálna parenterálna výživa niekedy zastaví tvorbu chylózneho ascitu [1]. Pokiaľ nie sú tieto opatrenia adekvátne, efektívna môže byť medikamentózna alebo chirurgická liečba. Používa sa aj oktreotid, etiliefrin, faktor XIII, prípadne skleroterapia alebo rádioterapia [1].
Progredujúci charakter ochorenia a nevyhnutnosť trvalej drenáže významne zhoršuje kvalitu života pacientok. Prognóza pacientok nie je priaznivá, dĺžka prežitia bola v minulosti maximálne 10 rokov od stanovenia diagnózy [15]. V súčasnosti s využitím všetkých dostupných liečebných modalít, vrátane transplantácie pľúc, 78 % pacientok prežíva 8,5 roka [14]. Pokiaľ sa extrapulmonálna forma manifestuje ako prvá, predchádza pľúcnemu postihnutiu zvyčajne 1–2 roky [10]. Toto sme pozorovali u nášho druhého prípadu, keď sa u pacientky zistila pľúcna forma 6 mesiacov po diagnóze extrapulmonálnej LAM. V tejto súvislosti treba zdôrazniť potrebu „follow-up“ u pacientok s LAM.
Žurková a spol. navrhujú u pacientok s LAM vždy vylúčiť prítomnosť tuberóznej sklerózy (oftalmologické, kožné a neurologické vyšetrenie). Pacientky s LAM a bilaterálnymi angiolipómami, rovnako ako aj pacientky s podozrením na TSC je potrebné odoslať na genetické vyšetrenie. Rutinné genetické vyšetrenie u pacientok so sporadickou formou LAM nie je indikované [20].
V liečebnej schéme sa v prvom rade využíva efekt gestagénov, ktorú považujeme za liečbu prvej línie. V obidvoch prípadoch sme liečbu gestagénmi aplikovali ako primárnu. Podanie sirolimu je v našich podmienkach limitované osobitným schválením a obyčajne je v kompetencii onkologického pracoviska. Sirolimus nemá byť rutinne predpisovaný mimo klinických štúdií. Liečba je indikovaná v prípadoch rýchlej progresie ochorenia u pacientok liečených gestagénmi alebo po vyčerpaní dostupných liečebných možností [12]. Vytvorenie centrálneho registra na európskej a celosvetovej úrovni môže priniesť benefit v diagnostike, liečbe a hlavne v prognóze pacientok s LAM.
MUDr. Erik Lajtman, PhD.
Gynekologicko-pôrodnícka klinika
FN a UKF Nitra
Špitálska 6
949 01 Nitra
Slovenská republika
e-mail: lajtmanerik@gmail.com
Zdroje
1. Blei, F. Medical Management. In Lee, B.-B., Bergan, J., Rockson, SG. Lymphedema. London: Springer-Verlag, 2011, p. 449–453.
2. Bonetti, F., Chiodera, P., Pea, M., et al. Transbronchial biopsy in lymphangioleiomyomatosis of the lung: HMB 45 for diagnosis. Am J Surg Pathol, 1993, 17, p. 1092–1102.
3. Bonetti, F., Pea, M., Martignoni, G., et al. Clear cell (Sugar) tumor of the lung is a lesion strictly related to angiomyolipoma: the concept of a family of lesion characterized by the presence of the perivascular epithelioid cells (PEC). Pathology, 1994, 26, p. 230–236.
4. Cornog, JL., Enterline, HT. Lymphangiomyoma, a benign lesion of chyliferous lymphatic synonymous with lymphangiopericytoma. Cancer, 1966, 19, p. 1909–1930.
5. Eliasson, AH., Phillips, YY., Tenholder, MF. Treatment of lymhangioleiomyomatosis. A meta-analysis. Chest, 1989, 96, p. 1352–1355.
6. Henske, E. Safety study of sirolimus and hydrochloroquine in women with lymphangioleiomyomatosis [on line]. [cit. 2012-10-01].Dostupný na WWW: http://clinicaltrialsfeeds.org/clinical-trials/show/NCT01687179>
7. Hohman, DW., Noghrehkar, D., Ratnayake, S. Lymphagio-leiomyomatosis: a review. Eur J Intern Med, 2008, 19, p. 319–324.
8. Kebria, M., Black, D., Bonelli, C., et al. Primary retroperitoneal lymphangioleiomyomatosis in a postmenopausal woman: a case report and review of the literature. Int J Gynecol Cancer, 2007, 2007, 17, p. 528–532.
9. Kelly, J., Moss, J. Lymphangioleiomyomatosis. Am J Med Sci, 2001, 321, p. 17–25.
10. Matsui, K., Tatsuguchi, A., Valencia, J., et al. Expora-pulmonary lymphangioleiomyomatosis (LAM): clinicopathologic features in 22 cases. Hum Pathol, 2000, 31, p. 1242–1248.
11. McCormack, FX., Yoshikazu, Y., Moss, J., et al. Multicenter international lymphangioleiomyomatosis efficaccy and safety of sirolimus (MILES) trial. N Engl J Med, 2011, 364, p. 1595–1606.
12. Nebeský, T., Pokojová, E., Dvořák, K. Lymfangioleio-myomatóza. Čes Radiol, 2004, 58, 1, s. 27–29.
13. Rapamune. SPC [on line]. [cit. 2012-10-01]. Dostupný na WWW:http://sukl.sk/buxus/generate_page.php?page_id=368&lie_id=34341
14. Sullivan, EJ. Lymphangioleiomyomatosis: a review. Chest, 2006, 114, 6, p 1689–1703.
15. Svendsen, TL., Viskum, K., Hansborg, N., et al. Pulmonary lymphagioleiomyomatosis: a case of progesterone receptor positive lymphangioleiomyomatosis treated with medroxyprogesterone, oophorectomy and tamoxifen. Br J Dis Chest, 1984, 78, p. 264–271.
16. Taviera-DaSilva, AM., Hathaway, O., Stylianou, M.,Moss, J. Changer in lung funkction and chylous effusion in patients with lymphangioleiomyomatosis treated with sirolimus. Ann Intern Med, 2011, 154, p. 797–805.
17. Taviera-DaSilva, AM., Moss, J. Progress in the treatment of lymfangioleiomyomatosis: From bench to bedside. Rev Port Pneumol, 2012, 18, p. 142–144.
18. Taviera-DaSilva, AM., Steagall, W., Moss, J. Lymphangio-leiomyomatosis. Cancer, Control, 2006, 13, 4, p 276–285.
19. Toshiaki, O., Takhiro, O., Kentaro, M., et al. Sirolimus ameliorated post lung transplant chylothorax in lymphangioleiomyomatosis. Ann Thorac Surg, 2008, 86, p. e7–e8.
20. Žurková, M., Kolek, V., Vašáková, M., Loštáková, V. Lymfangioleiomyomatóza – standard diagnózy, léčby a sledování [on line]. [cit. 2012-09-28]. Dostupný na WWW: http://pneumologie.cz/odborne/doporučenie-postupy.php
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2013 Číslo 2
-
Všechny články tohoto čísla
- … předvolební a povolební rybníček
- Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen
- Pravidelná ultrazvuková vyšetření v průběhu prenatální péče –doporučený postup
- Ultrazvuková vyšetření v průběhu prenatální péče o vícečetná těhotenství – doporučený postup
- Péče o těhotenství s intrauterinní růstovou retardací plodu –doporučený postup
-
Vedení porodu u těhotné s císařským řezem v anamnéze
Ultrazvukové vyšetření před stanovením taktiky vedení porodu – doporučený postup - Těhotenství a roztroušená skleróza – analýza výsledků z let 2003–2011
- Hyperlipidémie v těhotenství
-
Psychosociální klima porodnice očima rodiček I.
Výsledky celorepublikového průzkumu spokojenosti s perinatální péčí v ČR u reprezentativního souboru 1195 rodiček -
Kmenové buňky a karcinom ovaria
Charakteristika, význam a potenciální aplikacev klinické praxi - Selektivní modulátory progesteronového receptoru a jejich terapeutické využití
- L-arginin v prevenci a léčbě preeklampsie
- Systémová enzymoterapie v léčbě recidivující vulvovaginální kandidózy
- Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
- Opakované potrácení – přehledový článek
- Retroperitoneálna lymfangioleiomyomatóza – kazuistiky
- Transfusion-related acute lung injury (TRALI) – přehledový článek
- Blokáda vápníkových kanálů – perspektiva mužské antikoncepce?
- Moje zkušenosti z ENTOG exchange, Estonsko, 2012
- Atlas gamét a embryí niektorých živočichov a človeka
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Transfusion-related acute lung injury (TRALI) – přehledový článek
- Opakované potrácení – přehledový článek
- Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
- Hyperlipidémie v těhotenství
