Transfusion-related acute lung injury (TRALI) – přehledový článek
Transfusion-related acute lung injury (TRALI) – review
TRALI is a major cause of serious morbidity and mortality associated with a blood transfusion. It is clinically manifested by acute respiratory distress within 6 hours of completion of transfusion. Neutrophils have the key role in the pathogenesis. They are activated mostly with leukocyte antibodies (HLA and granulocyte) that are present mainly in plasma containing blood products. TRALI is a clinical diagnosis based on hy-poxemia and positive finding on lung X-ray examination. The treatment is only supportive and the mortality is about 5% to 10%. The major preventive measure is transfusing blood products from donors without leukocyte antibodies.
Keywords:
TRALI – blood transfusion – mortality – leukocyte antibodies
Autoři:
Z. Čermáková 1; O. Šimetka 2
; M. Kořístka 1
Působiště autorů:
Krevní centrum FN, Ostrava, vedoucí pracoviště MUDr. Z. Čermáková, Ph. D.
1; Porodnicko-gynekologická klinika FN, Ostrava, přednosta doc. MUDr. V. Unzeitig, CSc.
2
Vyšlo v časopise:
Ceska Gynekol 2013; 78(2): 211-215
Souhrn
TRALI je jednou z hlavních příčin závažné morbidity a mortality spojené s podáním krevní transfuze. Klinicky se manifestuje akutní dechovou tísní do šesti hodin od ukončení transfuze. Klíčovou roli v patogenezi mají neutrofilní leukocyty, pro jejichž aktivaci jsou nejvýznamnější leukocytární protilátky (HLA a granulocytární) přítomné zejména v transfuzních přípravcích (TP) obsahujících plazmu. Diagnóza TRALI je klinická s důkazem pozitivního rentgenového nálezu na plících a hypoxémie. Léčba je podpůrná s mortalitou asi 5 až 10 %. Nejdůležitějším preventivním opatřením je výroba TP od dárců bez leukocytárních protilátek.
Klíčová slova:
TRALI – krevní transfuze – mortalita – leukocytární protilátky
ÚVOD
Podání krevních transfuzí je nedílnou součástí jakékoli nemocniční péče, a to zejména u komplikovaných stavů s akutním krvácením. Porodnicko-gynekologická pracoviště jsou významným odběratelem transfuzních přípravků (TP), např. ve FN Ostrava je 8 % všech TP podáno právě na Porodnicko-gynekologické klinice. Podání alogenních TP však sebou přináší i riziko akutních potransfuzních reakcí, z nichž klinicky nejzávažnější je akutní poškození plic spojené s transfuzí (TRALI – Transfusion-Related Acute Lung Injury) [4]. Z tohoto důvodu jakákoliv akutní dechová tíseň související s transfuzí musí být v diferenciálně diagnostické rozvaze pokládána za možný projev TRALI.
HISTORIE DIAGNÓZY TRALI
Termín TRALI se používá od roku 1983, kdy Popovsky a kol. definovali klinickou jednotku akutního plicního poškození, k níž dochází v souvislosti s podáním transfuzních přípravků [17]. V roce 1985 byly prezentovány výsledky první analýzy TRALI u 36 pacientů. TRALI bylo rozpoznáno jako zřetelná klinická jednotka, kterou charakterizovala akutní dyspnoe s nástupem do 6 hodin od krevní transfuze, s hypoxémií a plicním edémem, s bilaterálními infiltráty na rentgenovém snímku plic, bez známek oběhového přetížení, obvykle provázená hypotenzí. Zotavení respiračního systému do stavu před transfuzí bylo pozorováno u 81 % pacientů [18]. Širší analýza TRALI je prováděna zahraničními hemovigilačními systémy od roku 1996 a získaná data potvrzují, že TRALI je hlavní příčinou morbidity a mortality související s krevní transfuzí ve Velké Británii [25]. V České republice jsou data dostupná od roku 2002 a TRALI je hlášeno s četností 4–5 případů za rok (údaje od Společnosti pro transfuzní lékařství).
DEFINICE TRALI
Komplikace při stanovení diagnózy TRALI, diskrepance v hemovigilančních datech a potřeba jasných kritérií pro studijní účely daly podnět k vypracování srozumitelnější jednotky. Pracovní skupina amerického NHLBI (The National Heart, Lung and Blood Institute) vycházela z definice akutního poškození plic (Acute Lung Injury, ALI) podle American-European Consensus Conference z roku 1994 [1] a definovala TRALI jako nové akutní poškození plic, které vznikne během transfuze nebo do 6 hodin od jejího ukončení u pacientů bez jiných rizikových faktorů pro ALI nebo s rizikovými faktory [35]. Následná Canadian Consensus Conference v Torontu roku 2004 dále rozšířila definici hypoxémie o „jiný klinický důkaz hypoxémie“ a zavedla jednotku „possible TRALI“ v případě výskytu alespoň jednoho dalšího rizikového faktoru pro ALI, než je transfuze [7, 11]. Tato definice se pak stala i všeobecně používanou (tab. 1).

RIZIKOVÉ TRANSFUZNÍ PŘÍPRAVKY A INCIDENCE TRALI
TRALI bylo hlášeno po podání všech druhů transfuzních přípravků (TP), tzn. plné krve, erytrocytů, plazmy, kryoproteinu, trombocytů, granulocytů, včetně kmenových buněk a intravenózních imunoglobulinových preparátů [20]. Nejrizikovější z pohledu vzniku TRALI je plazma [8, 9, 18] a TP obsahující alespoň 50 ml plazmy [7]. Incidence TRALI je v severní Americe (USA, Kanada) obvykle uváděna v rozmezí 1 : 1300 až 1 : 5000 podaných jednotek TP [8, 11, 18, 29, 37]. V Evropě je uváděna nižší, v rozmezí 1 : 55 500 až 1 : 200 000 všech podaných TP [6, 9]. Mortalita se pohybuje v rozsahu od 5 do 10 % [31, 38].
PATOGENEZE TRALI
Patogeneze TRALI není plně objasněna, uvádějí se dva základní mechanismy: TRALI zprostředkované a nezprostředkované protilátkami proti leukocytům.
1. Antibody-mediated TRALI (asi 80 % případů) [14].
Vyvolávající příčinou jsou leukocytární protilátky (HLA anebo granulocytární) přítomné obvykle v TP obsahujících plazmu, které po navázání na korespondující antigeny neutrofilů příjemce mohou způsobit jejich agregaci s následnou mechanickou sekvestrací v plicních kapilárách anebo přímé uchycení neutrofilů na endoteliální buňky s následnou adherencí a aktivací. Aktivované neutrofily uvolněním cytotoxických enzymů způsobí zvýšení kapilární permeability s únikem plazmatické tekutiny bohaté na bílkoviny do intersticia a alveolů (tzn. intraalveolání edém) [2, 3, 13]. Nepřímou aktivaci neutrofilů příjemce vyvolávají protilátky HLA II. třídy, které navázáním na monocyty způsobí uvolnění cytokinů působících aktivaci či priming neutrofilů [16]. Imunitní mechanismus vzniku TRALI po převodu HLA a granulocytárních protilátek byl potvrzen na zvířecích modelech [12, 22, 24]. Nejvýznamnější jsou protilátky proti antigenům HLA-A2 a HNA-2, které indukují klinicky závažné až fatální TRALI [5, 8, 19].
2. Non-antibody-mediated TRALI (asi 20 % případů) [14].
Pro neimunitní mechanismus vzniku TRALI byl navržen „two-hit“ model (model dvojího úderu) [27,30,32]. „První úder“ (např. sepse, trauma, masivní transfuze apod.) nejprve aktivuje endoteliální buňky plicních kapilár s následnou sekvestrací neutrofilů, poté „druhý úder“ (transfuze bioaktivních substancí / protilátek přítomných v plazmě a ve skladovaných buněčných TP) aktivuje sekvestrované neutrofily s rozvojem TRALI [3].
Podstatou „two-hit“ modelu je aktivace endoteliálních buněk plicních kapilár, zatímco imunitní TRALI bylo pozorováno dokonce i u zdravých jedinců [2]. Z tohoto důvodu byl navržen komplexnější „threshold model“ (prahový model), který oba mechanismy propojuje, přičemž práh citlivosti pro vznik TRALI (priming a aktivace neutrofilů, aktivace endoteliálních buněk) i jeho klinická závažnost (těžké, lehké) jsou závislé na spolupůsobení rizikových faktorů různé kvality a kvantity, jak ze strany transfuzního přípravku (protilátky, bioaktivní substance), tak ze strany pacienta (individuální vrozené a získané predispozice) [3].
KLINICKÝ OBRAZ TRALI
Klinické příznaky TRALI se typicky manifestují do 6 hodin od ukončení transfuze. Základním příznakem TRALI je akutní dechová tíseň (dyspnoe, tachypnoe) doprovázená obvykle hypotenzí (vzácně hypertenzí) a horečkou, dále může být přítomna cyanóza a tachykardie. Zcela bez příznaků mohou být pacienti v celkové anestezii, přičemž první známkou TRALI může být nález žlutého zpěněného sekretu v endotracheální trubici [15, 18, 36].
DIAGNÓZA TRALI A DIFERENCIÁLNÍ DIAGNÓZA
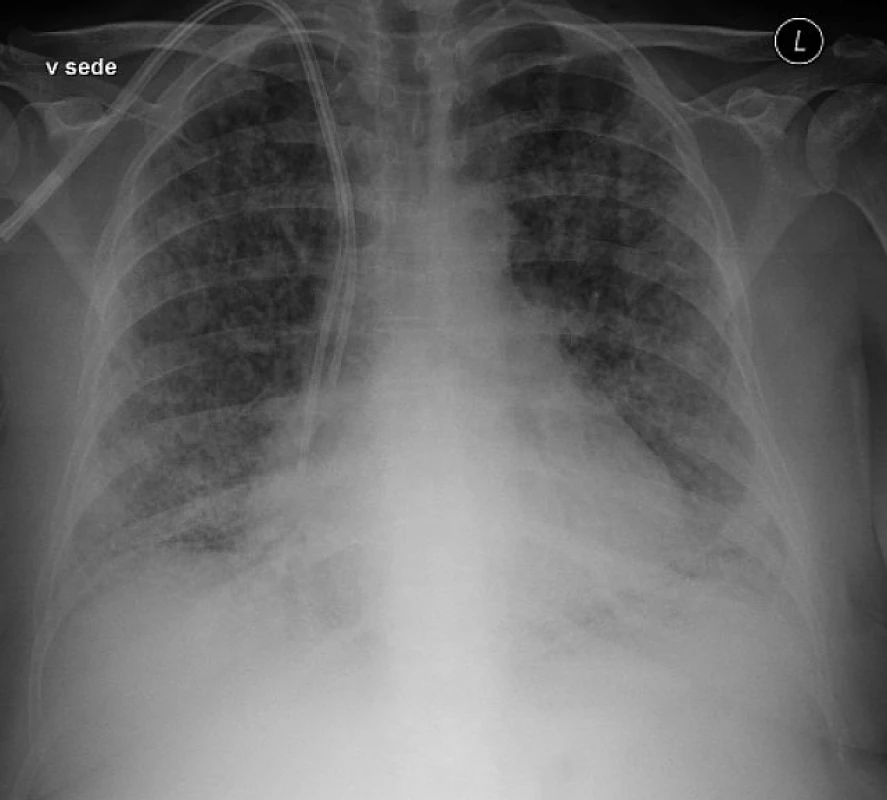
Diagnóza TRALI je založena na splnění klinických kritérií, jak je uvedeno v tabulce 1. Základní klinický obraz TRALI musí být podložen nálezem nového bilaterálního infiltrátu na rtg plic (obr. 1) a důkazem hypoxémie. V diferenciální diagnostice je nutné vyloučit ARDS, kardiogenní plicní edém, oběhové přetížení spojené s transfuzí (Transfusion-Associated Circulatory Overload, TACO), alergickou či anafylaktickou reakci. V případě zjištění jiných rizikových faktorů pro vznik ALI (např. sepse, pneumonie a jiné) se obvykle používá diagnóza „possible TRALI“ [7, 11]. Z laboratorní testů má podpůrný diagnostický význam vyšetření leukocytárních (HLA a granulocytárních) protilátek v rizikových TP, přičemž pozitivní nález podporuje diagnózu „antibody-mediated“ TRALI [37]. Diagnosticky nejasné případy je vhodné řešit ve spolupráci klinika s transfuzním lékařem.
LÉČBA TRALI
Léčba TRALI je pouze podpůrná. Pro lehké formy TRALI je dostačující podání kyslíku, těžké formy vyžadují šetrnou umělou plicní ventilaci (asi 70% případů) [18]. Diuretika nejsou indikována, pro použití kortikoidů chybí přesvědčivé důkazy [11,35,36]. K úpravě klinického stavu a vymizení infiltrátů na rentgenovém snímku plic dochází u většiny pacientů během 72 až 96 hodin [31,36]. Ve vzácných případech s pomalou úpravou může hypoxémie s nálezem plicních infiltrátů přetrvávat 7 dní a více [2].
Prevence TRALI
Nejdůležitějším dostupným preventivním opatřením k minimalizaci rizika imunitního TRALI je výroba TP obsahujících plazmu od dárců bez leukocytárních protilátek s preferencí mužských dárců s negativní transfuzní anamnézou nebo od dárkyň s negativní transfuzní a těhotenskou anamnézou [4]. V případě podání trombocytů lze snížit riziko TRALI podáním trombocytů připravených v náhradním roztoku. Další možností je použití klinicky velmi bezpečné SD plazmy (směsná, solvent-detergent antivirově ošetřená plazma) [34]. Preventivní opatření ke snížení neimunitního TRALI neexistují [26].
ZÁVĚR
TRALI je život ohrožující komplikací krevní transfuze. Vzájemná spolupráce klinických a transfuzních lékařů je rozhodující pro včasné stanovení správné diagnózy. Vzhledem k častému podávání TP právě na porodnických a gynekologických pracovištích je nutné o této vzácné, ale závažné komplikaci udržovat vysoké povědomí.
MUDr. Zuzana Čermáková, Ph.D.
Krevní centrum FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: zuzana.cermakova@fno.cz
Zdroje
1. Bernard, GR., Artigas, A., Brigham, KL., et al. Report of the American-European Consensus conference on acute respiratory distress syndrome: definitions, mechanisms, relevant outcomes, and clinical trial coordination. Consensus Committee. J Crit Care, 1994, 9, p. 72–81.
2. Bux, J. Antibody-mediated (immune) transfusion-related acute lung injury. Vox Sang, 2011, 100, p. 122–128.
3. Bux, J., Sachs, UJH. The pathogenesis of transfusion-related acute lung injury (TRALI). Brit J Hem, 2007, 136, p. 788–799.
4. Čermáková, Z., Kořístka, M., Blahutová, Š., et al. Transfusion-related acute lung injury: Report of two cases. Prag Med Rep, 2012, 113, 4, p. 294–298.
5. Davoren, A., Curtis, BR., Shulman, IA., et al. TRALI due to granulocyte-agglutinating human neutrophil antigen-3a (5b) alloantibodies in donor plasma: a report of 2 fatalities. Transfusion, 2003, 43, p. 641–645.
6. Flesland, O. A comparison of complication rates based on published haemovigilance data. Intensive Care Med, 2007, 33, suppl. 1, p. 17–21.
7. Goldman, M., Webert, KE., Arnold, DM., et al. Proceedings of a consensus conference: toward an understanding of TRALI. Trans Med Rev, 2005, 19, p. 2–31.
8. Chapman, CE., Stainsby, D., Jones, H., et al. Ten years of hemovigilance reports of transfusion-related acute lung injury in the United Kingdom and the impact of preferential use of male donor plasma. Transfusion, 2009, 49, p. 440–452.
9. Keller-Stanislawski, B., Reil, A., Gunay, S., Funk, MB. Frequency and severity of transfusion-related acute lung injury – German haemovigilance data (2006–2007). Vox Sang, 2010, 98, p. 70–77.
10. Khan, SY., Kelher, MR., Heal, JM., et al. Soluble CD40 ligand accumulates in stored blood components, primes neutrophils through CD40, and is a potential cofactor in the development of transfusion-related acute lung injury. Blood, 2006, 108, p. 2455–2462.
11. Kleinman, S., Caulfield, T., Chan, P., et al. Toward an under-standing of transfusion-related acute lung injury: statement of a consensus panel. Transfusion, 2004, 44, p. 1774–1789.
12. Lögdberg, LE., Vikulina, T., Zimring, JC., et al. Animal model of transfusion-related acute lung injury. Transf Med Rev, 2009, 23, p. 13–24.
13. Mair, DC., Eastlund, T. The pathophysiology and preven-tion of transfusion-related acute lung injury (TRALI): a review. Immunohem, 2010, 26, p. 161–173.
14. Middelburg, RA., van Stein, D., Briet, E., van der Bom, JG. The role of donor antibodies in the pathogenesis of transfusion-related acute lung injury: a systematic review. Transfusion, 2008, 48, p. 2167–2176.
15. Moore, SB. Transfusion-related acute lung injury (TRALI): clinical presentation, treatment, and prognosis. Crit Care Med, 2006, 34, Suppl., p. 114–117.
16. Nishimura, M., Hashimoto, S., Takanashi, M., et al. Role of anti-human leucocyte antigen class II alloantibody and monocytes in development of transfusion-related acute lung injury. Transf Med, 2007, 17, p. 129–134.
17. Popovsky, MA., Abel, MD., Moore, SB. Transfusion-related acute lung injury associated with passive transfer of antileukocyte antibodies. Am Rev Respir Dis, 1983, 128, p. 185–189.
18. Popovsky, MA., Moore, SB. Diagnostic and pathogenetic considerations in transfusion-related acute lung injury. Transfusion, 1985, 25, p. 573–577.
19. Reil, A., Keller-Stanislawski, B., Günay, S., Bux, J. Specificities of leucocyte alloantibodies in transfusion-related acute lung injury and results of leucocyte antibody screening of blood donors. Vox Sang, 2008, 95, p. 313–317
20. Rizk, A., Gorgon, KC., Kenney, L., Weinstein R. Transfusion-related acute lung injury after the infusion of IVIG. Transfusion, 2001, 41, p. 264–268 .
21. Sachs, UJ. Recent insights into mechanism of transfusion-related acute lung injury. Curr Opin Hematol, 2011, 18, p. 436–442.
22. Sachs, UJ., Hattar, K., Weissmann, N., et al. Antibody-induced neutrofil activation as a trigger for transfusion-related acute lung injury in an ex vivo rat lung model. Blood, 2006, 107, p. 1217–1219.
23. Sachs, UJ., Wasel, W., Bayat, B., et al. Mechanism of transfusion-related acute lung injury induced by HLA class II antibodies. Blood, 2011, 117, p. 669–677.
24. Seeger, W., Schneider, U., Kreusler, B., et al. Reproduction of transfusion-related acute lung injury in an ex vivo lung model. Blood, 1990, 76, p. 1438–1444.
25. Serious Hazards of Transfusion (SHOT). Annual SHOT Report 2011. Available from http://www.shotuk.org/
26. Shaz, BH., Stowell, SR., Hillyer, CD. Transfusion-related acute lung injury: from bedside to bench and back. Blood, 2011, 117, p. 1463–1471.
27. Silliman, CC., Ambruso, DR., Boshkov, LK. Transfusion-related acute lung injury. Blood, 2005, 105, p. 2266–2273.
28. Silliman, CC., Bjornsen, AJ., Wyman, TH., et al. Plasma and lipids from stored platelets cause acute lung injury in an animal model. Transfusion, 2003, 43, p. 633–640.
29. Silliman, CC., Boshkov, LK., Mehdizadehkashi, Z., et al. Transfusion-related acute lung injury: epidemiology and prospective analysis of etiologic factors. Blood, 2003, 101, p. 454–462.
30. Silliman, CC., Curtis, BR., Kopko, PM., et al. Donor antibodies to HNA-3a implicated in TRALI reactions prime neutrophils and cause PMN-mediated damage to human pulmonary microvascular endothelial cells in a two-event in vitro model. Blood, 2007, 109, p. 1752–1755.
31. Silliman, CC., Fung, YL., Ball, JB., Khan, SY. Transfusion-related acute lung injury (TRALI): current concepts and misconceptions. Blood Rev, 2009, 23, p. 245–255.
32. Silliman, CC., Kelher, M. The role of endothelial activation in the pathogenesis of transfusion-related acute lung injury. Transfusion, 2005, 45, Suppl., p. 109–116.
33. Silliman, CC., Voelkel, NF., Allard, JD., et al. Plasma and lipids from stored red cells cause acute lung injury in an animal model. J Clin Invest, 1998, 101, p. 1458–1467.
34. Sinnott, P., Bodger, S., Gupta, A., Brophy, M. Presence of HLA antibodies in single-donor-derived fresh frozen plasma compared with pooled, solvent detergent-treated plasma (Octaplas). Eur J Immunogenet, 2004, 31, p. 271–274.
35. Toy, P., Popovsky, MA., Abraham, E., et al. Transfusion-related acute lung injury: definition and review. Crit Care Med, 2005, 33, p. 721–726.
36. Triulzi, DJ. Transfusion-related acute lung injury: Current Concepts for Clinician. Anesth and Analg, 2009, 108, p. 770–776.
37. Wallis, JP., Lubenko, A., Wells, AW., Chapman, CE. Single hospital experience of TRALI. Transfusion, 2003, 43, p. 1053–1059.
38. Webert, KE., Blajchman, MA. Transfusion-related acute lung injury. Curr Opin Hematol, 2005, 12, p. 480–487.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2013 Číslo 2
-
Všechny články tohoto čísla
- … předvolební a povolební rybníček
- Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen
- Pravidelná ultrazvuková vyšetření v průběhu prenatální péče –doporučený postup
- Ultrazvuková vyšetření v průběhu prenatální péče o vícečetná těhotenství – doporučený postup
- Péče o těhotenství s intrauterinní růstovou retardací plodu –doporučený postup
-
Vedení porodu u těhotné s císařským řezem v anamnéze
Ultrazvukové vyšetření před stanovením taktiky vedení porodu – doporučený postup - Těhotenství a roztroušená skleróza – analýza výsledků z let 2003–2011
- Hyperlipidémie v těhotenství
-
Psychosociální klima porodnice očima rodiček I.
Výsledky celorepublikového průzkumu spokojenosti s perinatální péčí v ČR u reprezentativního souboru 1195 rodiček -
Kmenové buňky a karcinom ovaria
Charakteristika, význam a potenciální aplikacev klinické praxi - Selektivní modulátory progesteronového receptoru a jejich terapeutické využití
- L-arginin v prevenci a léčbě preeklampsie
- Systémová enzymoterapie v léčbě recidivující vulvovaginální kandidózy
- Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
- Opakované potrácení – přehledový článek
- Retroperitoneálna lymfangioleiomyomatóza – kazuistiky
- Transfusion-related acute lung injury (TRALI) – přehledový článek
- Blokáda vápníkových kanálů – perspektiva mužské antikoncepce?
- Moje zkušenosti z ENTOG exchange, Estonsko, 2012
- Atlas gamét a embryí niektorých živočichov a človeka
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Transfusion-related acute lung injury (TRALI) – přehledový článek
- Opakované potrácení – přehledový článek
- Význam stanovení proteinu p16 v managementu prekanceróz děložního hrdla
- Hyperlipidémie v těhotenství
