Je diabetes mellitus rizikový faktor kvasinkového poševního zánětu?
Is diabetes mellitus a risk factor in genital yeast infections?
Objective:
To analyze experimental and clinical data on diabetes mellitus (DM) related to infections with focus on vaginal mycosis. To evaluate a role of DM in the epidemiology of vulvovaginal candidiasis.
Design:
Review.
Setting:
Department of Clinical Microbiology, Department of Biological and Medical Sciences, Faculty of Pharmacy, Department of Obstetrics and Gynecology, Charles University in Prague, Faculty of Medicine and University Hospital Hradec Kralove.
Methods:
Review of literature data.
Results:
DM is a risk factor for fungal infections caused by yeasts (Candida albicans), members of Mucorales fungi, some dimorphic fungi (Coccidioides) and agents of onychomycosis. DM is usually associated only with increased colonization of the anatomical sites (oral cavity, vagina), and/ or with an intensified symptomatology of infection (onychomycosis, mucormycosis). Diabetic patients with oropharyngeal and vulvovaginal candidiasis have frequently changed etiology spectrum. The patients with VVC and DM, especially of older age or with prone to relapses, have tendency to shift of the spectrum to non-albicans species, mainly C. glabrata. Treatment of VVC in diabetic patients can be complicated owing to unfavourable antifungal susceptibility profile (C. glabrata) and/ or adverse interactions between some azole antifungals and sulfonylurea-based antidiabetics.
Conclusion:
Diabetes mellitus is often cited as a risk factor, although in many cases there is a lack of reliable and clinically relevant information. This does not mean that this disease can be underestimated. On the contrary, it is necessary to get the DM as soon as possible under control and thus prevent complications when infection develops. Invidual approach should be apllied to the diabetic patients at risk of an infection. Yeast colonization and development of vaginal infection is complex process primarily dependent on sexual hormones, indigenous microbiota and finely tuned mechanisms of local immunity. Role of DM consists in the fact that it is one of the important co-factors that can change the setup of the vaginal environment in favour of yeasts and thus promote or facilitate the development of VVC.
Keywords:
diabetes mellitus – hyperglycemia – risk factors – infections – fungi – yeasts – Candida albicans – Candida glabrata
Autoři:
V. Buchta 1,2; V. Matula 3; J. Kestřánek 3; M. Vejsová 1,2; L. Křivčíková 2; J. Špaček 3
Působiště autorů:
Ústav klinické mikrobiologie LF UK a FN, Hradec Králové, přednosta doc. RNDr. V. Buchta, CSc.
1; Katedra biologických a lékařských věd, Farmaceutická fakulta LF UK, Hradec Králové, vedoucí doc. PharmDr. P. Nachtigal, Ph. D.
2; Porodnicko-gynekologická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D., IFEPAG
3
Vyšlo v časopise:
Ceska Gynekol 2013; 78(6): 537-544
Kategorie:
Původní práce
Souhrn
Cíl studie:
Analyzovat experimentální a klinická data o diabetes mellitus (DM) ve vztahu k infekcím se zřetelem na vaginální mykózy. Vyhodnotit zda a do jaké míry hraje DM roli v patogenezi, výskytu a léčbě vulvovaginální kandidózy (VVK).
Typ studie:
Souhrnné sdělení.
Název a sídlo pracoviště:
Ústav klinické mikrobiologie, Farmaceutická fakulta UK, Porodnicko-gynekologická klinika LF UK a Fakultní nemocnice v Hradci Králové.
Metodika:
Rešerše literárních pramenů.
Výsledky:
DM podporuje kolonizaci a v menší míře rozvoj infekcí různé etiologie. U mykóz představuje DM rizikový faktor infekce nejčastěji u kvasinek, zvláště Candida albicans, dále u zástupců plísní Mucorales, některých dimorfních hub (Coccidioides) a původců onychomykóz. Většinou je DM spojený jen se zvýšenou kolonizací v dané anatomické lokalitě (orální dutina, pochva), v případě infekce může být spojený s větším rozsahem nebo intenzitou projevů onemocnění (onychomykóza, mukormykóza). U orofaryngeální a vulvovaginální kandidózy se u diabetiků pravidelně setkáváme se změnou druhového spektra. U pacientek s VVK a DM, zejména ve spojení s vyšším věkem či sklonem k recidivám, lze pozorovat posun spektra k non-albicans druhům, zvláště C. glabrata. Léčba VVK u DM může být komplikována jak nepříznivým antifungálním profilem (C. glabrata), tak antagonistickým vztahem mezi některými azolovými antimykotiky a antidiabetiky na bázi sulfonylurey.
Závěr:
Diabetes mellitus je často zmiňován jako rizikový faktor infekcí, ačkoli v mnoha případech chybí spolehlivá a klinicky ověřená data. To však neznamená, že lze toto onemocnění podceňovat. Naopak, je třeba dostat DM co nejdříve pod kontrolu, a tím zabránit komplikacím v případě rozvoje infekce. U rizikových skupin je nutné přistupovat k pacientkám individuálně a komplexně řešit jejich problémy. Kolonizace pochvy kvasinkami a rozvoj VVK jsou primárně podmíněné hormonálními poměry, funkční mikrobiotou a správně nastavenými mechanismy lokální imunity. Role DM spočívá především v tom, že představuje jeden z důležitých kofaktorů, který může měnit parametry vaginálního prostředí ve prospěch kvasinek, a tím podporovat či usnadňovat rozvoj VVK.
Klíčová slova:
diabetes mellitus – hyperglykémie – rizikové faktory – infekce – houby – kvasinky – Candida albicans – Candida glabrata
ÚVOD
Diabetes mellitus (DM) postihuje zhruba 7–8 % populace v České republice, přitom většinu diabetické populace tvoří diabetici 2. typu, pouze 7,5–10 % diabetiků je postiženo diabetem 1. typu. Je všeobecně známo, že infekční choroby představují signifikantní zdroj morbidity a mortality pro diabetickou populaci. Na straně druhé, dlouhodobému přesvědčení kliniků, že diabetes představuje rizikový faktor pro rozvoj infekčního onemocnění ani zdaleka neodpovídá množství dostupných dat k této problematice. To neznamená, že spojitost mezi DM a infekcí je pouze tradovaným tvrzením bez významnější opory v literatuře, ale spíše že její platnost je dokladována pro specifické skupiny diabetiků a pro určité skupiny mikrobiálních agens [47]. Rovněž platí, že oproti kontrolní populaci u většiny infekcí spojených s DM je, vedle komorbidit a zvýšené mortality, rozdíl spíše nebo pouze v průběhu a intenzitě projevů infekce než ve zvýšené frekvenci [1, 30, 37, 40, 54, 62, 84]. V případě vyšší úmrtnosti však v posledních desetiletích je znát zřetelný pokrok v důsledku lepší diagnostiky DM a jeho kontroly [44].
DIABETES MELLITUS A INFEKČNÍ ONEMOCNĚNÍ
Otázkou tedy je, které pacienty činí DM náchylné k infekcím, a především jak a proč. V tomto ohledu je k dispozici relativně málo klinicky relevantních podkladů, navíc řada z nich nedošla ke stejným závěrům. Obecně lze shrnout, že pacienti s DM jsou častěji kolonizováni nebo častěji trpí infekcemi dolních cest dýchacích, močových cest, kůže či sliznic, v jejichž etiologii se uplatňují zejména grampozitivní koky, enterobakterie, mykobakteria, respirační viry a houby [1, 6, 18, 30, 35, 36, 37, 41, 43, 47, 54, 65, 77]. Příčina sklonu pacientů s DM k infekcím je spojována s nedostatečnou kontrolu glykémie a patofyziologickými faktory, v prvé řadě s ketoacidózou, dále mikro - a makroangiopatií, nejčastěji se však zmiňují specifické změny imunitního systému [58, 80]. Je prokázáno, že polymorfonukleární leukocyty (PMNL), izolované z pacientů s DM, mají poškozenou schopnost chemotaxe, adheze, fagocytózy či baktericidní aktivity v důsledku hyperglykémie [7, 8, 10, 41, 58, 61, 78]. To je obvykle doprovázeno poklesem hladiny leukotrienu B4, prostaglandinu E a tromboxanu B2 [17, 25, 46, 79]. Pokud jde o nežádoucí efekty na protiinfekční imunitu, za kritickou je považována hladina glykémie nad 10 až 12 mmol/l [7, 17, 64]. Výsledky experimentů rovněž naznačily, že hyperglykémie může vést k trvalé stimulaci PMNL a ta k méně výrazné buněčné odpovědi na infekční podnět. Navíc také monocyty a lymfocyty diabetiků mohou mít sníženou antimikrobní aktivitu. Byly rovněž popsány změny buněčné imunity s následným zvýšením hladin prozánětlivých cytokinů (TNF-α, IL-1b, IL-16, IL-18), které podpořily inzulinovou rezistenci prostřednictvím snížení receptoru pro glukózu (transportní protein 4) a zvýšením lipolýzy [41, 78]. Oproti tomu chybí přesvědčivé důkazy o tom, že by diabetici měli zhoršenou humorální imunitu, jak bylo doloženo například schopností zachování normální protilátkové odpovědi po vakcinaci [54]. Na straně druhé, podání inzulinu a kontrola glykémie přímo i nepřímo zlepšuje funkci buněčné imunity [17, 26, 79].
V případě poševní sliznice však vztah její imunity k diabetu, se všemi jejími specifiky, zůstává, i přes znatelný pokrok v posledních letech, nadále nejasný.
DIABETES MELLITUS A MYKOTICKÉ INFEKCE
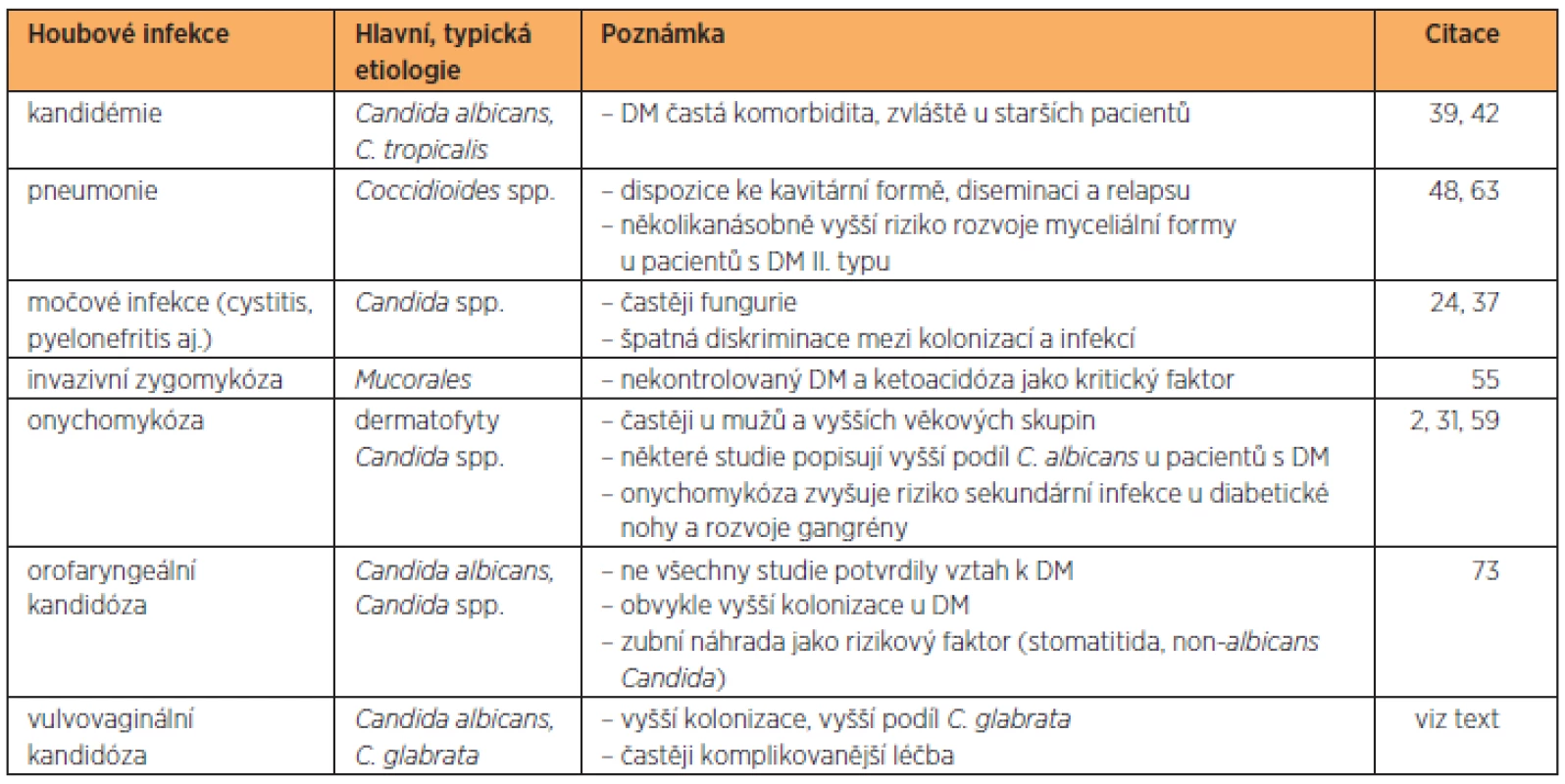
V případě patogenních hub se u diabetiků pravidelně setkáváme s kvasinkami (Candida spp., Cryptococcus spp.), méně často s některými dimorfními (Coccidioides spp.) a vláknitými (Aspergillus spp., Mucorales) houbami (tab. 1) [1, 55]. Klinicky jde zejména o slizniční a kožní infekce vyvolané převážně dermatofyty a kandidami [9, 31, 59, 67, 73]. Vedle toho však můžeme u specifických skupin pacientů pozorovat také zvýšený výskyt systémových mykotických infekcí, jako je mukormykóza či kryptokokóza. Podkladem pro rozvoj těchto mykóz je obvykle vážné postižení či deficit imunitního systému. Do kategorie predispozičních faktorů můžeme řadit agresivní protinádorovou terapii, HIV infekci, transplantace, těžké metabolické poruchy nebo nízkou porodní váhu u novorozenců. Nutno ovšem zdůraznit, že DM není obecně přijímán jako primární příčina mykotických infekcí, ale spíše jako rizikový faktor, který může významně ovlivňovat jejich průběh, rozsah a frekvenci. Příkladem je invazivní mukormykóza, devastující onemocnění s vysokou mortalitou, která přednostně postihuje imunosuprimované jedince s nekontrolovaným DM doprovázeným ketoacidózou.
DIABETES MELLITUS A VULVOVAGINÁLNÍ KANDIDÓZA
Jednou z oblastí, o které se dlouhodobě traduje, že je pod nezanedbatelným vlivem DM, je urogenitální trakt. To platí i pro vulvovaginální kandidózu (VVK), která reprezentuje nejběžnější mykotický zánět genitální sliznice [68]. Postihuje většinu žen během jejich sexuálně aktivního života a co je důležité, obvykle bez zjevné dispozice a systémových rizikových faktorů. S určitou nadsázkou můžeme říci, že o co frekventovaněji je VVK zmiňována v souvislosti s DM, o to hůře se hledají spolehlivé literární doklady. V současnosti jsou z hlediska diagnostiky a léčby rozlišovány dvě základní formy VVK – nekomplikovaná a komplikovaná [69]. Nekomplikovaná VVK je typická akutní forma vyvolaná C. albicans, se kterou má během svého života zkušenost až 75 % ženské populace. U některých žen, přibližně u 40 %, bude následovat jedna nebo více epizod. Přibližně u 3 až 5 % pacientek se může vyvinout rekurentní forma VVK, definovaná jako minimálně čtyři mikrobiologicky potvrzené ataky za rok [69]. Dominantním původcem zůstává C. albicans, která odpovídá za 80 až 90 % všech případů. Vzácněji se setkáváme i s dalšími oportunními druhy kandid, jako je C. glabrata, C. tropicalis, C. parapsilosis nebo pivní kvasinka Saccharomyces cerevisiae. Několik studií zaznamenalo zvyšující se podíl non-albicans Candida druhů, zvláště C. glabrata, a to zejména u pacientek s rekurentní VVK, AIDS, ale také s DM [16, 29, 32, 75].
Diabetes mellitus – imunopatogeneze vulvovaginální kandidózy
Základní rámec pro kolonizaci kvasinkami představuje prostředí pochvy s její nutriční nabídkou (glykogen), specifickými fyzikálně-chemickými podmínkami (pH, dostupnost kyslíku) a imunitou. Vzhledem k menstruačnímu cyklu podléhá mnoho parametrů tohoto prostředí cyklickým změnám vázaným na kolísání hladin pohlavních hormonů (estrogeny, progesteron). Ale do prostředí vaginy se promítají i nepřímé vlivy, které souvisí s výživou, antibiotickou léčbou, sexuální aktivitou, osobní hygienou či způsobem oblékání [13]. V neposlední řadě je zde neopomenutelný faktor samotné kvasinky a její schopnosti se adaptovat na podmínky pochvy, popřípadě rozvoje VVK [72].
Mechanismem, kterým může glukóza stimulovat kandidy, je jednak přímá podpora růstu, jednak indukce tvorby proteinu, který zvyšuje adhezi k vaginálním epiteliálním buňkám [20, 50, 64]. Vedle toho zvýšená hladina glukózy interferuje s opsonizací kvasinky tím, že indukuje expresi povrchového receptoru pro C3 fragment (iC3b) komplementu, který kompetuje s navázáním neutrofilů, a tím brání fagocytóze [27, 34]. Tyto receptory jsou indukovány rovněž transformací kvasinky v myceliální formu [27], která, jak známo, koreluje s invazí sliznice [71]. Hyperglykémie je tak jedním z faktorů, který nepřímo zvyšuje prostřednictvím dimorfního přechodu virulenci C. albicans. Možný vztah glukózy k recidivě VVK naznačilo zjištění, že pacientky s rekurentní VVK mají v moči častěji detekovány cukry, včetně glukózy. Úprava diety se sníženým obsahem cukrů následně vedla k výraznému snížení nových epizod [33]. Nezanedbatelná je rovněž enzymová výbava, zvláště v ní vyniká C. albicans, ve které mají hlavní roli sekreční aspartázy, fosfolipázy, hydrolázy či hyaluronidáza [15, 49].
Vliv DM bývá tradičně vysvětlován horší kontrolou glykémie a z ní plynoucí narušené funkce imunitního systému a poměrů ve vaginální mikrobiotě vlivem dlouhodobě nekompenzovaného diabetu [58]. To může vést ke změně přirozeného spektra vaginální mikroflóry a následně k větší náchylnosti k rozvoji infekcí, včetně těch vyvolaných kandidami [58, 85]. Vysvětlení vyšší vnímavosti ke kolonizaci a infekcím vyvolaným kvasinkami u diabetiků má však zřejmě více příčin. Jde zejména o nepříznivý vliv patofyziologických změn (ketoacidóza, angiopatie) a důsledek narušení některých funkcí imunity, zejména u PMNL (chemotaxe, adheze, fagocytóza, mikrobicidní aktivita). Do jaké míry se tyto mechanismy uplatňují ve vaginálním kompartmentu, není přesně známo.
Vztah VVK, zvláště její rekurentní formy ke zvýšené hladině cukru v krvi zůstává nejasný, protože jednotlivé studie přinesly kontroverzní výsledky. Nebyly nalezeny významné rozdíly v glukózové toleranci mezi pacientkami s rekurentní VVK a zdravými kontrolami [21]. Na druhé straně někteří autoři zaznamenali poruchu glukózové tolerance u nediabetických žen s rekurentní VVK, ale ta byla spíše spojena s obezitou resp. vyšší hodnotou BMI indexu [19, 49]. K podobným závěrům, tj. vyšší výskyt infekčních komplikací – ale u rodiček po císařském řezu, došla i dánská studie [43]. Abnormální tolerance ke glukóze tedy nutně neindikuje DM nebo rekurentní VVK, je však přinejmenším signálem dostat DM pod kontrolu.
Specifický rizikový faktor pro kolonizaci kvasinkami a rozvoj VVK představuje těhotenství, během kterého se může vyvinout gestační DM. I přes nedostatek klinických dat, některá naznačila spojitost s komplikovanými formami VVK, včetně rozvoje rekurentní VVK [83]. Velká čínská studie sledující 16 tisíc těhotných žen zjistila gestační DM u 4,3 % žen, u nichž byl zaznamenán dvojnásobný výskyt rekurentní VVK oproti kontrolám [83]. V souvislosti s tímto nálezem, přišli autoři se zajímavou teorií, kdy kauzalitu obrátili, a to, že rekurentní VVK indikuje u pacientek vyšší vnímavost ke glukózové intoleranci anebo představuje chronický zánět a ten se zase může podílet na mechanismu patogeneze inzulinové tolerance [83]. V případě těhotenství je však nutné mít na paměti, že zároveň dochází k významnému posunu hormonálního milieu směrem k produkci estrogenů a ty výrazně samy o sobě napomáhají kolonizaci kandidami [11, 82].
V případě pochvy je nutné si uvědomit, že představuje typické hormonálně dependentní prostředí s dominantním efektem estradiolu a gestagenů. Jde o komplexní vztah, kde na jedné straně je kvasinka a její výbava a schopnost adaptace k osídlení případně následnému poškození sliznice, na druhé straně vaginální mikrobiom definovaný fyziologickými parametry, rezidentní mikrobiotou a specificky vybavenou, lokální imunitou hostitele. Uvedená problematika je tedy zajímavá i z obecného ekologického pohledu vzájemného vztahu kvasinky a člověka, který v závislosti na řadě podmínek měnících se během života ženy balancuje mezi komenzalismem a parazitismem. Kvasinky, dominantně Candida albicans coby hlavní původce infekčního zánětu pochvy však nesplňuje typickou představu komenzálního druhu a způsob jejího chování klade řadu otázek praktickým gynekologům, klinickým mykologům a nejnověji i experimentálním biologům. Situaci komplikuje rovněž skutečnost, že nelze mechanicky přejímat obecné poznatky o DM. Většina byla získaná ze studia poměrů v orální dutině, protože přinejmenším z hlediska imunity a její interakce s kandidami je tato anatomická lokalita nastavená odlišně, a nelze ji tedy ztotožňovat s vaginální [23]. A to logicky vede k oprávněné obezřetnosti při popisu a interpretaci experimentálních i klinických dat.
V souvislosti se zvýšenou vnímavostí ke kandidové infekci bývají v posledních letech zmiňovány genetické polymorfismy. Příkladem takového kofaktoru je defekt lokální imunity v podobě polymorfismu genu DEFB1 pro β-defensin 1, který se u diabetiků vyskytuje častěji, a mohl by tak vysvětlovat, proč jsou diabetici častěji kolonizováni kandidami [38]. Mechanismus by mohl spočívat ve snížené expresi antimikrobiálních kationických peptidů epiteliálními buňkami u osob s tímto typem polymorfismu, čímž by bylo výrazně sníženo antiadhezivní a antiinvazivní působení defensinů. Další zajímavým zjištěním vyplývajícím ze studia nosičství polymorfismu pro β-defensin a jeho vazby na přítomnost kandid v ústní dutině bylo, že vyšší počty kvasinek u diabetiků oproti kontrole (ne-diabetici) se týkaly pouze C. glabrata a C. tropicalis, ne však C. albicans [38]. Jinými slovy to může vysvětlovat zvýšený podíl C. glabrata a C. tropicalis u diabetiků, který zaznamenala řada studií, včetně těch, které se týkaly vaginálního kompartmentu. Navíc, u pacientek s rekurentní VVK bylo doloženo několik polymorfismů, zejména genu MBL2 kódujícího protein pro manózu vázající lektin [4, 5, 81].
Diabetes mellitus a epidemiologie vulvovaginální kandidózy
Každopádně, co je doloženo u diabetiček s VVK resp. s kvasinkovou kolonizací relativně velmi dobře, je častější výskyt non-albicans druhů Candida (nonCA), především C. glabrata. Studie DeLeona a spol. zjistila, že téměř 38 % diabetiček bylo kolonizováno C. glabrata, zejména s DM typu II, kde tvořily 54 % všech kvasinkových izolátů [16]. Také těhotné ženy s gestačním DM a DM typu I mohou být výrazněji kolonizovány C. glabrata (25 až 39 %) [85]. K podobnému závěru došla indická studie, ve které byla C. glabrata prokázána u 39 % diabetiček oproti 30 % u kontrolní skupiny [28]. Některé studie navíc naznačily, že mezi ženami s DM je významněji zastoupena vedle C. glabrata také C. tropicalis [28, 53], ale obvykle z nich nelze zjistit specifické údaje, které by umožňovaly korelovat tyto nálezy s dalšími predispozičními a rizikovými faktory [3, 14, 22, 51, 52].
Stále tedy zůstává otázka, zda DM je nezávislý faktor kolonizace kvasinkami, nebo jeden ze spolufaktorů. Australská studie, která sledovala výskyt kandid v pochvě, zjistila, že 21 % žen bylo kolonizováno kvasinkami s dominancí C. albicans (89 %) a s C. glabrata jako nejčastěji se vyskytující nonCA, ať už samostatně, nebo společně s C. albicans. Co však bylo statisticky významné, byl vyšší průměrný věk žen s kolonizací nonCA resp. C. glabrata (43 roků) v porovnání s C. albicans (33 roků) [32]. Podobný vztah mezi věkem a zvýšeným podílem nonCA zaznamenali i jiní autoři [16]. Velmi dobře designovaná holandská studie zaměřená obecně na DM a infekce prokázala, že ženy s DM I. i II. typu mají zvýšené riziko pro infekce močových cest, kožní a slizniční infekce, včetně mykotického původu, a také pro komplikace v jejich průběhu, zejména recidivy [47].
V případě VVK je z klinického hlediska zajímavá rovněž informace o vyšší perzistenci kandid u diabetiček přeléčených jednorázovým podáním flukonazolu, která ve svém důsledku může vést k relapsu. Co je důležité, schopnost přežívat v přítomnosti antimykotika se výlučně nevztahovala na rezistentnější C. glabrata, ale i na C. albicans, i když snížená citlivost nepochybně dává C. glabrata komparativní výhodu [29]. Na druhé straně in vitro citlivost kvasinkových kmenů obou druhů k flukonazolu byla u diabetiček i kontrol obdobná před terapií i po terapii. Uvedené závěry byly popsány u pacientek s DM II. typu, otázkou zůstává, zda je lze vztáhnout i na DM I. typu [29]. Jedno z vysvětlení, proč selhává široce používané jednorázové podání flukonazolu (150 mg/d) více u diabetických než nediabetických pacientek, může spočívat v lékové interakci. Pacienti s DM běžně používají antidiabetika na bázi sulfonyl-urey. Výsledkem působení flukonazolu je zvýšení plazmatické koncentrace těchto antidiabetik, což následně potencuje jejich hypoglykemizující efekt a ten potažmo rozvoj těžké hypoglykémie [66]. Obecně podmínky vhodné pro růst kandid jako důsledek zvýšené koncentrace glukózy mohou do určité míry vysvětlovat perzistenci kandid a nižší účinnost antimykotické terapie v delším časovém horizontu (14 vs. 35 dnů), jak nezávisle na druhové etiologii vyplynulo ze studie, která srovnávala různé režimy léčby VVK [70]. V souvislosti s kolonizací kandidami jsou velmi zajímavé závěry studie, která sledovala výskyt kandid (potvrzený kultivačním nálezem) u chirurgických pacientů s DM II. typu, kteří brali statiny. U skupiny léčené statiny (převážně atorvastatin) byla zjištěna statisticky nižší kolonizace kandidami, a to i v případě, kdy byla léčba přerušena během chirurgického výkonu [74]. Experimentální data dokládají antifungální a protizánětlivý účinek statinů, pravděpodobně zásahem do metabolické dráhy syntézy cholesterolu [45, 76].
Volba terapie u diabetiček s VVK by tedy měla být uvážlivá s ohledem na jejich základní medikaci a komorbidity. To platí dvojnásobně, pokud je etio-logickým agens C. glabrata, i když v jejím případě není flukonazol primárně indikován. Vzhledem k tomu, že se tento druh v literatuře objevuje vedle DM také ve spojení s vyšším věkem a v některých studiích i recidivujícími formami VVK, je nutné zvážit všechny aspekty léčby.
Lze tedy shrnout, že pacientky s DM patří do rizikové skupiny VVK, ale preskripci antimykotika by mělo předcházet důkladné vyšetření, včetně potvrzení kandidové etiologie. Základem léčby by měla být topická antimykotika, popřípadě, podle intenzity projevů, doplněná o systémové preparáty; přednost by měly mít dlouhodobé režimy. Je třeba počítat, a v případě pozitivní kultivace dourčit a testovat na citlivost k antimykotikům, s C. glabrata a její špatnou odezvou na azolové preparáty [11, 12, 56, 57]. V souvislosti s nálezem C. glabrata se nabízí zvážit možnost, zda tento druh neindikuje přítomnost DM, a změřit hladinu krevního cukru. Kontrola glykémie zůstává nepochybně základním opatřením u pacientek s DM, a nelze opomenout ani případnou úpravu hormonálních a mikrobiálních poměrů v pochvě.
ZÁVĚR
Vztah DM a kvasinek je zastřen řadou mýtů a domněnek a bývá často přeceňován. To v horším případě může vést ke zbytečné zátěži žen antimykotickými preparáty. Jedna taková studie ukázala, že čtvrtině žen s DM a vaginálním dyskomfortem byla podána antifungální terapie, aniž by bylo provedeno řádné mikrobiologické vyšetření. Zpětnou analýzou vyšlo najevo, že pouze jedna šestina pacientek měla pozitivní kultivační nález kvasinky, a bylo tedy oprávněné uvažovat o kvasinkovém původu infekce a antimykotické léčbě [60].
Absence racionálního přístupu k diagnóze vaginálního dyskomfortu nic nemění na tom, že diabetes mellitus je považován za významný rizikový faktor pro vznik VVK, i když ještě detailně neznáme anebo nerozumíme všem aspektům epidemiologie a imunopatogeneze VVK. Současné znalosti naznačují, že DM hraje významnější roli spíše jen u určité části pacientek s VVK. Kolonizace pochvy kvasinkami a výskyt VVK jsou primárně závislé na hormonálních poměrech, funkční mikrobiotě a správně nastavených mechanismech lokální imunity. Diabetes mellitus představuje jeden z důležitých kofaktorů, který může měnit parametry vaginálníno prostředí ve prospěch kvasinek, a tak podpořit rozvoj VVK.
Poděkování
Práce byla podpořena Centrem základního výzkumu LC531 Ministerstva školství, mládeže a tělovýchovy České republiky a grantem SVV 266902.
Doc. RNDr. Vladimír Buchta, CSc.
Ústav klinické mikrobiologie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: vladimir.buchta@fnhk.cz
Zdroje
1. Ahmed, MS., Reid, E., Khardori, N. Respiratory infections in diabetes: Reviewing the risks and challenges. J Respir Dis, 2008, 29, 7, p. 285–293.
2. Alteras, I., Saryt, E. Prevalence of pathogenic fungi in the toe-webs and toe-nails of diabetic patients. Mycopathologia, 1979, 67, p. 157–159.
3. Arzeni, D., Del Poeta, M., Simonetti, O., et al. Prevalence and antifungal susceptibility of vaginal yeasts in outpatients attending a gynecological center in Ancona, Italy. Eur J Epidemiol, 1997, 13, 4, p. 447–450.
4. Babula, O., Lazdane, G., Kroica, J., et al. Relation between recurrent vulvovaginal candidiasis, vaginal concentrations of mannose-binding lectin, and a mannose-binding lectin gene polymorphism in Latvian women. Clin Infect Dis, 2003, 37, 5, p. 733–737.
5. Babula, O., Lazdāne, G., Kroica, J., et al. Frequency of interleukin-4 (IL-4) – 589 gene polymorphism and vaginal concentrations of IL-4, nitric oxide, and mannose-binding lectin in women with recurrent vulvovaginal candidiasis. Clin Infect Dis, 2005, 40, 9, p. 1258–1262.
6. Bader, MS. Diabetic foot infection. Am Fam Physician, 2008, 78, 1, p. 71–79.
7. Bagdade, JD., Root, RK., Bulger, RJ. Impaired leukocyte function in patients with poorly controlled diabetes. Diabetes, 1974, 23, 1, p. 9–15.
8. Bagdade, JD., Stewart, M., Walters, E. Impaired granulocyte adherence. A reversible defect in host defense in patients with poorly controlled diabetes. Diabetes, 1978, 27, 6, p. 677–681.
9. Belazi, M., Velegraki, A., Fleva, A., et al. Candidal over-growth in diabetic patients: potential predisposing factors. Mycoses, 2005, 48, 3, p. 192–196.
10. Bhattacharya, SK., Shastri, S., Mahajan, P., et al. Poly-morphonuclear leukocyte function in type-2 diabetes mellitus patients and its correlation with glycemic control. Nepal Med Coll J, 2007, 9, p. 111–116.
11. Bohannon, NJ. Treatment of vulvovaginal candidiasis in patients with diabetes. Diabetes Care, 1998, 21, 3, p. 451–456.
12. Buchta, V., Slezák, R., Špaček, J., et al. Současné možnosti léčby kožních a slizničních mykóz. Med pro Praxi, 2009, 6, 3, s. 155–164.
13. Buchta, V., Špaček, J. Úskalí současné laboratorní diagnostiky a terapie vulvovaginální kandidózy. Klin Mikrobiol Infekc Lek, 2011,17, 5, s. 158–163.
14. Corsello, S., Spinillo, A., Osnengo, G., et al. An epidemiological survey of vulvovaginal candidiasis in Italy. Eur J Obstet Gynecol Reprod Biol, 2003, 110, 1, p. 66–72.
15. Calderone, RA., Fonzi, WA. Virulence factors of Candida albicans. Trends Microbiol, 2001, 9, 7, p. 327–335.
16. de Leon, EM., Jacober, SJ., Sobel, JD., Foxman, B. Prevalence and risk factors for vaginal Candida colonization in women with type 1 and type 2 diabetes. BMC Infect Dis, 2002, 2 : 1. Epub 2002 Jan 30.
17. Delamaire, M., Maugendre, D., Moreno, M., et al. Impaired leukocyte function in diabetic patients. Diabet Med. 1997, 14, 1, p. 29–34.
18. Donders, GG. Lower genital tract infections in diabetic women. Curr Infect Dis Rep, 2002, 4, p. 536–539.
19. Donders, GG., Prenen, H., Verbeke, G., Reybrouck, R. Impaired tolerance for glucose in women with recurrent vaginal candidiasis. Am J Obstet Gynecol, 2002, 187, 4, p. 989–993.
20. Edwards, JE. Jr, Gaither, TA., O‘Shea, JJ., et al. Expression of specific binding sites on Candida with functional and antigenic characteristics of human complement receptors. J Immunol, 1986, 137, 11, p. 3577–3583.
21. Ehrström, S., Yu, A., Rylander, E. Glucose in vaginal secretions before and after oral glucose tolerance testing in women with and without recurrent vulvovaginal candidiasis. Obstet Gynecol, 2006, 108, 6, p. 1432–1437.
22. Fan, SR., Liu, XP., Li, JW. Clinical characteristics of vulvovaginal candidiasis and antifungal susceptibilities of Candida species isolates among patients in southern China from 2003 to 2006.J Obstet Gynaecol Res, 2008, 34, 4, p. 561–566.
23. Fidel, PL. Jr. Distinct protective host defenses against oral and vaginal candidiasis. Med Mycol, 2002, 40, 4, p. 359–375.
24. Fisher, JF., Newman, CL., Sobel, JD. Yeast in the urine: solutions for a budding problem. Clin Infect Dis, 1995, 20, p. 183–189.
25. Gallacher, SJ., Thomson, G., Fraser, WD., et al. Neutrophil bactericidal function in diabetes mellitus: evidence for association with blood glucose control. Diabet Med, 1995, 12, p. 916–920.
26. Geerlings, SE., Hoepelman, AI. Immune dysfunction in pa-tients with diabetes mellitus (DM). FEMS Immunol Med Microbiol, 1999, 26, p. 259–265.
27. Gilmore, BJ., Retsinas, EM., Lorenz, JS., Hostetter, MK. An iC3b receptor on Candida albicans: structure, function, and correlates for pathogenicity. J Infect Dis, 1988, 157, p. 38–43.
28. Goswamim, R., Dadhwal, V., Tejaswi, S., et al. Species-specific prevalence of vaginal candidiasis among patients with diabetes mellitus and its relation to their glycaemic status. J Infect, 2000, 41, 2, p. 162–166.
29. Goswami, D., Goswami, R., Banerjee, U., et al. Pattern of Candida species isolated from patients with diabetes mellitus and vulvovaginal candidiasis and their response to single dose oral fluconazole therapy. J Infect, 2006, 52, p. 111–117.
30. Greene, MT., Chang, R., Kuhn, L., Rogers, MA., et al. Predictors of hospital-acquired urinary tract-related bloodstream infection. Infect Control Hosp Epidemiol, 2012, 33, 10, p. 1001–1007.
31. Gupta, AK., Humke, S. The prevalence and management of onychomycosis in diabetes patients. Eur J Dermatol, 2000, 10, p. 379–384.
32. Holland, J., Young, ML., Lee, O., C-A Chen S. Vulvovaginal carriage of yeasts other than Candida albicans. Sex Transm Infect, 2003, 79, p. 249–250.
33. Horowitz, BJ., Edelstein, SW., Lippman, L. Sugar chromatography studies in recurrent Candida vulvovaginitis. J Reprod Med, 1984, 29, 7, p. 441–443.
34. Hostetter, PW. Perspectives in diabetes: handicaps to host defence. Effects of hyperglycemia on C3 and Candida albicans. Diabetes, 1990, 39, p. 271–275.
35. Hu, KK., Boyko, EJ., Scholes, D., et al. Risk factors for urinary tract infections in postmenopausal women. Arch Intern Med, 2004, 164, p. 989–993.
36. Jeon, CY., Murray, MB. Diabetes mellitus increases the risk of active tuberculosis: a systematic review of 13 observational studies. PLoS Med, 2008, 5, e152.
37. Joshi, N., Caputo, GM., Weitekamp, MR., Karchmer, AW. Infections in patients with diabetes mellitus. N Engl J Med, 1999, 341, 25, p. 1906–1912.
38. Jurevic, RJ., Bai, M., Chadwick, RB., et al. Single-nucleotide polymorphisms (SNPs) in human beta-defensin 1: high-throughput SNP assays and association with Candida carriage in type I diabetics and nondiabetic controls. J Clin Microbiol, 2003, 41, p. 90–96.
39. Kao, AS., Brandt, ME., Pruitt, WR., et al. The epidemiology of candidemia in two United States cities: results of a population-based active surveillance. Clin Infect Dis, 1999, 29, 5, p. 1164–1170.
40. Kornum, JB., Thomsen, RW., Riis, A., et al. Type 2 diabetes and pneumonia outcomes: a population-based cohort study. Diabetes Care, 2007, 30, 9, p. 2251–2257.
41. Koziel, H., Koziel, MJ. Pulmonary complications of diabetes mellitus. Infect Dis Clin North Am, 1995, 9, p. 65–96.
42. Krcmery, V., Jurga, L., Mateicka, F., Sulcová, M. Fungaemia in elderly patients. Int J Antimicrob Agents, 2001, 17, 5, p. 419–421.
43. Leth, RA., Uldbjerg, N., Nørgaard, M., et al. Obesity, diabetes, and the risk of infections diagnosed in hospital and post-discharge infections after cesarean section: a prospective cohort study. Acta Obstet Gynecol Scand, 2011, 90, 5, p. 501–509.
44. Lind, M., Garcia-Rodriguez, LA., Booth, GL., et al. Mortality trends in patients with and without diabetes in Ontario, Canada and the UK from 1996 to 2009: a population-based study. Diabetologia, 2013 Jun 22. [Epub ahead of print]
45. McFarlane, SI., Muniyappa, R., Francisco, R., Sowers, JR. Clinical review 145: pleiotropic effects of statins: lipid reduction and beyond. J Clin Endocrinol Metab, 2002, 87, 4, p. 1451–1458.
46. Muchova, J., Liptakova, A., Orszaghova, Z., et al. Antioxidant systems in polymorphonuclear leucocytes of type 2 diabetes mellitus. Diabet Med, 1999, 16, p. 74–78.
47. Muller, LM., Gorter, KJ., Hak, E., et al. Increased risk of common infections in patients with type 1 and type 2 diabetes mellitus. Clin Infect Dis, 2005, 41, 3, p. 281–288.
48. Muñoz-Hernández, B., Martínez-Rivera, MA., Palma Cortés, G., et al. Mycelial forms of Coccidioides spp. in the parasitic phase associated to pulmonary coccidioidomycosis with type 2 diabetes mellitus. Eur J Clin Microbiol Infect Dis, 2008, 27, 9, p. 813–820.
49. Nowakowska, D., Kurnatowska, A., Stray-Pedersen, B., Wilczyński, J. Activity of hydrolytic enzymes in fungi isolated from diabetic pregnant women: is there any relationship between fungal alkaline and acid phosphatase activity and glycemic control? APMIS, 2004, 112, 6, p. 374–383.
50. Nwobu, RA., Agbonlahor, DE., Odugbemi, TO. Adherence of Candida albicans to human vaginal epithelial cells. East Afr Med J, 1997, 74, 6, p. 389–391.
51. Ozcan, SK., Budak, F., Yucesoy, G., et al. Prevalence, susceptibility profile and proteinase production of yeasts causing vulvovaginitis in Turkish women. APMIS, 2006, 114, 2, p. 139–145.
52. Paulitsch, A., Weger, W., Ginter-Hanselmayer, G., et al. A 5-year (2000–2004) epidemiological survey of Candida and non-Candida yeast species causing vulvovaginal candidiasis in Graz, Austria. Mycoses, 2006, 49, 6, p. 471–475.
53. Peer, AK., Hoosen, AA., Seedat, MA., et al. Vaginal yeast infections in diabetic women. S Afr Med J, 1993, 83, 10, p. 727–729.
54. Peleg, AY., Weerarathna, T., McCarthy, JS., Davis, TM. Common infections in diabetes: pathogenesis, management and relationship to glycaemic control. Diabetes Metab Res Rev, 2007, 23, p. 3–13.
55. Petrikkos, G., Skiada, A., Lortholary, O., et al. Epidemiology and clinical manifestations of mucormycosis. Clin Infect Dis, 2012, 54 Suppl 1, p. S23–S34.
56. Ray, D., Goswami, R., Banerjee, U., et al. Prevalence of Candida glabrata and its response to boric acid vaginal suppositories in comparison with oral fluconazole in patients with diabetes and vulvovaginal candidiasis. Diabetes Care, 2007, 30, 2, p. 312–317.
57. Ray, D., Goswami, R., Dadhwal, V., et al. Prolonged (3-month) mycological cure rate after boric acid suppositories in diabetic women with vulvovaginal candidiasis. J Infect, 2007, 55, 4, p. 374–377.
58. Rayfield, EJ., Ault, MJ., Keusch, GT., et al. Infection and diabetes: the case for glucose control. Am J Med, 1982, 72, 3, p. 439–450.
59. Rich, P., Hare, A. Onychomycosis in special patient population: focus on the diabetic. Int J Dermatol, 1999, 38, suppl. 2, p. 17–19.
60. Rowe, BR., Logan, MN., Farrell, I., Barnett, AH. Is candidiasis the true cause of vulvovaginal irritation in women with diabetes mellitus? J Clin Pathol, 1990, 43, 8, p. 644–645.
61. Saiepour, D., Sehlin, J., Oldenborg, PA. Insulin inhibits phagocytosis in normal human neutrophils via PKC alpha/beta-dependent priming of F-actin assembly. Inflamm Res, 2006, 55, p. 85–91.
62. Saint, S., Kaufman, SR., Rogers, MA., et al. Risk factors for nosocomial urinary tract-related bacteremia: a case-control study. Am J Infect Control, 2006, 34, 7, p. 401–407.
63. Santelli, AC., Blair, JE., Roust, LR. Coccidioidomycosis in patients with diabetes mellitus. Am J Med, 2006, 119, 11, p. 964–969.
64. Segal, E., Soroka, A., Schechter, A. Correlative relationship between adherence of Candida albicans to human vaginalepithelial cells in vitro and candidal vaginitis. Sabouraudia, 1984, 22, 3, p. 191–200.
65. Shah, BR., Hux, JE. Quantifying the risk of infectious diseases for people with diabetes. Diabetes Care, 2003, 26, p. 510–513.
66. Schelleman, H., Bilker, WB., Brensinger, CM., et al. Anti-infectives and the risk of severe hypoglycemia in users of glipizide or glyburide. Clin Pharmacol Ther, 2010, 88, 2, p. 214–222.
67. Skořepová, M. Mykózy a diabetes. Vnitr Lek, 2006, 52, 5, s. 470–473.
68. Sobel, JD. Vulvovaginal candidiasis. Lancet, 2007, 369, 9577, p. 1961–1971.
69. Sobel, JD., Faro, S., Force, RW., et al. Vulvovaginal candidiasis: epidemiologic, diagnostic, and therapeutic considerations. Am J Obstet Gynecol, 1998, 178, 2, p. 203–211.
70. Sobel, JD., Kapernick, PS., Zervos, M., et al. Treatment of complicated Candida vaginitis: comparison of single and sequential doses of fluconazole. Am J Obstet Gynecol, 2001, 185, 2, p. 363–369.
71. Sobel, JD., Mueller, G., Buckley, H. Critical role of germ tube formation in the pathogenesis of candidal vaginitis. Infect Immun, 1984, 44, p. 576–579.
72. Soll, DR. Candida commensalism and virulence: the evolution of phenotypic plasticity. Acta Trop, 2002, 81, 2, p. 101–110.
73. Soysa, NS., Samaranayake, LP., Ellepola, AN. Diabetes mellitus as a contributory factor in oral candidosis. Diabet Med, 2006, 23, 5, p. 455–459.
74. Spanakis, EK., Kourkoumpetis, TK., Livanis, G., et al. Statin therapy and decreased incidence of positive Candida cultures among patients with type 2 diabetes mellitus undergoing gastrointestinal surgery. Mayo Clin Proc, 2010, 85, 12, p. 1073–1079.
75. Spinillo, A., Capuzzo, E., Gulminetti, R., et al. Prevalence of and risk factors for fungal vaginitis caused by non-albicans species. Am J Obstet Gynecol, 1997, 176, 1, Pt 1, p. 138–141.
76. Sun, HY., Singh, N. Antimicrobial and immunomodulatory attributes of statins: relevance in solid-organ transplant recipients. Clin Infect Dis, 2009, 48, 6, p. 745–755.
77. Tuazon, CU. Skin and skin structure infections in the patient at risk: carrier state of Staphylococcus aureus. Am J Med, 1984, 76, 5A, p. 166–171.
78. Turina, M., Fry, DE., Polk, HC. Jr. Acute hyperglycemia and innate immune system: clinical, cellular, and molecular aspects. Crit Care Med,. 2005, 33, p. 1624–1633.
79. Valerius, NH., Eff, C., Hansen, NE., et al. Neutrophil and lymphocyte function in patients with diabetes mellitus. Acta Med Scand, 1982, 211, p. 463–472.
80. Vracko, R., Thorning, D., Huang, TW. Basal lamina of alveolar epithelium and capillaries: quantitive changes with aging and diabetes mellitus. Am Rev Respir Dis, 1979, 120, p. 973–983.
81. Wojitani, MD., de Aguiar, LM., Baracat, EC., Linhares, IM. Association between mannose-binding lectin and interleukin-1 receptor antagonist gene polymorphisms and recurrent vulvovaginal candidiasis. Arch Gynecol Obstet, 2012, 285, 1, p. 149–153.
82. Xu, J., Sobel, JD. Candida vulvovaginitis in pregnancy. Curr Infect Dis Rep, 2004, 6, 6, p. 445–449.
83. Yang, H., Wei, Y., Gao, X., et al. Risk factors for gestational diabetes mellitus in Chinese women: a prospective study of 16,286 pregnant women in China. Diabet Med, 2009, 26, 11, p. 1099–1104.
84. Zanobetti, A., Schwartz, J. Are diabetics more susceptible to the health effects of airborne particles? Am J Respir Crit Care Med, 2001, 164, 5, p. 831–833.
85. Zheng, NN., Guo, XC., Liv, W., et al. Characterization of the vaginal fungal flora in pregnant diabetic women by 18S rRNA sequencing. Eur J Clin Microbiol Infect Dis, 2013, 32, 8, p. 1031–1040.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2013 Číslo 6
-
Všechny články tohoto čísla
- Osmdesát pět let samostatného porodnicko-gynekologického oddělení v Hradci Králové a 75 let budovy porodnické a gynekologické kliniky
- Lze považovat i na začátku třetího tisíciletí primární karcinom vejcovodu za enigma?
- Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti
- Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
- Jaký je aktuální stav diagnostiky vulvovaginálního dyskomfortuv České republice? Pilotní analýza
- Vezikouterinní vlasová píštěl osm let po císařském řezu – kazuistika
- Variabilita v načasování dělení lidských embryí monitorovaných systémem time-lapse v závislosti na věku pacientky
- Je diabetes mellitus rizikový faktor kvasinkového poševního zánětu?
- Proteiny rezistence LRP, Pgp,MRP1, MRP3 a MRP5 u pacientek s karcinomem ovaria
- Transuretrální aplikace polyacrylamid hydrogelu (Bulkamidu®) při léčbě ženské stresové inkontinence močia změny léčebného efektu v závislosti na čase od operace
- Incidence, etiologie a klinický význam trombocytopenie v graviditě
- Epidemiologie, etiologie a diagnostika nykturie
- Postup u předčasného porodu s plodem na hranici viability (22.-25. týden) těhotenství
- Vliv způsobu porodu na ženskou sexualitu
- Vzpomínka na MUDr. Jana Kvasničku, CSc.
- Vzpomínka na prof. MUDr. Miloslava Uhra, CSc
- Rejstříky
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Postup u předčasného porodu s plodem na hranici viability (22.-25. týden) těhotenství
- Management předčasného odtoku plodové vody s ohledem na zánětlivé komplikace – naše zkušenosti
- Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
- Vliv způsobu porodu na ženskou sexualitu
