Nové technologie a perspektivy analýzymetabolomu embrya
The new technologies for the analytical examination of the embryonic metabolome and its prospects
Objective:
To review current technologies for the analytical examination of the embryonic metabolome and its perspectives.
Design:
Review article.
Setting:
Department of Gynecology and Obstetrics, Faculty of Medicine, Masaryk University, and University Hospital, Brno, Department of Biochemistry, Faculty of Science and CEITEC, Masaryk University, Brno.
Methods and results:
Nowadays, very sensitive analytical technologies are available. They enable exact measurement of various molecules – products of embryo metabolism during first days of cultivation. The capillary electrophoresis is one of promising method. Recent studies analysed metabolic differences between embryos that result in a pregnancy and those that do not. Amino acid levels, glucose or pyruvate in the embryo culture media were analysed most frequently. However, results of these studies are ambiguous.
Conclusions:
The capillary electrophoresis with contactless conductivity detection may provide a useful data of the embryonic metabolome. A comprehensive analysis of the used culture medium may represent a valuable adjunct to morphological criteria for enhanced rates of implantation and delivery.
Key words:
metabolomics, metabolome analysis, capillary electrophoresis, embryo, assisted reproductive techniques.
Autoři:
I. Crha 1
; A. Mádr 2; J. Musilová 2; Z. Glatz 2; J. Žáková 1; P. Ventruba 1
Působiště autorů:
Gynekologicko-porodnická klinika LF MU a FN Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA
1; Ústav biochemie, Přírodovědecká fakulta a CEITEC, Masarykova univerzita, Brno, vedoucí prof. RNDr. Z. Glatz, CSc.
2
Vyšlo v časopise:
Ceska Gynekol 2012; 77(6): 502-506
Souhrn
Cíl studie:
Uvést stručný přehled současných metod pro analýzu metabolomu embrya, vlastních zkušeností v této oblasti a perspektivy dalšího vývoje.
Typ studie:
Literární přehled.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno; Ústav biochemie, Přírodovědecká fakulta a CEITEC, Masarykova univerzita, Brno.
Předmět a metoda studie:
V současné době jsou k dispozici vysoce citlivé analytické metody umožňující přesné stanovení řady molekul, které souvisí s látkovou přeměnou – metabolismem – embrya v prvních dnech jeho vývoje. Jednou z perspektivních metod je kapilární elektroforéza. V uplynulých letech byly analyzovány parametry metabolismu embryí kultivovaných in vitro a byl hodnocen jejich vztah k morfologii a dosažení těhotenství. Pozornost se soustředila nejčastěji na metabolismus aminokyselin, glukózy a pyruvátu. Výsledky studií však mají zatím nejednoznačné výsledky.
Závěr:
Analýza kultivačního média kapilární elektroforézou patří ke slibným metodám stanovení metabolomu. Rozsáhlý výzkum přináší nové poznatky, které by ve svém výsledku měly vést k vytvoření klinicky použitelné metody výběru embrya a zvýšení efektivity transferu jednoho embrya.
Klíčová slova:
metabolomika, analýza metabolomu, kapilární elektroforéza, embryo, asistovaná reprodukce.
ÚVOD
Tradiční systémy hodnocení morfologie zárodečných buněk a embryí dosáhly svého limitu při výběru optimálního embrya pro transfer. Zůstávají sice stále užitečným nástrojem zkušených embryologů, ale další pokrok v této oblasti vyžaduje přesnější informace o fyziologické aktivitě jednotlivých embryí. V současné době jsou k dispozici vysoce citlivé analytické techniky umožňující přesnou detekci molekul, které souvisí s metabolismem embrya v prvních dnech jeho vývoje. Cílem této práce je uvést stručný přehled současných metod stanovení metabolomu embrya, vlastních zkušeností v této oblasti a perspektivy dalšího vývoje.
METABOLOM
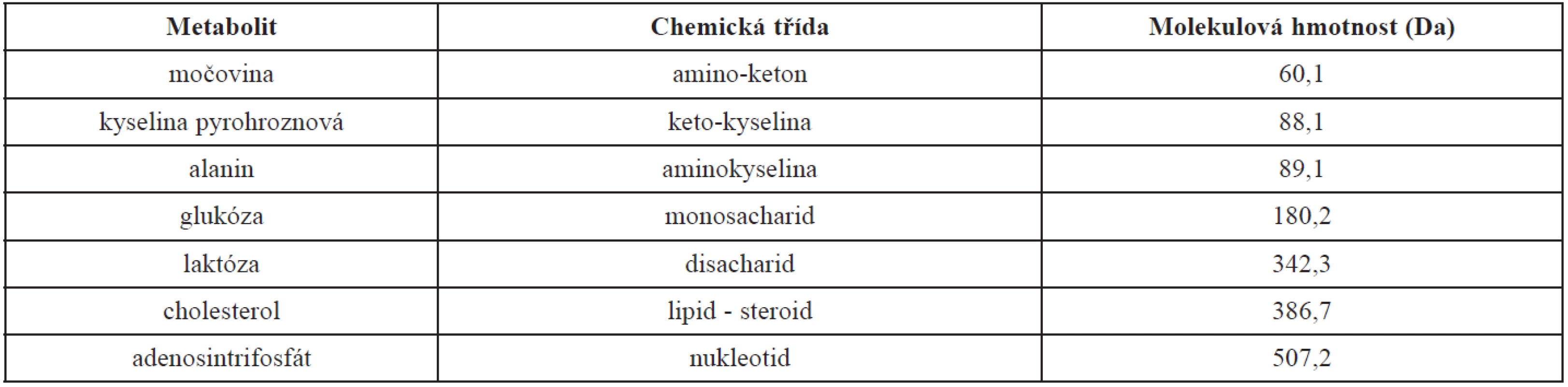
Pro pochopení studií zabývajících se stanovením metabolomu je důležité znát správné názvosloví a vzájemné souvislosti jednotlivých termínů (tab. 1) [11]. Termín metabolomika je v oblasti výzkumu chápán většinou jako komplexní analýza metabolomu v biologickém vzorku, např. „target analysis“, „fingerprinting“, „footprinting“ aj. Základní definice těchto termínů byly uvedeny již v roce 2002 [5] a upřesněny v roce 2005 [18]. Příklady metabolitů, jejich chemická třída a molekulární hmotnost jsou uvedeny v tabulce 2. Různé postupy analýzy jsou aplikovány s cílem rozlišit rozdíly v koncentracích jednotlivých metabolitů, ke kterým dochází v souvislosti s expresí jednotlivých genů a následnou aktivitou vznikajících proteinů nebo při změnách v prostředí buňky. Protože jednotlivé metabolity jsou až výsledkem všech předchozích regulačních procesů na úrovni genomu a proteomu, dávají cennou informaci o výsledné reakci. Mohutný výzkum v této oblasti dokládá i nárůst počtu vědeckých publikací týkajících se metabolomu – z několika desítek v roce 2002 na několik tisíc v roce 2011.

VZTAH METABOLISMU EMBRYA A REPRODUKČNÍHO POTENCIÁLU
V uplynulých letech byl analyzován metabolismus embryí kultivovaných in vitro a hodnotil se jejich vztah k morfologii a dosažení těhotenství. Pozornost se soustředila nejčastěji na metabolismus aminokyselin, glukózy a pyruvátu. Aminokyseliny jsou základními stavebními jednotkami proteinů a jako takové jsou součástí kultivačních médií. Změny hladin aminokyselin odrážejí metabolické funkce dělících se buněk. Glukóza a pyruvát patří k základním látkám, ze kterých embryo získává energii. V časných stadiích vývoje je hlavním zdrojem energie pyruvát a laktát. Schopnost metabolizovat glukózu se zvyšuje při přechodu z moruly do blastocysty.
ANALYTICKÉ METODY PRO STANOVENÍ METABOLOMU
Spolehlivé stanovení metabolitů biologických systémů vyžaduje adekvátní metody analýzy. K nejčastěji využívaným metodám patří následující.
Hmotnostní spektrometrie
Hmotnostní spektrometrie (MS – mass spectrometry) patří k nejčastěji využívaným metodám analýzy metabolomu. Je založena na ionizaci a fragmentaci jednotlivých látek a následné separaci vzniklých iontů podle poměru hmotnost/náboj a jejich detekce. MS je velmi citlivá metoda. Umožňuje detekci metabolitů vyskytujících se v mikromolárních i nižších koncentracích ve vzorku, což odpovídá požadavkům pro analýzu metabolomu. MS umožňuje nejen kvantitativní analýzu, ale díky znalosti poměru hmotnost/náboj a povahy fragmentace umožňuje identifikaci konkrétního metabolitu [9]. MS lze využít samostatně při přímém zavedení vzorku do iontového zdroje nebo v kombinaci s nějakou separační technikou. Při kombinaci MS a vhodné separační techniky se redukuje komplexní charakter hmotnostního spektra, citlivost a jednoznačnost stanovení pomocí MS roste. Navíc jsou získány další informace o fyzikálně chemických vlastnostech metabolitů.
Kapilární elektroforéza –hmotnostní spektrometrie
Kapilární elektroforéza (CE) v kombinaci s MS (CE-MS = capillary electrophoresis-mass spectrometry) využívá separace jednotlivých metabolitů před vstupem do MS podle jejich náboje a velikosti v silném elektrickém poli. Umožňuje analýzu širokého spektra látek od anorganických iontů až po velké proteiny bez složité přípravy vzorku, která by byla nutná při využití jiné analytické metody. Významnou předností CE je možnost analýzy minimálního objemu vzorku (dávkuje se několik nanolitrů), jednoduchá instrumentace a snadná miniaturizace.
Kapalinová chromatografie – hmotnostní spektrometrie
Kapalinová chromatografie (LC) v kombinaci s MS (LC-MS = liquid chromatography-mass spectrometry)se využívá k stanovení metabolitů v biologických tekutinách, které nejsou těkavé a při vyšších teplotách podléhají rozkladu. V principu je založena na rozdílné interakci separovaných látek s pevnou fází a je využitelná pro stanovení látek v širokém rozsahu molekulových hmotností – od jednoduchých sacharidů, aminokyselin až po proteiny a fosfolipidy [4]. Efektivita stanovení se díky neustálému vylepšování instrumentace zvyšuje, a tak se můžeme setkat například s novým pojmem ultra-vysokoúčinná kapalinová chromatografie (UHPLC = ultra-high performance liquid chromatography).
Plynová chromatografie –hmotnostní spektrometrie
Plynová chromatografie s MS (GC-MS = gas chromatography-mass spectrometry) nachází uplatnění při stanovení tepelně stabilních látek, které je možné převést do plynné fáze. Mnohé metabolity tyto požadavky nesplňují, a proto se chemicky upravují – derivatizují. To se odráží na pracné a časově náročné úpravě vzorku. Z těchto důvodů je využívána především při analýze sekundárních metabolitů u rostlin, které zmíněné podmínky splňují [4].
Spektroskopie
Spektroskopické metody je možné rozdělit na ne-optickou, jakou je nukleární magnetická rezonance (NMR), a na optickou spektroskopii. Optická spektroskopie využívá interakci vzorku s elektromagnetickým zářením – jeho absorpci, emisi nebo disperzi. Zařízení pro optickou spektroskopii jsou v porovnání s přístroji pro NMR a MS jednodušší a robustnější.
Spektroskopie nukleární magnetické rezonance
Spektroskopie nukleární magnetické rezonance (NMR = nuclear magnetic resonance) je metoda, která využívá magnetických vlastností atomových jader, jejich orientaci v magnetickém poli a interakci s radiofrekvenčním zářením. Na základě NMR spektroskopie lze určit složení a struktury molekul ve vzorku a jejich množství. Moderními metodami NMR spektroskopie lze zjistit i prostorovou strukturu menších proteinů. Umožňuje analýzu biologických materiálů bez jejich destrukce, a tak může být tentýž vzorek následně analyzován jinými analytickými technikami. Dává podrobné kvalitativní a kvantitativní údaje o analyzovaném vzorku. Zařízení jsou velmi nákladná, stanovení je časově náročné a vyžaduje zkušený tým pracovníků.
Spektroskopie infračerveného záření s Fourierovou transformací
Princip FT-IR (Fourier transformation infrared spectroscopy) využívá vibrací chemických vazeb (např. ohýbání a natahování). Při absorpci elektromagnetickému záření molekulou se zvýší vibrační energie. Energie absorbovaného záření je charakteristická pro určité funkční skupiny, které se nacházejí v molekule stanovované látky (např. OH, CH3, NH2 aj.) a odráží tak chemickou strukturu. Spektra, tedy závislost absorbance na energii elektromagnetického záření (oblast vlnových délek 2500 – 25 000 nm), jsou následně vyhodnocena. Multivariační analýzou jednotlivých vrcholů záznamu a jejich porovnání s referenčními záznamy jednotlivých známých látek umožňuje jejich identifikaci. FT-IR spektroskopie je schopna analyzovat sacharidy, polysacharidy, aminokyseliny, lipidy, mastné kyseliny i proteiny. Citlivost a specifita nedosahuje hodnot, jaké nabízí MS, velkou výhodu je ale možnost analýzy velkého počtu vzorků v krátkém čase. Analýza vodných roztoků je však ztížena silnou absorpcí infračerveného záření vodou.
Spektroskopie záření blízkého infračervenému
Spektroskopie záření blízkého infračervenému (NIR = near infrared spectroscopy) se odlišuje od FT-IR v tom, že především zachycuje vibrační frekvence funkčních skupin v pásmu vlnových délek 700–2500 nm. Byla s výhodou použita pro detekci laktátu. Zařízení je v porovnání s ostatními IR spektrometry jednodušší a levnější. Citlivost stanovení je ale nižší a k vyhodnocení je potřeba využít multivariační analýzy.
Ramanova spektroskopie
Ramanova spektroskopie (RS = Raman spectroscopy) využívá laserový paprsek, který vyvolává změny vibrací molekulárních vazeb. Analýzou záření vycházejícího z laserem ozářeného vzorku je možné stanovit velikost absorpce a její souvislost s vibračními frekvencemi. V porovnání se spektry FT-IR spektroskopie RS detekuje především symetrické vibrace.
Kapilární elektroforéza s bezkontaktní vodivostní detekcí
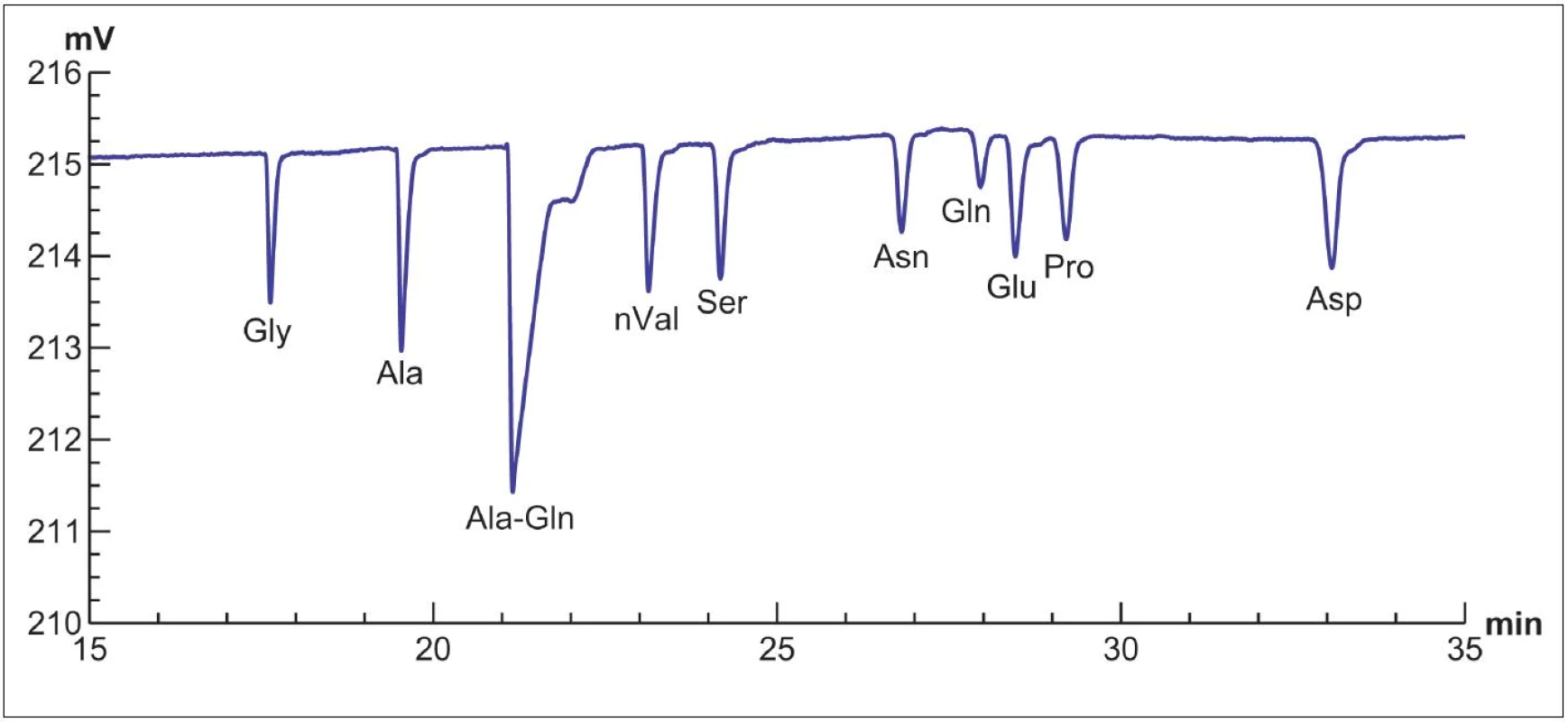
Zajímavou alternativou pro metabolomické studie je kombinace CE s bezkontaktní vodivostní detekcí (CCD = contactless conductivity detection) [12]. Kombinace je velice atraktivní přednostmi CE a univerzálností CCD. CE-CCD byla úspěšně použita pro stanovení aminokyselin v různých vzorcích [2]. Naše centrum spolupracuje s vědeckou skupinou prof. Zdeňka Glatze, která se v současnosti zaměřuje na její využití pro analýzu po-užitých kultivačních médií v asistované reprodukci. Ve výsledku by měla poskytovat informace o metabolické aktivitě embrya, a podpořit tak výběr embrya s nejvyšším implantačním potenciálem. Cílem vývoje je vytvoření rychlé a robustní metody CE-CCD tak, aby mohla být rutině používána v embryologických laboratořích. Pro ilustraci je na obr. 1 vyobrazen záznam CCD získaný po separaci kultivačního média pomocí CE. Pro analýzu je zapotřebí použít pouze 25 µl kultivačního média, které může být analyzováno opakovaně.
DISKUSE
První klinické studie neinvazivního stanovení metabolomu média po kultivaci embryí prokázaly korelaci mezi zjištěným profilem a dosažením klinického těhotenství. Pro analýzu byla nejčastěji využita metoda NIR.
Výsledky studií však zatím přinášejí rozporné výsledky, což je vzhledem ke komplexnosti metabolické aktivity embryonálních buněk, rozdílným analytickým metodám a uspořádání studií pochopitelné. Při analýzách metabolismu pyruvátu bylo prokázáno, že zvýšený příjem pyruvátu embryem koreluje s jeho vývojem do stadia blastocysty [1]. V multicentrických studiích bylo také prokázáno, že metabolický profil kultivačního média embrya je nezávislý na morfologii a v kombinaci s morfologickým hodnocením embrya umožňuje výběr embryí s vyšším implantačním potenciálem [13, 16]. V prospektivních randomizovaných studiích však analýza metodou NIR nepřinesla očekávané výsledky [6, 14, 17].
V souvislosti s hledáním metod výběru nejlepšího embrya a jeho úskalím je poučné zmínit PGS (preimplantation genetic screening). Právem se očekávalo, že selekcí a transferem embrya, v jehož blastomeře nebyla prokázána aneuploidie chromozomů, se výrazně zlepší výsledky léčby. Randomizované studie však neprokázaly přínos, mnohé prokázaly signifikantní pokles počtu dosažených těhotenství. V závěrech meta-analýzy randomizovaných studií v roce 2011 uvádějí autoři: „v současné době neexistuje důkaz o přínosu PGS pro zvýšení počtu živě narozených dětí po IVF. U žen vyššího věku PGS signifikantně počet živě narozených dětí snižuje“ [10]. Příčinou je především mozaicismus jednotlivých blastomer. Z těchto důvodů provádění PGS nedoporučuje ani „ESHRE PGD Consortium“ ve svém rozboru desetiletého sběru dat [7]. Alternativou velmi nákladné PGS by mohl být neinvazivní monitoring embryonálního vývoje s predikcí výskytu chromozomálních anomálií [8]. Hledání cest pro selekci optimálně životaschopného embrya tak pokračuje [3, 15, 19].
ZÁVĚR
Podrobná a spolehlivá analýza biologických markerů životaschopnosti embrya představuje novou informaci o schopnosti jeho implantace a dosažení těhotenství. Analýza kultivačního média kapilární elektroforézou patří ke slibným metodám analýzy metabolomu. Rozsáhlý výzkum přináší nové poznatky, které by ve svém výsledku měly vést k vytvoření klinicky použitelné metody pro výběr embrya a zvýšení efektivity transferu jednoho embrya.
Poděkování
Práce byla připravena s podporou Grantové agentury České republiky (projekt P206/11/0009).
Adresa pro korespondenci:
Doc. MUDr. Igor Crha, CSc.
Gynekologicko-porodnická klinika LF MU a FN Brno
Obilní trh 11
602 00 Brno
e-mail: icrha@fnbrno.cz
Zdroje
1. Botros, L., Sakkas, D., Seli, E. Metabolomics and its application for non-invasive embryo assessment in IVF. Mol Hum Reprod, 2008, 14, 12, p. 679–690.
2. Coufal, P., Zuska, J., van de Goor, T., et al. Separation of twenty underivatized essential amino acids by capillary zone electrophoresis with contactless conductivity detection. Electrophoresis, 2003, 24, p. 671–677.
3. Crha, I., Konečná, H., Žáková, J., et al. Proteom seminální plazmy u mužů s azoospermií. Prakt Gyn, 2011, 15, 2, s. 2–5.
4. Dunn, WB. Current trends and future requirements for the mass spectrometric investigation of microbial, mammalian and plant metabolomes. Phys Biol, 2008, 5, p. 1–24.
5. Fiehn, O. Metabolomics – the link between genotypes and phenotypes. Plant Mol Biol, 2002, 48, p. 155–171.
6. Hardarson, T., Ahlström, T., Rogberg, L., et al. Non-invasive metabolomic profiling of day 2 and 5 embryo culture medium: a prospective randomized trial. Hum Reprod, 2011, 27, p. 89–96.
7. Harper, JC., Wilton, L., Traeger-Synodinos, J., et al. The ESHRE PGD Consortium: 10 years of data collection. Hum Reprod Update, 2012, 18, 3, p. 234–247.
8. Hlinka, D., Lazarovská, S., Rutarová, J., et al. Non-invasive monitoring of the timing of early embryo cleavages-objectively measurable predictor of human embryo viability. Čes Gynek, 2012, 77, 1, s. 52–57.
9. Katz-Jaffe, MG., Schoolcraft, WB., Gardner, DK. Analysis of protein expression (secretome) by human and mouse preimplantation embryos. Fertil Steril, 2006, 86, p. 678–685.
10. Mastenbroek, S., Twisk, M., van der Veen, F., Repping, S. Preimplantation genetic screening: a systematic review and meta-analysis of RCTs. Hum Reprod Update, 2011, 17, 4, p. 454–466.
11. Musilová, J., Sedláček, V., Kučera, I., Glatz, Z. Capillary zone electrophoresis with field enhanced sample stacking as a tool for targeted metabolome analysis of adenine nucleotides and coenzymes in Paracoccus denitrificans. J Sep Sci, 2009, 32, p. 2416–2420.
12. Opekar, F., Štulík, K. Elektrochemická detekce s elektrodami mimo roztok – znovuzrození bezkontaktních impedančních metod. Chem Listy, 2010, 104, s. 1148–1154.
13. Seli, E., Botros, L., Sakkas, D., Burns, DH. Non-invasive metabolomic profiling of embryo culture media using proton NMR correlates with reproductive potential of embryos in women undergoing in vitro fertilization. Fertil Steril, 2008, 90, p. 2183–2189.
14. Seli, E., Bruce, C., Botros, L., et al. Receiver operating characteristic (ROC) analysis of day 5 morphology grading and metabolomics viability score on predicting implantation outcome. J Assist Reprod Genet, 2011, 28, p. 137–144.
15. Svobodová, M., Oborná, I., Fingerová, H., et al. Comparison of reactive oxygen species production in neat semen and washed spermatozoa. Čes Gynek, 2009, 74, 6, s. 399–403.
16. Vergouw, CG., Botros, LL., Roos, P., et al. Metabolomic profiling by near-infrared spectroscopy as a tool to assess embryo viability: a novel, non-invasive method for embryo selection. Hum Reprod, 2008, 23, p. 1499–1504.
17. Vergouw, CG., Kieslinger, DC., Kostelijk, H., et al. Day 3 embryo selection by metabolomic profiling of culture medium with near-infrared spectroscopy as an adjunct to morphology: a randomized controlled trial. Hum Reprod, 2012, p. 1–8.
18. Villas-Boas, SG., Hojer-Pedersen, J., Akesson, M., et al. Global metabolite analysis of yeast: evaluation of sample preparation methods. Yeast, 2005, 22, p. 1155–1169.
19. Žáková, J., Lousová, E., Crha, I., et al. PICSI – selekce zralých spermií pro oplození lidských oocytů metodou ICSI. Prakt Gyn, 2010, 14, 4, s. 180–183.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2012 Číslo 6
-
Všechny články tohoto čísla
- Editorial
- Úloha leptinu v lidské reprodukci (anorexie, bulimie)
- Dehiscencia laparotómie po hysterektómii – manažment hojenia rany
- Výskyt infekcie u novorodencov SAG pozitívnych matiek v závislosti na peripartálnej antibiotickej profylaxii a spôsobe pôrodu
- Možnosti ultrazvukové predikce placenta accreta v klinické praxi
- Nové technologie a perspektivy analýzymetabolomu embrya
- 3D MR-based brachyterapie v léčbě lokálně pokročilého karcinomu děložního hrdla – časné klinické výsledky
- Moderní chirurgická a biologická léčba karcinomu prsu
- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Subjektivní hodnocení vlastního zdraví a jeho souvislosti. Populační studie gravidních žen v Brně
- Follow-up po léčbě karcinomu ovaria –opravdu bez Ca 125?
- Srovnání vybraných parametrů oxidačního stresu ve folikulární tekutině u žen s poruchou plodnosti a u zdravých fertilních dárkyň oocytů
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
- Jak dál s naším porodnictvím?
- Bezpečnost domácích porodů a medicína založená na důkazech
- Domácí porody v České republice
-
Pracovní komise pro porodnictví MZ ČR
PROHLÁŠENÍ ODBORNÝCH SPOLEČNOSTÍ
(Péče o matku a dítě) - Část zápisu z jednání výboru ČGPS ČLS JEP
-
PETICE
dle čl. 18 Listiny základních práv a svobod a zákona č. 85/1990 Sb.o právu petičním - Štruktúrny základ transportnej funkcie vajíčkovodu
- Postižení vývoje dětí s nízkou porodní hmotnostíve 24 měsících korigovaného věku, narozených v České republice v letech 2000–2009
- Porody dětí velkých hmotností ve Fakultní nemocnici v Olomouci (1993–2010)
- Endovaskulární léčba krvácení v souvislostis porodem a těhotenstvím
-
Rychle progredující tumor dělohy
kazuistika - Doporučení k předpisu kombinované hormonální antikoncepce
- Vzpomínka na prim. MUDr. J. Šráčka
- Obsahový rejstřík
- Rejstřík autorů
- Věcný rejstřík
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Domácí porody v České republice
- Doporučení k předpisu kombinované hormonální antikoncepce
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
